Распределение электронов в атоме по состояниям.
Если тождественные частицы имеют одинаковые квантовые числа, то их волновая функция симметрична относительно перестановки чисел. Отсюда следует, что два одинаковых фермиона, входящих в одну систему, не могут находиться в одинаковых состояниях, так как для фермионов волновая функция должна быть антисимметричной. Обобщая опытные данные, В. Паули сформулировал принцип, согласно которому системы фермионов, встречаются в природе только в состояниях, описываемых антисимметричными волновыми функциями (квантово-механическая формулировка принципа Паули).
Из этого положения вытекает более простая формулировка принципа Паули: в системе одинаковых фермионов любые два из них не могут одновременно находиться в одном и том же состоянии, т.е. в одном и том же атоме не может быть более одного электрона с одинаковым набором четырех квантовых чисел n, l, ml и ms, т.е. число электронов Z(n, l, ml, ms) = 0 или 1. Отметим, что число однотипных бозонов, находящихся в одном и том же состоянии, не лимитируется.
Таким образом, принцип Паули утверждает, что два электрона, связанные в одном и том же атоме, различаются значениями по крайней мере одного квантового числа.
Максимальное число электронов, находящихся в состояниях, определяемых данным квантовым числом, равно:
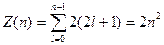
Совокупность электронов в многоэлектронном атоме, имеющих одно и то же главное квантовое число n, называют электронной оболочкой. В каждой из оболочек электроны распределяются по подоболочкам, соответствующих данному l. Поскольку орбитальное квантовое число принимает значения от 0 до l – 1, число подоболочек равно порядковому номеру оболочки n. Количество электронов в подоболочке определяется магнитным и магнитным спиновым квантовыми числами: максимальное число электронов в подоболочке с данным l равно 2(2l + 1).