НАЙПРОСТІШІ СТЕХІОМЕТРИЧНІ РОЗРАХУНКИ
Мета вивчення теми:
робити розрахунки по хімічних формулах і рівняннях, що пов'язані з визначенням:
- процентного складу речовини;
- кількості продуктів реакції по заданих кількостях вихідних речовин;
- кількості вихідних речовин по заданих кількостях продуктів реакції;
- кількості речовини, що залишилася в надлишку.
Відношення мольних кількостей, мас і об¢ємів речовин, що відповідають рівнянню даної реакції, називають стехіометричними співвідношеннями, а кількісні розрахунки за формулами та рівняннями - стехіометричними розрахунками.
В основі всіх кількісних розрахунків лежить закон збереження маси, встановлений М.В.Ломоносовим: маса речовин, що вступають у реакцію, дорівнює масі продуктів реакції. Тому можна знайти невідому масу однієї з взаємодіючих речовин.
Приклад 1. Карбонат кальцію розкладається при нагріванні на СаО і CO2. Яка маса природного вапняку, що містить 90 % (мас.) СаСО3 буде потрібна для одержання 7 т негашеного вапна СаО ?
Розв’язання. Запишемо рівняння реакції розкладу карбонату кальцію:
СаСО 3 ® СаО + CO 2.
Визначимо кількість речовини СаO, що міститься в 7 т негашеного вапна:
n(СаO) = m(СаO)/М(СаO), де m (СаO) - маса оксиду кальцію (негашеного вапна), г;
М(СаO) - молярна маса негашеного вапна, г/моль;
М(СаO)= 40+16= 56 г/моль.
 n(СаО) = 7× 106 ¤ 56= 1,25 ×105 моль.
n(СаО) = 7× 106 ¤ 56= 1,25 ×105 моль.
Визначимо кількість речовини карбонату кальцію, необхідну для одержання 1,25·105 моль СаО. З рівняння реакції випливає, що з одного моля СаСО3 утворюється один моль СаО, тобто
n(СаСО3) = n(СаО) = 1,25 × 105 моль.
Визначимо масу 1,25×105 моль СаСО3:
m(СаСО 3) = n(СаСО 3)× М(СаСО 3).
Враховуючи, що М(СаСО 3) = 40 + 12 + 3∙16 = 100 г/моль, маємо:
m(СаСО3) = 1,25×105×100 = 1,25× 10 7 г = 12,5 т.
Така кількість карбонату кальцію буде потрібна для одержання 7 т СаО. Однак, вапняк складається із СаСО3 на 90 %. Обчислимо масу вапняку, що містить 12,5 т СаСО 3:
m(СаСО3) = m(вапняку)×w(СаСО3),
де w(СаСО3) – масова частка СаСО3 у вапняку в частках одиниці.
У такий спосіб: m(вапняку) = m(СаСО 3)/w(СаСО 3), m(вапняку) = 12,5/0,9 = 13,9 т.
Оскільки при однаковій температурі й однаковому тиску мольні об'єми будь-яких газів і парів рівні між собою, коефіцієнти в рівняннях реакцій між газоподібними речовинами вказують не тільки на співвідношення між числом реагуючих молекул (молей) і молекул (молей), що утворюються, але і на об'ємні співвідношення вихідних і кінцевих газоподібних продуктів реакції. Об'єми газів, що беруть участь у реакції, пропорційні стехіометричним коефіцієнтам у рівнянні реакції.
Приклад 2. Який об'єм кисню необхідний для каталітичного окиснення 200 л аміаку (н.у.), що протікає за рівнянням
4NH3(г) + 5O2(г) = 4NO(г) + 6H2O(г)
і який сумарний об'єм продуктів реакції?
Розв’язання. З рівняння реакції видно, що на окиснення чотирьох мольних об'ємів аміаку потрібно п'ять мольних об'ємів кисню. В зв'язку з тим, що гази знаходяться при однакових умовах, їхні мольні об'єми рівні між собою. Тоді V(NH3) : V(O2) = 4:5. Отже: V(O2) = (5/4) ∙ V(NH3). Знаходимо об'єм кисню:
V(O2) = (5¤ 4) × 200 = 250 л.
З рівняння реакції також видно, що з чотирьох об'ємів NH3 утворюються чотири об'єми NO і шість об'ємів водяної пари, разом 10 об'ємів газоподібних продуктів.
V(NH3) : V продуктів = 4:10
Звідси легко обчислити сумарний об'єм газоподібних продуктів, що утворюються з 200 л NH3 :
V продуктів = (10 ¤ 4) ∙ V(NH3) = (10 ¤ 4) ∙ 200 = 500 л.
При проведенні розрахунків по рівняннях гетерогенних реакцій доцільно виражати кількості твердих речовин в одиницях маси, а кількості газоподібних – відразу в одиницях об'єму. Тоді по рівнянню реакції встановлюють співвідношення мас і об'ємів.
Приклад 3. Який об'єм при 1270С и тиску 121,56 кПа диоксиду сірки отримано при випалі 1 т залізного колчедану, що містить 90 % FeS2?
Розв’язання. Складемо рівняння реакції випалу FeS2:
4FeS2 +11O2 = 2Fe2O3 + 8 SO2
Знайдемо масу FeS2, що міститься в 1 т залізного колчедану: m(FeS2) = m(колчедану)×w(FeS2) . Враховуючи, що m(колчедану)=1 т, а w(FeS2)= 0,9, маємо: m(FeS2)=1×0,9 =0,9 т.
Визначимо кількість речовини, що міститься в 0,9 т FeS2:
n(FeS2) = m(FeS2)/M(FeS2), де M(FeS2) – молярна маса FeS2, що дорівнює 119,9 г/моль.
n(FeS2) = 0,9×106/119,9 = 7,51×103 моль.
З рівняння реакції випливає, що з 4 моль FeS2 утворюється 8 моль SO2 , тобто
n(SO2) : n(FeS2) = 8 : 4 = 2:1 і
n(SO2) = 2n(FeS2) = 2 ×7,51×103 = 1,5×104 моль.
Знаходимо об'єм SO2, що утворюється за нормальних умов (Vо):
Vо(SO2) = n(SO2) ×Vm = 1,5×104 × 22,4 = 3,36×105 л = 336 м3 .
Приведемо об'єм диоксиду сірки до заданих умов, скориставшись рівнянням об'єднаного газового закону:
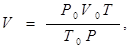
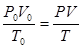 і
і
де усі величини з нижніми індексами “0” відповідають нормальним умовам.
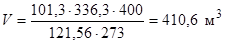
Якщо в умові задачі задані кількості двох або більшого числа вихідних речовин, то всі розрахунки проводять по тому з учасників реакції, що знаходиться в недостачі, тому що саме цей реагент цілком вступає в реакцію.
Приклад 4. Змішали 7,30 г HCl з 4,00 г NH3. Скільки грамів NH4Cl може утворитися? Знайти масу газу, що залишається після реакції.
Розв’язання. Складемо рівняння реакції утворення NH4Cl:
NH3 + HCl = NH4Cl
Перевіримо, чи в стехіометричному співвідношенні взяті вихідні речовини. Для цього знайдемо кількість речовини n кожного з реагентів:
n(HCl) = m(HCl) / M(HCl) = 7,30 / 36,5 = 0,200 моль;
n(NH3) = m(NH3) / M(NH3) = 4 / 17 = 0,235 моль.
З рівняння реакції випливає, що 1 моль HCl взаємодіє з
1 моль NH3, а кількості молей, задані в умові задачі, відносяться як 0,2 : 0,235. Отже, HCl може цілком вступити в реакцію, а NH3 залишиться в надлишку. Значить, всі розрахунки повинні проводитися по HCl. Знайдемо кількість речовини NH4Cl, що утворюється. По рівнянню реакції: n(NH4Cl) = n(HCl) = 0,2 моль.Тоді маса продукту m(NH4Cl) =
= n(NH4Cl)×M(NH4Cl) = 0,2×53,5 = 10,7 г. Обчислимо кількість речовини аміаку, що залишилась після реакції Dn(NH3):
Dn(NH3) = n(NH3) - n'(NH3),
де n'(NH3)–кількість речовини аміаку, що вступила у реакцію, n'(NH3) = n(HCl) = 0,2 моль, Dn(NH3) = 0,235-0,2 = 0,035 моль.
Знаходимо масу надлишкової кількості аміаку Dm(NH3):
Dm(NH3) = Dn(NH3) × M(NH3) = 0,035×17 = 0,6 г.