ЕКВІВАЛЕНТИ ПРОСТИХ ТА СКЛАДНИХ РЕЧОВИН
Мета вивчення теми :
- розраховувати еквіваленти та молярні маси еквівалентів простих речовин, оксидів, кислот, основ і солей;
- використовувати закон еквівалентів в розрахунках за хімічними формулами та рівняннями.
Еквівалент визначають як реальну або умовну частинку, яка реагує (тобто приєднує, визволяє або обмінює) з одним іоном водню. Під умовною розуміємо якусь частку реальної частинки.
Еквівалент в окисно-відновних реакціях (ОВР) – це реальна або умовна частинка, яка приєднує або віддає один електрон.
Число, яке показує, яка частка молекули реагує (еквівалентна) з одним іоном водню в даній кислотно-основній реакції або з одним електроном в даній окисно-відновній реакції, називається фактором еквівалентності f, який розраховується за формулою:
f = 1/z (1)
В обмінних реакціях z дорівнює абсолютній величині сумарного заряду іонів, які інший реагент обмінює з даною речовиною .
В окисно-відновних реакціях z дорівнює кількості електронів, які приймає (віддає) одна частинка окисника (відновника).
Еквівалент речовини В записують так:
Е(В) = f× В,
де В – хімічна формула речовини, а еквівалент катіона В+ або аніона В- виражають як:
Е(В) = f В+,
Е(В) = f В-,
де В+ чи В- - формули іонів.
Приклад 1. Розрахувати фактори еквівалентності і еквіваленти оксиду алюмінію в реакціях: а) з сірчаною кислотою з утворенням середньої солі; б) з гідроксидом натрію з утворенням метаалюмінату.
Розв’язання. а) Реакція обміну здійснюється за рівнянням:
Al2O3 + 3H2SO4 ® Al2(SO4)3 + 3H2O
З рівняння видно, що одна "молекула" Al2O3 реагує з шістьма іонами водню з утворенням води. Робимо висновок, що одному іону водню еквівалентна шоста частина молекули Al2O3, це означає, що f(Al2O3)=1/6. До такого ж висновку можна прийти в результаті іншого міркування. Три сульфат-іони SO42- (які еквівалентні шістьом іонам водню) обмінюють у "молекулі" Al2O3 три іони кисню. Сумарний заряд трьох сульфат-іонів дорівнює шести (як і сумарний заряд трьох іонів О2-). Тоді згідно з формулою (1), f(Al2O3)=1/6, тоді Е(Al2O3)=1/6 Al2O3.
б) Al2O3 + 2NaOH ® 2NaAlO2 + H2O
Це обмінна реакція. Одна "молекула" Al2O3 реагує з двома гідроксид-іонами, еквівалентними двом іонам водню. Тому одному іону водню еквівалентна половина молекули Al2O3 і тоді: f (Al2O3)=1/2, а Е(Al2O3)=1/2 Al2O3.
Якщо реакція, в якій приймає участь оксид, невідома, то за його формулою звичайно визначають найменше значення фактора еквівалентності:
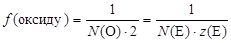
де N(О) і N(Е) – відповідно кількість атомів кисню і елемента в формулі оксиду, а 2 і z(E) – заряди іонів кисню і елемента. Наприклад, для Al2O3 за його формулою:
f = 1/6, а Е(Al2O3) = 1/6 Al2O3
Приклад 2. Обчислити еквівалент і фактор еквівалентності фосфорної кислоти в реакції:
Н3PO4 + 2NaOH ® Na 2HPO4 + 2H2O
Розв’язання. З рівняння реакції видно, що в кожній молекулі Н3PO4 два іони водню обмінюються на два іони натрію. Сумарний заряд іонів водню, що обмінюються, дорівнює двом (так само, як і сумарний заряд іонів натрію). Згідно з формулою (1): f(Н3PO4)=1/2, Е(Н3PO4)=1/2 Н3PO4.
Кількість атомів водню в молекулі кислоти, що обмінюються на основні залишки, називається основністю кислоти. Для розрахунку фактора еквівалентності кислоти використовується формула:
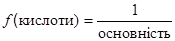
В реакції, що розглядається, основність фосфорної кислоти дорівнює двом (два атоми водню обмінюються на два основних залишки Na+) і f(Н3PO4)=1/2,а Е(Н3PO4)= =1/2 Н3PO4.
Одноосновні кислоти мають одне значення еквівалента, що у всіх реакціях за їх участю співпадає з їх молекулами.
Приклад 3. Розрахувати фактор еквівалентності і еквівалент гідроксиду кальцію в реакції:
Ca(OH)2 + HCI ® CaOHCl + H2O
Розв’язання. В кожній молекулі Са(ОН)2 тільки один гідроксид-іон, заряд якого дорівнює одиниці, обмінюється в цій реакції на хлорид-іон. За формулою (1): f(Са(ОН)2) = 1.
Кількість гідроксид-іонів в молекулі основи, що обмінюються на кислотні залишки, називається кислотністю основи:
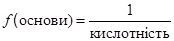
У тій реакції, що розглядається, в молекулі Са(ОН)2 тільки один гідроксид-іон обмінюється на хлорид-іон, тому кислотність Са(ОН)2 дорівнює одиниці:
f(Са(ОН)2) = 1; Е(Са(ОН)2) = Са(ОН)2.
Однокислотні основи теж мають одне значення еквівалента в усіх реакціях за їх участю. Так, еквівалент гідроксиду натрію завжди дорівнює його молекулі.
Приклад 4. Розрахувати фактор еквівалентності і еквівалент Na2CO3.
Розв’язання. Оскільки не задана реакція за участю цієї солі двохосновної кислоти, то визначити конкретний вираз еквівалента неможливо. У цьому випадку звичайно вказують найменше значення фактора еквівалентності:
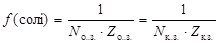
 (2)
(2)
де Nо.з. і Nк.з. – кількості основних і кислотних залишків, Zо.з. і Zк.з. – заряди основних і кислотних залишків.
Згідно з формулою, що наведена вище:
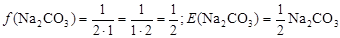
Приклад 5. Розрахувати фактори еквівалентності і еквіваленти Na2CO3 в реакціях з соляною кислотою з утворенням кислої солі та вуглекислоти.
Розв’язання. а) Кисла сіль утворюється при еквімолярному (1:1) співвідношенні реагентів:
Na2CO3 + HCI ® NaHCO3 + NaCI
До кислотного залишку солі Na2CO3 приєднується один іон водню. Фактор еквівалентності дорівнює одиниці і еквівалентом Na2CO3 у цій реакції є молекула: Е(Na2CO3) = =Na2CO3.
б) Вугільна кислота утворюється при співвідношенні реагентів 1: 2 :
Na2CO3 + 2НCI ® H2CO3 + 2NaCI
До кислотного залишку солі приєднуються два іони водню. Одному іону водню еквівалентна половина молекули Na2CO3 і Е(Na2CO3)=1/2Na2CO3. Той же самий результат можна отримати за формулою (2). Сумарний заряд двох іонів натрію, що обмінюються, як і сумарний заряд двох іонів водню, дорівнює двом.
Приклад 6. Визначити фактори еквівалентності і еквіваленти алюмінію і кисню в реакції:
0 0 +3 -2
4AI + 3O2 ® 2AI2O3
Розв’язання. Це окисно-відновна реакція. Окисником в цій реакції є кисень. Одна молекула О2 приймає чотири електрони, тому що ступінь окиснення елемента кисню змінюється від 0 до –2. Тоді за формулою (1):
f(О2)=1/4; Е(О2) = 1/4 О2.
Отже еквівалентом кисню є умовна частинка, яка дорівнює четвертій частині його молекули. Відновником в цій реакції є алюміній. Один атом алюмінію віддає три електрони, коли ступінь окиснення змінюється від 0 до +3, тому f(Al)=1/3; E(Al)=1/3Al. Еквівалентом алюмінію є умовна частинка, яка дорівнює третій частині його молекули.
Молярна маса еквівалентів речовини Мекв – маса 1 моля еквівалентів цієї речовини. Вона дорівнює добутку фактора еквівалентності на молярну масу речовини:
Мекв = f×М,
де М – молярна маса речовини, г/моль.
Молярну масу еквівалентів можна позначати також за загальним правилом літерою М, якщо в дужках вказувати ту частинку, що є еквівалентом даної речовини. Наприклад, молярна маса еквівалентів водню позначається як М(1/2Н2), молярна маса еквівалентів кисню – М(1/4О2). Корисно пам'ятати молярні маси еквівалентів водню і кисню
М(1/2Н2) = 1г/моль, М(1/4О2) = 8г/моль.
Для газоподібних речовин застосовують поняття молярного об¢єму еквівалентів Vекв - об¢єму 1 моля еквівалентів газу. Значення цієї величини розраховується за формулою:
Vекв = f×Vm,
де Vm – молярний об¢єм газу, що за нормальних умов (0°С і 101,3 кПа) дорівнює 22,4 л/моль. Зверніть увагу, що
V(1/2Н2) = 11,2 л/моль, а V(1/4 О2) = 5,6 л/моль.
Еквівалент і молярна маса еквівалентів – часто величини змінні. Їх значення залежать від хімічної природи сполук і від реакцій за їх участю. З цієї причини про молярну масу еквівалентів елемента можна говорити, розглядаючи лише конкретну сполуку, а про молярну масу еквівалентів сполуки – конкретну реакцію, у якій вона приймає участь.
Кількість речовини еквівалентів nекв можна обчислити за загальними правилами, виходячи із маси речовини, або об¢єму газу за нормальних умов:
nекв= m/Mекв або nекв= V/Vекв
Приклад 7. Розрахуйте кількість речовини еквівалентів: а) в 10 г Н2; б) в 44,8 л (н.у.) Н2.
Розв’язання. Використовуючи наведені вище формули обчислимо:
а) 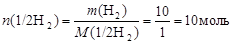 і
і
б) 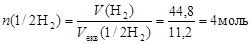
В хімічних розрахунках часто використовують закон еквівалентів:
Кількість молей еквівалентів всіх речовин, які беруть участь у реакції, однакова.
Для реакції аА + вВ ® сС + дД математичний вираз закону еквівалентів має вигляд:
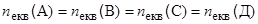
Підставляючи замість nекв вираз для кількості речовини через масу або об¢єм, отримуємо ще два вирази для закону еквівалентів:

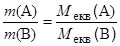 і
і 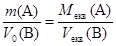
Перше із цих рівнянь дозволяє дати таке формулювання: маси речовин, що приймають участь у реакції, співвідносяться як молярні маси їх еквівалентів.
Приклад 8. Визначте фактори еквівалентності і еквіваленти усіх речовин, що беруть участь в реакції
Na2O + H2O ® 2NaOH
Розв’язання. При розв’язанні такої задачі зручно записувати усі викладки рядками під рівнянням реакції.
Розв’язок має вигляд:
Na2O + H2O ® 2NaOH
n(молекул) 1 1 2
n(еквівалентів) 2 2 2
f ½ ½ 1
E 1/2Na2O 1/2H2O NaOH
У першому рядку проставляємо кількості молекул, що приймають участь у реакції. Ці кількості дорівнюють коефіцієнтам в рівнянні реакції.
У другому рядку записуємо числа еквівалентів речовин. Однокислотна основа NaOH має постійний еквівалент у всіх реакціях. Її фактор еквівалентності f =1 і еквівалент Е = NaOH записуємо у третьому і четвертому рядках. Оскільки в цій реакції беруть участь дві молекули NaOH, а еквівалентом є одна молекула, то в реакції приймають участь два еквіваленти NaOH. Цю цифру записуємо у другому рядку.
Інші речовини, наприклад вода, в різних реакціях мають неоднаковий еквівалент. Але в даній реакції, за законом еквівалентів, числа еквівалентів усіх речовин однакові і дорівнюють двом.
Для знаходження факторів еквівалентності і еквівалентів Na2O і Н2О звернемо увагу, що в реакції приймають участь по одній молекулі і по два еквіваленти кожної з цих речовин, отже еквівалентом їх є половина молекули, а f = 1/2.
Приклад 9. Метал масою 98,1 г при взаємодії з кислотою витискує 33,6 л водню, виміряного за нормальних умов. Визначте молярну масу еквівалентів металу.
Розв’язання. Згідно з законом еквівалентів:
nекв(Me) = n(1/2 H2)
або після підставлення виразів числа молей через масу і об’єм
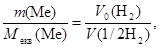
звідки:
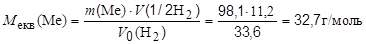
Молярна маса еквівалентів складної речовини дорівнює сумі молярних мас еквівалентів її складових частин.
Для оксидів:
Мекв(оксиду) = Мекв(елемента) + М(1/4 О2)
або
Мекв(оксиду) = Мекв(елемента) + 8
Для кислот:
Мекв(кислоти) = М(1/2 Н2) + Мекв(кислотного залишку)
або
Мекв(кислоти) = 1 + Мекв(кислотного залишку),
Для основ:
Мекв(основи) = Мекв(основного залишку) + Мекв(ОН-)
враховуючи, що Мекв(ОН-) = 17 г/моль
Мекв(основи) = Мекв(основного залишку) + 17
Для солей
Мекв(солі)= Мекв(осн.залишку)+Мекв(кисл.залишку)
Приклад 10. Розрахувати можливі значення молярної маси еквівалентів гідроксиду алюмінію.
Розв’язання. Згідно з формулою
Мекв(основи) = Мекв(осн.залишку) + 17
гідроксид алюмінію в різних реакціях утворює такі основні залишки: а) Al(OH)2+, б) AlOH2+ i в) Al3+. Їм відповідають такі значення молярних мас еквівалентів:
а) Мекв(Al(OH)3) = Мекв(Al(OH)2+) +17 = (27 + 2×17)/1 +17 = = 78 г/моль;
б) Мекв(Al(OH)3) = Мекв(AlOH2+) + 17 = (27 + 17)/2 +17 = = 39 г/моль;
в) Мекв(Al(OH)3) = Мекв(Al3+) + 17 = 27/3 + 17 = 26 г/моль.
ДОМАШНЄ ЗАВДАННЯ
1. Розрахуйте молярні маси еквівалентів оксиду свинцю (IV) в реакціях: PbO2 + 2H2SO4 ® Pb(SO4)2 + 2H2O
PbO2 + 2NaOH ® Na 2PbO3 + H2O
Відповідь: 59,75 г/моль; 119,5 г/моль.
2. Розрахуйте можливі значення молярних мас еквівалентів наступних речовин за їх формулами: H2SeO4, Ni(OH)2, NaHSiO3, CoOHCI, К2SO3.
Відповідь: 145 і 72,5 г/моль; 93 і 46,5 г/моль;
100 г/моль; 111,5г/моль; 79 г/моль.
3. Обчисліть молярну масу еквівалентів H2S для такої реакції: Н2S + NaOH ® NaHS + H2O. Відповідь: 34 г/моль.
4. Обчисліть молярну масу еквівалентів Cu(OH)2 для реакції: Cu(OH)2 + HCI ® CuOHCI + H2O. Відповідь: 98 г/моль.
5. Чи однакова кількість молярних мас еквівалентів і молярних об¢ємів еквівалентів міститься відповідно: а) у 230 г натрію і 200 г кальцію; б) у 33,6 л водню і у 28 л кисню.
Відповідь: а) так, по 10 молярних мас еквівалентів;
б) ні, 3 і 5 молярних об¢ємів еквівалентів відповідно.
6. Визначте фактори еквівалентності, еквіваленти і молярні маси еквівалентів всіх речовин, які беруть участь у реакції:
AI2O3 + 6HCI ® 2AICI3 + 3H2O
Відповідь:1/6, 1/6 AI2O3, 17 г/моль; 1, HCI, 36,5 г/моль;
1/3,1/3 AICI3, 44,5 г/моль; 1/2, 1/2Н2О, 9 г/моль.
7. Мідь утворює два оксиди, в одному з яких масова доля міді 88,9%, а в другому – 80%. Визначте молярні маси еквівалентів міді в обох оксидах.
Відповідь: 64 г/моль, 32 г/моль.
8. Для розчинення 8,4 г металу потрібно 7,35 г сірчаної кислоти (реакція протікає з повним витисненням водню з сірчаної кислоти). Визначте молярну масу еквівалентів металу і об¢єм водню, який виділяється.
Відповідь:56 г/моль; 1,68 л.
9. 2,6 г гідроксиду металу обробили сірчаною кислотою і
одержали 5,7 г сульфату.Визначте молярну масу еквівалентів металу. Відповідь: 8,74 г/моль.
10. 0,35 г двовалентного металу витиснули з кислоти 209 мл водню, який збирали при 20 0С і тиску 102,3 кПа. Визначте молярну масу еквівалентів металу і молярну масу металу. Який це метал? Відповідь: 20 г/моль, 40 г/моль, Са.
3. БУДОВА АТОМА
Мета вивчення теми:
- засвоїти основи теорії будови атома (основні ідеї квантової механіки, апарат квантових чисел електронів в атомі, принцип Паулі, правило Хунда, правила Клечковського, будова оболонок багатоелектронних атомів) ;
- складати електронні формули і графічні схеми електронних конфігурацій атомів і їх валентних оболонок у стаціонарному і збудженому станах.
Відповідно до сучасних уявлень атом являє собою складну систему з позитивно зарядженого ядра і електронів, що рухаються навколо нього, зв'язаних силами електричної взаємодії. У ядрі сили ядерної взаємодії утримують разом протони, кожний з яких несе один позитивний елементарний заряд, і електрично нейтральні нейтрони. Величина заряду ядра дорівнює (в одиницях елементарного заряду) числу протонів і, відповідно, числу електронів у нейтральному атомі. Ця величина визначає порядковий номер у періодичній системі і тим самим – хімічну індивідуальність кожного елемента.
Корисно зрозуміти і запам'ятати взаємозв'язок основних фізичних характеристик – мас m і зарядів q – складаючих атом частинок з іншими хімічними константами:
mp » mn » 1/ NA = 1/ 6,02×1023 = 1,67×10-24 г = 1,67×10-27 кг.
mē = 1/1840 × mp = 9,1×10-28 г = 9,1×10-31 кг.
|qē | = | qp| = F/NA = 96500 / 6,02×1023 = 1,60×10-19 Кл.
Тут: NA= 6,02×1023 моль-1– число Авогадро; F = 96500 Кл/моль – число Фарадея (заряд одного моля електронів).
Розмір атома за порядком величини дорівнює 10-8см = =0,1нм = 1Å. Розмір ядра приблизно в 105 разів менший розміру атома, однак у ядрі зосереджено понад 99,95 % всієї атомної маси.
Стан електрона в атомі підкоряється законам квантової механіки, яка вивчає рух і взаємодію мікрочастинок. За уявленнями квантової механіки мікрочастинки мають хвильову природу, а хвилі мають загальні властивості із частинками. Це означає, що будь-який мікрооб'єкт поводиться і як локалізована частинка, і як розмита по простору хвиля. Ця властивість називається корпускулярно-хвильовим дуалізмом (подвійністю). Динамічні перемінні, що характеризують частинки (енергія Е и імпульс p = mv, де v – швидкість) і хвилі (довжина хвилі l і частота n) пов'язані через постійну Больцмана h (h = 6,63×10-34 Дж×с): E = h×n,
l = h/р.
Не можна одночасно точно визначити положення в просторі й імпульс (швидкість) мікрочастинки. Цей факт визначається співвідношенням невизначеностей Гейзенберга:
Dх × Dр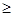 h/2p ,
h/2p ,