рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Открытие периодического закона дало Менделееву основу для системы классификации химических элементов и созданию Периодической системы
Реферат Курсовая Конспект
Открытие периодического закона дало Менделееву основу для системы классификации химических элементов и созданию Периодической системы
Открытие периодического закона дало Менделееву основу для системы классификации химических элементов и созданию Периодической системы - раздел Химия, Периодического Закона...
Периодического закона
Периодический закон был открыт. Менделеевым в 1869 г. современная формулировка периодического закона: –
Свойства элементов, а также свойства образуемых ими простых и сложных веществ находятся в периодической зависимости от величины заряда ядер их атомов.
Открытие периодического закона дало Менделееву основу для системы классификации химических элементов и созданию Периодической системы.
До Д.И. Менделеева некоторые ученые делали попытки систематизации химических элементов. Они объединяли элементы со сходными свойствами в группы, однако группы элементов рассматривались изолированно друг от друга.
Менделеев смог создать объективную основу для классификации элементов. Этой основой оказалась атомная масса химических элементов, которая в то время была изучена. Он расположил известные в то время 63 элемента в порядке возрастания их атомных масс и обратил внимание на то, что в рядах через определенное число элементов их свойства периодически повторяются.
Расположив столбцами группы элементов, Менделеев обнаружил сходство элементов друг с другом. При этом были учтены не только физические и химические свойства соответствующих простых веществ, но также формы (формулы) их оксидов, гидроксидов и других соединений. В результате чего, Менделеев получил таблицу, выражающую периодичность изменения свойств элементов и их соединений - Периодическую таблицу,в которой каждый элемент занимал определенное место.
В настоящее время известно 109 химических элементов. Периодическая система состоит из семи периодов, расположенных в таблице горизонтально, и восьми групп, расположенных вертикально.
Строение атома
В 1913 г. английский физик Г. Мозлиустановил, что заряд ядра численно равен порядковому номеру элемента в периодической системе. Химический элемент — это множество атомов с одинаковым зарядом ядра. Самым… В состав ядер атомов других химических элементов входят протоны и нейтроны. Нейтрон — нейтральная частица, масса…Квантово-механическое описание электрона в атоме
Квантовые числа
Состояние электрона в атоме характеризуется набором четырех квантовых чисел.По энергии электроны в атоме распределяются по энергетическим уровням и подуровням.Главное. (определяет размер электронного облака)Орбитальное или побочное (определяет форму электронного облака)Магнитное. (характеризует ориентацию электронного облака в магнитном поле)Спиновое(определяет собственное движение электрона)
Атомные орбитали
атомной орбиталь-состояние электрона в атоме, характеризующееся тремя квантовыми числами n, l, ml ,область пространства, в которой наиболее вероятно нахождение электрона.
Совокупность орбиталей с одним и тем же значением главного квантового числа n образует энергетический уровень.
Вопрос 1 Формирование электронной оболочки атома
Основные закономерности заполнения электронами уровней, подуровней и орбиталей в электронной оболочке атома
Это означает, что каждый новый электрон попадает в атоме на самый низкий (по энергии) свободный подуровень. II Правило Клечковского (правило n+l).Энергия орбиталей возрастает с… Например, 3d, сумма n+l= 3+2 =5Общие представления о химической связи
1-я теорияХС возникла в н. 19 века. Берман и Бертолли выдвинули гравитационную теорию ТС, согласно к-й взаимодействие между атомами связывали с…Квантово-механическая теория химической связи
Валентность – это способность атомов образовывать химические связи.Метод молекулярных орбиталей.Типы химических связей и их свойства.
1)обменному-каждый из соединяющихся атомов имеет на валентном уровне неспаренный электрон, который он предоставляет для образования общей… 2)донорно-акцепторному-один из соединяющихся атомов предоставляет электронную… Ионная связь–связь, образующаяся между атомами, электроотрицательность которых сильно различается.В противоположность…Параметры химической связи
Энергия связи. Химическая связь возникает только в том случае, если при сближении атомов полная энергия системы понижается, т.е. энергия системы… Чем больше энергия связи, тем прочнее данная связь. Длина связи-это среднее расстояние между центрами связанных между собой атомов и соответствует минимуму энергии…III. По признаку изменения степеней окисления элементов, которые входят в состав реагирующих веществ, выделяют реакции, идущие без изменения степеней окисления элементов, и на окислительно-восстановительные (идущие с изменением степеней, окисления элементов).
1. Реакции, идущие без изменения степеней окисления элементов:
SO2 + Н2O = H2SO3; СаСО3 = СаО+СО2; A1(ОН)3 + 3HС1 = AlCl3 + 3H2O
2. Окислительно-восстановительные реакции:
Реакции, при которых изменяются степени окисления элементов, входящих в состав реагирующих веществу, называютсяокислительно-восстановительными.
IV. По признаку выделения или поглощения энергии реакции делят на экзотермические и эндотермические.
V. По признаку обратимости реакции подразделяются на две группы: необратимые и обратимые. 1) Необратимые реакции могут идти только в одном направлении и протекают до… 2) Обратимыми называются реакции, протекающие в двух противоположных направлениях: прямом и обратном.Вопрос
Раствором называется твёрдая или жидкая гомогенная физико-химическая система, состоящая из двух или более компонентов, количества которых могут изменяться в широких пределах. Гомогенной называется система, состоящая из одной фазы (например, только жидкой, только твёрдой, или только газообразной фазы). Фаза – это часть системы, отделённая от других частей этой же системы поверхностью раздела, при переходе через которую свойства изменяются скачком. Гетерогенная система состоит из нескольких фаз, отделённых друг от друга поверхностью раздела.
Примеры гомогенных систем: любая газовая смесь, раствор сахара в воде. Примеры гетерогенных систем: вода со льдом, насыщенный раствор с осадком (жидкая фаза и твёрдая фаза), угольная пыль в атмосфере (твёрдая фаза и газовая фаза), смесь песка и мела (твёрдая фаза песка и твёрдая фаза мела), смесь подсолнечного масла и воды (жидкая фаза масла и жидкая фаза воды).
Всякий раствор состоит из растворённых веществ и растворителя, т.е. среды, в которой эти вещества равномерно распределены в виде молекул или ионов. Растворителем обычно считают тот компонент, который в чистом виде существует в том же агрегатном состоянии, что и полученный раствор (например, в случае водного раствора соли растворителем является вода). Если оба компонента до растворения находились в одинаковом агрегатном состоянии (например, спирт и вода), то растворителем считается компонент, находящийся в большем количестве.
Однородность растворов делает их сходными с химическими соединениями. Выделение теплоты при растворении некоторых веществ также указывает на химическое взаимодействие между растворителем и растворяемым веществом. Отличие растворов от химических соединений состоит в том, что состав раствора может изменяться в широких пределах. Кроме того, в свойствах раствора можно обнаружить многие свойства его отдельных компонентов, чего не наблюдается в случае химического соединения. Непостоянство состава растворов сближает их с механическими смесями, но от смесей они отличаются своей гомогенностью.
Таким образом, растворы занимают промежуточное положение между механическими смесями и химическими соединениями. Наиболее важный вид растворов – жидкие растворы, которые рассматриваются далее более подробно.
Растворение кристалла твёрдого вещества в жидкости протекает следующим образом. Когда кристалл вносят в жидкость, в которой он может растворяться, от его поверхности отрываются отдельные молекулы или ионы, которые вследствие диффузии равномерно распределяются по всему объёму растворителя. Отделение молекул или ионов от твёрдого тела вызвано, с одной стороны, их собственным колебательным движением, а с другой – притяжением к молекулам растворителя. Этот процесс должен был бы продолжаться до полного растворения любого количества кристаллов, если бы одновременно не происходил обратный процесс – кристаллизация. Перешедшие в раствор молекулы или ионы, сталкиваясь с поверхностью ещё нерастворившегося вещества, снова притягиваются к нему и входят в состав его кристаллов. Выделение молекул или ионов из раствора будет происходить тем быстрее, чем больше их концентрация в растворе. Так как концентрация по мере растворения увеличивается, то наступит момент химического равновесия, когда скорость растворения равна скорости кристаллизации.
Раствор, находящийся в равновесии с растворяющимся веществом, называется насыщенным раствором.
Рис. 6.1 – Схема ион-дипольного взаимодействияВопрос
Нормальная концентрация раствора.
Эквивалентом (Э) вещества называется такое его количество, которое в химических реакциях соединяется с 1 моль атомов водорода или замещает его в соединениях.
Размерность эквивалента такая же, как и количества вещества – моль.
Например, в реакции:
2 Н2 + О2 = Н2О
1 моль атомов Н эквивалентен Ѕ моль атомов О, следовательно, Э(О)=1/2 моль.
Масса одного эквивалента вещества называется эквивалентной массой(Мэкв); размерность эквивалентной массы такая же, как молярной массы: кг/моль или г/моль. Например, МЭКВ(Н) = 1 г/моль; МЭКВ(О) = 8 г/моль.
Количество вещества эквивалента (nэкв) равно отношению массы вещества (т) к эквивалентной массе:
nэкв(Х) = т(Х)/Мзкв.
Например, если имеется 32 г кислорода, то nэкв = 32/8 = 4 моль.
Состав раствора, выраженный через количество эквивалентов растворенного вещества в одном литре раствора, называется нормальной концентрацией (сН).
Таким образом, нормальная концентрация равна отношению количества эквивалентов растворенного вещества (nэкв(Х)) в растворе к объему раствора (V):
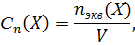
| (6) |
Единица измерения нормальной концентрации - моль/м3; для практического использования обычно служит кратная единица моль/дм3 или моль/л. В литературе встречаются разные обозначения нормальной концентрации, например для раствора серной кислоты с нормальной концентрацией 0,2 моль/л:
CН(Н2SO4) = 0,2 моль/л CН(Н2SO4) = 0,2 н
или
0,2 н. раствор Н2SO4 C(1/2 Н2SO4) = 0,2 моль/л
Последнее обозначение — рекомендованное; оно показывает, чему равен эквивалент растворенного вещества (в данном случае 1/2 моль) и сколько эквивалентов содержится в 1 л раствора.
Молярная масса и эквивалентная масса связаны соотношением:
Мэкв = fэкв∙ М
где fэкв - так называемый фактор эквивалентности,который для элемента равен 1/В, где В - стехиометрическая валентность* элемента в данном соединении (формальная валентность, следующая из формулы соединения); fэкв - величина безразмерная.
Так, для серы в Н2S fэкв = 1/2, откуда Э(S) = 1/2 моль и Мэкв(S) = 32/2 = 16 г/моль.
Для различных классов неорганических соединений фактор эквивалентности равен:
Для оксида:
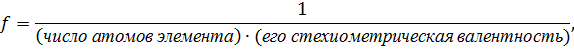
|
Для основания:
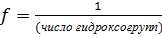 , ,
|
Для кислоты:
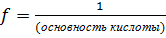 , ,
|
Для соли:
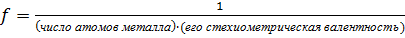 , ,
|
Зная нормальную концентрацию, легко рассчитать объем раствора того или иного реагента, требующийся для реакции. Пусть два вещества введены в реакцию в виде растворов, нормальные концентрации которых равны соответственно сн и с/н, и для реакции потребовались объемы растворов этих веществ соответственно V и V/. По определению нормальной концентрации сн показывает количество эквивалентов вещества в 1 л раствора. Тогда количество эквивалентов первого реагента составит сн V, а количество эквивалентов второго с/н V/. По закону эквивалентов вещества реагируют в количествах, пропорциональных их эквивалентам, т. е. количества эквивалентов реагирующих веществ равны, следовательно:
 или или 
| (7) |
т. е. объемы реагирующих растворов обратно пропорциональны их нормальным концентрациям.
Если известны нормальная концентрация раствора и эквивалентная масса растворенного вещества, можно легко вычислить массу вещества, содержащегося в 1 мл раствора.
11 ворос: Понятие химического равновесия. Скорость химической реакции. Константа химического равновесия.
Понятие химического равновесия
– реакции необратимые, т.е. протекающие до полного израсходования одного из реагирующих веществ. Это связано с тем, что необратимая реакция… – реакции обратимые, в которых ни одно из реагирующих веществ не расходуется… Например, необратимая реакция:Таким образом, чем больше концентрации реагирующих веществ, тем больше скорость реакции.
Константа равновесия
Состав реакционной смеси, соответствующий состоянию равновесия, называется равновесным составом,а концентрации веществ, находящихся в равновесии,… Количественной характеристикой системы в состоянии химического равновесия…Нарушение равновесия вследствие изменения температуры
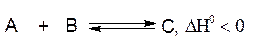
Повышение температуры вызывает смещение равновесия в сторону реакции, идущей с поглощением теплоты, а понижение температуры смещает равновесие в сторону реакции, идущей с выделением теплоты.
Впрос
Понятие скорости химической реакции
Учение о скоростях и механизмах химических реакций называется химической кинетикой.
Реакции могут быть гомогенными и гетерогенными.Гомогенные реакции протекают в однородной среде (например, в газовой фазе или жидком…Скоростью химической реакции называется число элементарных актов реакции, происходящих в единицу времени в единице объема (для гомогенных реакций) или на единице поверхности раздела фаз (в случае гетерогенных реакций)
Скорость химической реакции обычно характеризует изменение концентрации одного из реагирующих веществ в единицу времени.
При этом безразлично, о каком из участвующих в реакциивеществе идет речь: все они связаны между собой уравнением реакции.
Обычно концентрацию выражают в [моль/л], а время — в секундах (с), поэтому размерность скорости реакции равна [моль/л • с].
Рассмотрим реакцию взаимодействия водорода с парами хлора:
Н2 + Cl2 « 2HCl
Обозначим концентрацию паров хлора в начале некоторого отрезка времени t1черезС1, а при t2 –С2. Так, хлор в процессе реакции расходуется, следовательно, С1>С2. Скорость реакции Vможет быть найдена из равенства
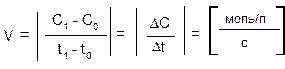
По мере расходования исходных веществ,скорость реакции уменьшается (рис. 1).
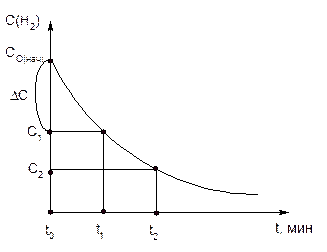
Рисунок 1- Изменение концентрации реагирующего вещества во времени
В ходе химических процессов концентрации веществ меняются непрерывно. Поэтому важно знать величину скорости реакции в данный момент времени, т.е. мгновенную скорость, которая выражается производной от концентрации во времени:
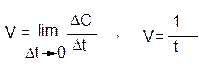
Мгновенная (истинная) скорость– это скорость реакции в конкретный момент времени.

где: t – это время от начала химической реакции до момента появления видимых изменений (изменение окраски раствора, появление газа, осадка).
Вопрос
Факторы, влияющие на скорость химической реакции
Скорость реакции зависит от природы реагирующих веществ, их концентрации и внешних условий (например, температуры, давления, катализаторов).
Зависимость скорости реакции от природы реагирующих веществ
Зависимость скорости реакции от природы веществ очень сложна, она связана с их составом и строением. Химический процесс всегда представляет собой…Зависимостьскорости реакции от концентрации реагирующих веществ
Число соударений в свою очередь тем больше, чем выше концентрация каждого из исходных веществ или, что, то же самое, чем больше произведение…В простой реакции или в какой-либо стадии сложной реакции могут принимать участие одна, две или три молекулы. Этот признак характеризует молекулярность реакции.
По этому признаку различают– мономолекулярные, бимолекулярные, тримолекулярные и т. д. реакции.
Мономолекулярные реакции представляют собой самопроизвольный распад одной молекулы, би- и тримолекулярные - результат соударения соответственно двух или трех молекул.
Вероятность осуществления реакции зависит отеемолекулярности. Наиболее часты бимолекулярные реакции. Тримолекулярные реакции более редки, а тетрамолекулярные - почти не встречаются.
Сумма показателей степени в кинетическом уравнении реакции называется порядком реакции (п).
Различают суммарный порядок реакции (т. е. сумма показателей степени в кинетическом уравнении) и частные порядки по какому-либо из реагентов, т. е. показатели степени при концентрации данного вещества в кинетическом уравнении.
Зависимостьскорости реакции от температуры
Число, показывающее, во сколько раз увеличивается скорость реакции при повышении температуры на 10°С,называетсятемпературным коэффициентом… Для большинства реакций γ равно 2-3 (правило Вант-Гоффа). Зная величину γ, а также скорость реакции при одной температуре Т1, можно вычислить ее скорость при другой…Зависимость скорости реакции от присутствия катализаторов.
Явление изменения скорости реакции под действием таких веществ называется катализом. Реакции под действием катализаторов называются… В большинстве случаев действие катализатора объясняется тем, что он снижает… 15 вопрос: Основные положения теории электролитической диссоциации.Истинные и потенциальные электролитыГидратация этих ионов.
Потенциальные электролиты - это вещества, имеющие молекулярную структуру, однако их молекулы содержат сильнополярные ковалентные связи, а потому… К потенциальным электролитам относятся, например, многие кислоты (НС1, H2SO4).… Под действием электрического поля, создаваемого приблизившимися к ним молекулами воды, молекулы этих веществ…В результате образуются гидратированные ионы, хаотически движущиеся в растворе электролита.
При составлении ионных уравнений следует помнить, что алгебраическая сумма зарядов ионов, на которые диссоциируют электролиты, равна нулю, что следует из электронейтральности как отдельных веществ, участвующих в ионной реакции, так и системы в целом.
Рассмотрим примеры ионных реакций в растворах электролитов.
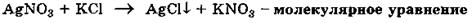 1. Реакцию между водными растворами нитрата серебра и хлорида калия можно записать следующим образом:
1. Реакцию между водными растворами нитрата серебра и хлорида калия можно записать следующим образом:
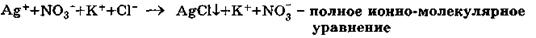 Представив сильные электролиты в ионной форме, а нерастворимое вещество - в молекулярной форме, получим:
Представив сильные электролиты в ионной форме, а нерастворимое вещество - в молекулярной форме, получим:
Сократив их в приведенном выше уравнении, рассматриваемую реакцию можно записать следующим образом:
 |
Вопрос
Ионное произведение воды. Водородный показатель
Н2О « Н+ + ОН- (или более строго 2Н2О « Н3О+ + ОН-) Выражение для константы диссоциации воды:Соль образованная сильным основанием и сильной кислотой не подвергается гидролизу.
Степень гидролиза (h)– это отношение числа молекул соли, подвергшихся гидролизу к общему числу молекул соли введенных в раствор. Степень гидролиза… Степень гидролиза зависит от следующих факторов:Если добавляемое вещество связывает продукты гидролиза, то гидролиз усиливается. Если добавляемое вещество связывает исходные вещества или увеличивает концентрацию продуктов гидролиза, гидролиз ослабевает.
Более универсальной характеристикой является Константа гидролиза (Кh,).
Константа гидролиза (Кh,) не зависит от концентрации соли и является постоянной для данной соли при данной температуре Рассмотрим три типичных случая гидролиза солей, причем для простоты катион и анион примем однозарядными.
Гидролиз солей, соответствующих сильному основанию и слабой кислоте
Гидролиз таких солей может быть выражен следующими уравнениями: полное: 
или сокращенное: 
Гидролиз солей, соответствующих слабому основанию и сильной кислот
или в сокращенной ионно-молекулярной форме:Все химические реакции можно разделить на два типа.
─ реакции, которые идут без изменения степени окисления атомов реагирующих веществ
─ реакции, которые идут с изменением степени окисления атомов реагирующих веществ.
Реакции, при которых изменяются степени окисления элементов, входящих в состав реагирующих веществ, называются окислительно-восстановительными.
Окислительно-восстановительная реакция — это единый процесс, состоящий из двух разных полуреакций: полуреакции окисления и полуреакции… Окисление - это процесс потери электронов атомом, молекулой или ионом. Восстановление — это процесс присоединения электронов атомом, молекулой или ионом.Вопрос
Предмет органической химии
Органическая химия – наука, изучающая соединения углерода, называемые органическими веществами. В связи с этим органическую химию называют также химией соединений углерода.
Важнейшие причины выделения органической химии в отдельную науку заключаются в следующем.
Многочисленность органических соединений по сравнению с неорганическими соединениями.
2. Органические вещества имеют исключительное значение как вследствие их крайне многообразного практического применения, так и потому, что они… 3. Имеются существенные отличия в свойствах и реакционной способности…Предметом органической химии является изучение способов получения, состава, строения и областей применения важнейших классов органических соединений.
Исторический обзор развития органической химии
Они умели изготовлять спиртные напитки путем брожения сахаристых веществ (вино, пиво), приготовлять уксус путем скисания вина. В Индии из сахарного… Однако, в то время люди имели дело со смесями органических соединений. Чистые… В средние века алхимики (алхимия происходит от арабского алькимия, которое восходит к греческому chemia cheo - лью,…Первые теоретические воззрения
Теория радикалов
В общем-то, это правильно. Но неправильным в теории радикалов было то, что радикалы постоянны и неизменны. Впервые это было опровергнуто русским… Теория радикалов до некоторой степени сыграла и положительную роль в развитии…Теория типов
Он предложил строить органические соединения подобно неорганическим, посредством замены атомов в последних, органическими остатками. Всю… По теории Жерара, различные радикалы не обладают противоположными зарядами. В… Теория типов сыграла положительную роль. Для несложных молекул она способна была предсказать свойства вновь…Теория строения А.М.Бутлерова
Бутлеров воспринял от них материалистическое учение и критическое отношение ко всем теориям. Впервые основные идеи теории строения, высказанные А.… Основные идеи теории А. М. Бутлерова могут быть кратко изложены следующим… 1. Все атомы, образующие молекулу органического вещества, связаны в определенной последовательности, причем на…Вопрос
Классификация органических соединений
К настоящему времени известно более 10 млн. органических соединений. Каждый год химики синтезируют и выделяют из природных источников сотни тысяч новых соединений. Чтобы ориентироваться в этом многообразии, органические соединения принято классифицировать.
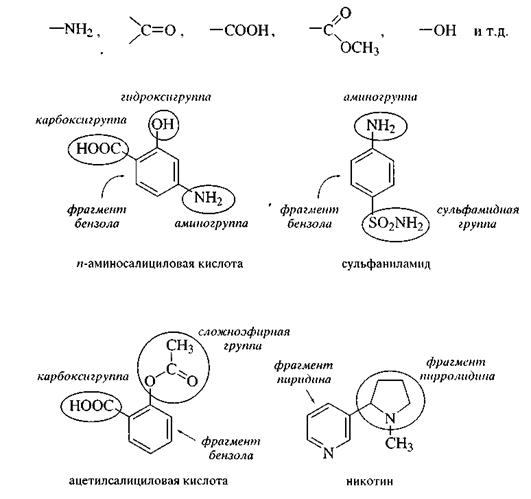
Давно уже отмечено, что большинство органических молекул состоит из двух частей: фрагмента, который в ходе реакции остается без изменения, и группы, подвергающейся при этом превращениям. Атом или группу атомов, связанных определенным образом, наличие которых в молекуле органического вещества придает ему характерные свойства, называют функциональной группой.
Структурная теория А.М. Бутлерова, давшая химикам четкое понимание термина «функциональная группа», лежит в основе современной классификации органических соединений.
В структурной формуле каждого соединения можно выделить фрагмент углеводорода или гетероциклического соединения. Этот фрагмент принято рассматривать в качестве остова молекулы. Как правило, остов реже трансформируется в ходе реакции, нежели функциональная группа. Характер остова молекулы определяет ряд, к которому принадлежит данное соединение. Выделяют следующие ряды:
1. Ациклический(алифатический, жирный) рядвключает соединения с открытой цепью углеродных атомов; эти соединения могут быть насыщенными (предельными), например:
 |
или ненасыщенными (непредельными), например:
 |
2. Циклический рядвключает:
карбоциклические соединения, содержащие углеродный скелет, замкнутый в цикл
 |
гетероциклические соединения, содержащие гетероатомы (иные, нежели углерод) в составе циклов
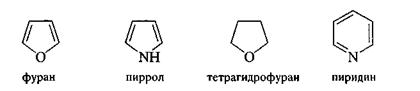 |
В свою очередь, карбоциклические соединения подразделяются на: ароматический ряд, который включает углеводороды и их производные, содержащие шестичленные циклы с чередующимися простыми и двойными связями (ароматические ядра)

алициклический ряд, который объединяет все остальные карбоциклические соединения, как насыщенные, так и ненасыщенные
 |
Наличие тех или иных функциональных групп в молекуле органического соединения определяет принадлежность этого соединения к тому или иному классу.
В табл. 1.1 перечислены наиболее важные функциональные группы, их названия и названия, соответствующих им классов органических веществ, даны примеры представителей этих классов.
Рассмотрим структуры некоторых органических соединений. Внимательный анализ каждой из них позволяет выделить в них фрагмент соответствующего углеводорода или гетероциклического соединения и связанные с этим фрагментом функциональные группы:
 |
Основы номенклатуры в органической химии
Правила, по которым образуются названия органических соединений, составляют номенклатуру. В настоящее время в органической химии применяют… 1. Тривиальная номенклатура Это система исторически сложившихся названий, но применяемых до настоящего времени. Как правило, эти названия были…Нахождение алканов в природе
Вопрос
Способы получения алканов
Гидрирование ненасыщенных углеводородов.
СН2=СН2 + Н2 ® СН3- СН3;
СН≡С–СН3 + 2Н2 ® СН3–СН2–СН3
Гидрирование газообразным водородом протекает в присутствии катализаторов и чаще всего под давлением. Наиболее сильными катализаторами являются металлы платиновой группы в мелко раздробленном состоянии. Часто используются катализаторы типа «никеля Ренея».
Из галоидных алкилов.
2 СН3- СН2I + 2Na ® СН3–СН2–СН2–СН3 + 2NaI Можно брать и два разных галоидных алкила. В этом случае образуется смесь трех… СН3I + С2Н5I +2Na ® СН3–СН3 + СН3–СН2–СН2–СН3 + СН3–СН2–СН3+ 2NaIИз карбоновых кислот.
Промышленный синтез из оксида углерода (2)(Синтез Фишера, Тропша). При пропускании смеси СО и Н2 при t = 200° С и атмосферном давлении над катализатором Fe и Со образуется смесь алканов…Физические свойства алканов
Наиболее закономерно в гомологическом ряду предельных углеводородов изменяются температуры кипения. Первые четыре члена ряда: метан, этан, пропан и… Превращению жидкого вещества в газообразное противо-действуют слабые силы… Второй фактор проявляется в различии t°кип изомерных углеводородов, имеющих одинаковую молекулярную массу. Нормальные…Химические свойства алканов
В алканах связи С–Н и С–С малополярны и прочны. Поэтому для образования карбкатионов и карбанионов (гетеролитический разрыв связи) нужно много…Галоидирование.
CH4 + Cl2 ® CH3Cl + HCl хлористый метил CH3Cl + Cl2 ® CH2Cl2 + HCl хлористый метилен CH2Cl2 + Cl2 ® CHCl3 + HCl хлороформНитрование.
CH4 + HО–NO2 ® CH3NO2 + H2O Этан в этих условиях реагирует по двум направлениям: СН3–СН3 + HNO3 ® СН3–СН2NO2 + H2OСульфирование.
Серная кислота (олеум) при нагревании медленно сульфирует алканы с третичным атомом углерода:

Сульфохлорирование.
С2H6 + Cl× ® С2H5× + HClОкисление.
Смесь спиртов применяется для получения пластификаторов пластических масс,…Дегидрирование.
При t = 300-400°С алканы, пропущенные над катализатором окисидом хрома и алюминия, теряют два атома водорода и превращаются в алкены:

Реакция имеет важное значение в промышленности при получении дивинила и изопрена – мономеров синтеза каучуков.
Изомеризация.
Под действием кислых катализаторов (например, AlCl3) алканы способны к перестройке углеродного скелета:

– Конец работы –
Используемые теги: Открытие, периодического, Закона, дало, Менделееву, основу, системы, классификации, химических, элементов, созданию, Периодической, системы0.151
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Открытие периодического закона дало Менделееву основу для системы классификации химических элементов и созданию Периодической системы
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов