ЗАКОНОМЕРНОСТИ ПРОТЕКАНИЯ ХИМИЧЕСКИХ ПРОЦЕССОВ. Законы и формулы
3. ЗАКОНОМЕРНОСТИ ПРОТЕКАНИЯ
ХИМИЧЕСКИХ ПРОЦЕССОВ
Законы и формулы
Процессы в термодинамических системах
Термодинамика изучает свойства макроскопических систем на основе возможных превращений энергии без рассмотрения их микросостояний.
Для анализа этого аспекта химических процессов используют понятие «система». Системой называется совокупность тел, находящихся во взаимодействии и мысленно выделенных из окружающей среды.
Систему характеризуют параметрами состояния (например, внутренней энергией U, температурой T, давлением p, объемом V, концентрацией С и др.). Параметр состояния, изменение которого в ходе процесса не зависит от пути его протекания, называют функцией состояния системы.
Систему называют изолированной, если она не обменивается с окружающей средой энергией и веществом. Закрытые системы не обмениваются веществом с окружающей средой, но могут обмениваться энергией. В открытых системах осуществляется обмен с окружающей средой как энергией, так и веществом.
Первый закон термодинамики соответствует закону сохранения энергии: изменение внутренней энергии термодинамической системы (DU) равно количеству теплоты (Q), сообщенной ей, за вычетом работы (А), совершенной системой. В химических процессах работа против внешних сил представляет собой работу расширения А = p · DV. Тогда:
DU = Q – p · DV. (3.1)
Для процесса, протекающего при постоянном объеме: DV = 0. Тепловой эффект такого процесса (Qv) равен изменению внутренней энергии системы и, следовательно, обладает свойствами функции состояния:
Qv = DU. (3.2)
Если процесс протекает при постоянном давлении, то из (3.1) следует
Q = (U2 + pV2 ) – (U1 + pV1) = H2 – H1 = DH. (3.3)
Полученная функция (Н) называется энтальпией (теплосодержанием) системы и по определению является функцией состояния. Таким образом, тепловой эффект реакции, протекающей при постоянном давлении и данной температуре, равен изменению энтальпии системы и также обладает свойствами функции состояния
Qp = DH. (3.4)
Соотношения(3.2) и (3.4)служат обоснованиемзакона Гесса: тепловой эффект химической реакции не зависит от пути ее протекания.
В термохимии принято считать, что тепловой эффект реакции равен изменению энтальпии по абсолютной величине, но отличается по знаку: Q = –DH. Поэтому тепловой эффект экзотермических реакций (протекающих с выделением теплоты) положителен: Q > 0, а DН < 0. Соответственно для эндотермических реакций (протекающих с поглощением теплоты): Q < 0, а DН > 0.
В термодинамических расчетах широко применяется понятие энтальпия образования соединения DНo298–это тепловой эффект получения одного моля сложного вещества из простых. Для простых веществ энтальпия образования равна 0. Обсуждаемая величина зависит от условий протекания процесса, поэтому в справочниках приводится для стандартного состояния (pо= 101325 Па и Т о = 298 К).
Второй закон термодинамики учитывает не только изменение энтальпии в ходе процесса, но и общее изменение ее структуры (степени хаотичности). Мерой хаотичности строения системы является функция состояния энтропия (S). Больцман показал, что
S = k · ln W,(3.5)
где k = R / NA – постоянная Больцмана; W – термодинамическая вероятность системы (число микросостояний, которыми реализуется данное макросостояние).
Критерием самопроизвольности процесса является изменение функции состояния системы – энергии Гиббса (DG).
DG = DH – T · DS. (3.6)
Для самопроизвольных процессов
DН – Т · DS ≤ 0. (3.7)
Уравнение (3.7) является формальным выражением второго закона термодинамики: невозможен процесс, единственным результатом которого является передача теплоты от тела менее нагретого к телу более нагретому.
В термодинамических расчетах наряду со значениями энтальпии образования соединений DНо298 широко применяются стандартные величины энтропии S о298 и энергии Гиббса образования DGо298. Многие расчеты основаны на применении следствия из закона Гесса: для функций состояния системы их изменение в ходе процесса можно рассчитать следующим образом:
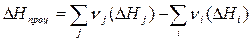 , (3.8)
, (3.8)
где i, j – индексы соответственно исходных веществ и продуктов, а νi , νj – соответствующие коэффициенты из уравнения реакции.
Таким образом, изменение энтальпии в ходе реакции равно разности между суммой энтальпий образования продуктов и суммой энтальпий образования исходных веществ. Аналогичные уравнения справедливы для изменения энтропии и энергии Гиббса в ходе процесса
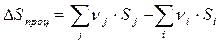 , (3.9)
, (3.9)
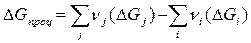 . (3.10)
. (3.10)
Кинетика химических реакций
Средняя скорость реакции соответствует изменению количества вещества D n за промежуток времени Dtв единице объема или на единице площади поверхности:
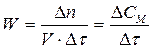 (для гомогенных реакций); (3.11)
(для гомогенных реакций); (3.11)
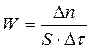 (для гетерогенных реакций). (3.12)
(для гетерогенных реакций). (3.12)
Влияние концентрации реагентов на скорость реакции. Основной постулат химической кинетики (закон действующих масс для скорости реакции) гласит: скорость реакции, протекающей необратимо, пропорциональна произведению молярных концентраций реагентов. Для реакции
а А + b В ® продукты
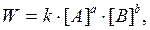 (3.13)
(3.13)
где k – константа скорости реакции; [A], [B] – молярные концентрации реагентов; a, b – порядок реакции соответственно по реагентам А и B. Физический смысл константы скорости: k= W, если [А] = [В] =1моль/дм3. Величина k зависит от природы реагентов и температуры.
Влияние температуры. Согласно правилу Вант-Гоффа, увеличение температуры на 10 градусов приводит к возрастанию скорости в gраз:
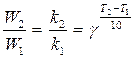 , (3.14)
, (3.14)
где g = 2…4 – температурный коэффициент скорости реакции (температурный коэффициент Вант-Гоффа).
Более строго влияние температуры на величину константы скорости химической реакции выражает уравнение Аррениуса
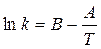 , (3.15)
, (3.15)
где B и A – константы. Уравнению Аррениуса отвечает зависимость
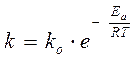 , (3.16)
, (3.16)
где Ea – энергия активации реакции – избыточная по сравнению с имеющимся запасом энергия, которая необходима для того, чтобы перевести все исходные молекулы в реакционноспособное состояние.
Равновесие обратимых химических процессов. Обратимые химические реакции протекают как в прямом, так и в обратном направлении:
а А + b В « с С + d D.
Для равновесия обратимой реакции справедлив закон действующих масс – для обратимых реакций в состоянии равновесия отношение произведений концентраций продуктов к произведению концентраций реагентов есть величина постоянная:
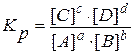 , (3.17)
, (3.17)
гдеKр – константа равновесия обратимой химической реакции.
Величина Kрсвязана с изменением энергии Гиббса в ходе реакции
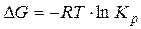 . (3.18)
. (3.18)
Равновесие обратимых процессов подчиняется принципу Ле Шателье: если на обратимую систему, находящуюся в состоянии динамического равновесия, оказать воздействие (изменить параметр), то равновесие сместится так, чтобы оказанное воздействие ослабить.
Вариант 1
I.Реакция
2 Н2(г)+ О2(г)= 2 Н2О(г)+ 483,6 кДж
протекает при стандартных условиях. Чему равна стандартная энтальпия образования Н2О(г)?
1) –483,6 кДж/моль; 2) –967,2 кДж/моль; 3) –241,8 кДж/моль;
4) +483,6 кДж/моль; 5) +241,8 кДж/моль.
II. Для реакции
Fe2O3(k) + 3 H2(г)= 2 Fe(k) + 3 H2O(г)– 96,8 кДж
ΔSо = +139 Дж/К. Рассчитайте значение DGо и определите, возможно ли самопроизвольное протекание ее при: а) Т = 300 К и б) Т = 1000 К.
А) нет, (б) нет; 2) (а) нет, (б) равновесие; 3) (а) да, (б) нет;
А) да, (б) да; 5) (а) нет; (б) да.
III. При увеличении температуры на 40° скорость реакции увеличилась в 81 раз. Чему равен температурный коэффициент Вант-Гоффа?
1) 3,0; 2) 4,0; 3) 2,5; 4) 2,0; 5) 3,5.
IV.Как изменится скорость прямой реакции
N2 + 3 H2 = 2 NH3,
если объем газовой cмеси уменьшить в 2 раза?
Уменьшится в 16 раз; 2) возрастет в 16 раз; 3) возрастет в 4 раза;
Возрастет в 2 раза; 5) уменьшится в 2 раза.
2 СО + О2 « 2 СО2+ Q, если: а) увеличить давление; б) увеличить температуру? 1) (а) ®, (б) ®; 2) (а) ¬, (б) ®; 3) (а) ¬, (б) ¬;И 0,030; 2) 0,030 и 0,012; 3) 0,048 и 0,006;
И 0,024; 5) 0,048 и 0,030.
V. В каком направлении сместится равновесие
СаСО3(к)« СаО(к)+ СО2(г) ;DН = +178 кДж
при: а) повышении давления, б) повышении температуры?
1) (а) ¬, (б) ®; 2) (а) ¬, (б) ¬; 3) (а) ®, (б) ¬;
4) (а) ®, (б) ®; 5) (а) не влияет, (б) ®.
Вариант 3
I.Реакция
N2 + 3 H2 = 2 NH3+ 92 кДж
осуществлена при стандартных условиях. Чему равна стандартная энтальпия образования NH3?
1) –46 кДж/моль; 2) +92 кДж/моль; 3) –92 кДж/моль;
4) +46 кДж/моль; 5) –184 кДж/моль.
II. Для реакции
2 NO2(г)= N2О4 (ж)+ 57 кДж
DS о = –177 Дж/К. Возможно ли самопроизвольное протекание ее при: а) Т = 300 К, б) Т = 500 К?
А) да, (б) да; 2) (а) да, (б) нет; 3) (а) нет, нет;
А) нет, (б) равновесие; 5) (а) нет, (б) да.
III. Увеличение температуры от 273 до 313 К привело к ускорению некоторой химической реакции в 16 раз. Какое значение имеет температурный коэффициент этого взаимодействия?
1) 2,0; 2) 2,5, 3) 3,0; 4) 4,0; 5) 3,5.
IV. Как изменится скорость прямой реакции
2 SO2(г)+ О2(г)= 2 SO3(г) ,
если уменьшить объем системы в 3 раза?
Уменьшится в 3 раза; 2) уменьшится в 27 раз; 3) увеличится в 9 раз;
Уменьшится в 9 раз; 5) увеличится в 27 раз.
СО(г)+ 3 Н2(г)« СН4(г)+ Н2О(г)+ Q, если: а) уменьшить давление, б) уменьшить температуру? 1) (а) ®, (б) ®; 2) (а) ¬, (б) ¬; 3) (а) ®, (б) ¬;К; 2) 0,386 К; 3) 298 К; 4) 273 К; 5) 2,59 К.
III. Реакция, температурный коэффициент которой равен 4, проте-кает при 350 К с определенной скоростью. При какой температуре ее скорость станет меньше в 256 раз?
1) 370 К; 2) 300 К; 3) 330 К; 4) 310 К; 5) 390 К.
IV.Как изменится скорость прямой реакции
2 Н2 + О2 = 2 Н2О ,
если объем газовой смеси увеличить в 2 раза?
Увеличится в 8 раз; 2) уменьшится в 8 раз; 3) увеличится в 4 раза;
Увеличится в 2 раза; 5) уменьшится в 2 раза.
СО(г)+ 3Н2(г)« СН4(г)+ Н2О(г) ; DН < 0, если: а) уменьшить объем системы, б) понизить температуру? 1) (а) ®, (б) ¬; 2) (а) ¬, (б) ¬; 3) (а) ¬, (б) ®;1) 3,0; 2) 4,0; 3) 2,0; 4) 5,0; 5) 2,5.
IV. Как изменится скорость прямой реакции
2 NO(г)+ О2(г)= 2 NO2(г) ,
если давление в системе уменьшить в 2 раза?
Увеличится в 8 раз; 2) уменьшится в 2 раза; 3) увеличится в 2 раза;
Уменьшится в 4 раза; 5) уменьшится в 8 раз.
4 НСl(г) + О2(г) « 2 Н2О(г) + 2 Сl2(г) ; DН = –114 кДж, если: а) уменьшить давление, б) уменьшить температуру? 1) (а) ¬, (б) ¬; 2) (а) ¬, (б) ®; 3) (а) ®, (б) ®;Уменьшится в 32 раза; 2) уменьшится в 5 раз; 3) увеличится в 32 раза; 4) уменьшится в 10 раз; 5) увеличится в 10 раз.
IV.Через некоторое время после начала реакции
4 НСl + O2 = 2 H2O + 2 Cl2
концентрации веществ стали равными: [НСl] = 0,01 моль/дм3; [O2] = 0,02 моль/дм3; [Сl2] = 0,02 моль/дм3. Какими были исходные концентрации НСlи O2 (в моль/дм3)?
И 0,04; 2) 0,03 и 0,03; 3) 0,05 и 0,03;
И 0,06; 5) 0,01 и 0,02.
V. В каком направлении сместится равновесие обратимой реакции
4 NH3(г)+ 5 О2(г) « 4 NO(г)+ 6 Н2О(г) ; DН < 0,
если: а) увеличить давление, б) повысить температуру в сиcтеме?
1) (а) ®, (б) ¬; 2) (а) не влияет, (б) ®; 3) (а) ¬, (б) ®;
4) (а) ®, (б) ®; 5) (а) ¬, (б) ¬.
Вариант 7
I. При взаимодействии 1 моля серы с углеродом в стандартных условиях по реакции
2 S + C = CS2
поглощается 44,4 кДж теплоты. Чему равна стандартная энтальпия образования CS2?
1) –88,8 кДж/моль, 2) +44,4 кДж/моль; 3) –44,4 кДж/моль;
4) +88,8 кДж/моль; 5) +22,2 кДж/моль.
II.Для реакции
Fe2O3(к)+ 3 Н2(г) = 2 Fe(к)+ 3 Н2О(г)– 96,8 кДж
DS o = 142 Дж/К. Рассчитайте значение DG o и определите, возможно ли самопроизвольное ее протекание при: а) Т = 300 К; б) Т = 1000 К.
1) (а) нет, (б) нет; 2) (а) нет, (б) да; 3) (а) да, (б) да;
4) (а) да, (б) нет; 5) (а) нет, (б) состояние равновесия.
III. Температурный коэффициент Вант-Гоффа некоторой реакции равен 3. Скорость ее при 298 К составляет 0,001 моль/(дм3 · с). Чему равна скорость этой реакции при 328 К?
1) 0,027 моль/(дм3 · с); 2) 0,009 моль/(дм3 · с); 3) 0,003 моль/(дм3 · с);
4) 1,1 ·10–4 моль/(дм3 · с); 5) 3,7 ·10–5 моль/(дм3 · с).
IV. Как изменится скорость прямой реакции
2 Н2 + О2 = 2 Н2О,
если объем газовой смеси увеличить в 2 раза?
1) увеличится в 8 раз; 2) уменьшится в 8 раз; 3) уменьшится в 2 раза;
4) увеличится в 2 раза; 5) увеличится в 4 раза.
V. В какую сторону сместится равновесие обратимой реакции
СО(г) + 3 Н2(г) « СН4(г)+ Н2O(г) ; DН o < 0,
если: а) уменьшить объем системы, б) уменьшить температуру?
1) (а) ¬, (б) ®; 2) (а) не влияет, (б) ®; 3) (а) ®, (б) ®;
4) (а) ¬; (б) ¬; 5) (а) ®, (б) ¬.
Вариант 8
I. Этан сгорает в соответствии с термохимическим уравнением
С2Н6(г)+ 3,5 О2(г) = 2 СО2(г)+ 3 Н2О(ж)+ 1555 кДж.
Стандартные энтальпии образования СО2(г) и Н2О(ж) равны –393,5 и –285,8 кДж/моль соответственно. Чему равна энтальпия образования этана?
1) +89,4 кДж/моль; 2) –875,7 кДж/моль; 3) –89,4 кДж/моль;
4) +875,7 кДж/моль; 5) –197,1 кДж/моль.
II.Для реакции
N2O4(г)= 2 NO2(г)– 57 кДж
DS о = +177 Дж/К. Определите, возможно ли ее самопроизвольное протекание при: а) Т = 300 К, б) Т = 400 К.
А) нет, (б) равновесие; 2) (а) да, (б) да; 3) (а) нет, (б) нет;
А) да, (б) нет; 5) (а) нет, (б) да.
III. Реакция, температурный коэффициент которой равен 4, протекает при 350 К. При какой температуре ее скорость станет меньше в 256 раз?
К; 2) 390 К; 3) 330 К; 4) 370 К; 5) 300 К.
IV. Как изменится скорость прямой реакции
N2 (г)+ 3 Н2(г)= 2 NН3(г) ,
если давление в системе увеличить в 3 раза?
Уменьшится в 3 раза; 2) увеличится в 81 раз; 3) увеличится в 3 раза;
Уменьшится в 81 раз; 5) увеличится в 12 раз.
2 СО + О2 « 2 СО2+ Q, если: а) увеличить давление, б) уменьшить температуру? 1) (а) не влияет, (б) ®; 2) (а) ®, (б) ¬; 3) (а) ¬; (б) ¬;1) 2,5; 2) 3,5; 3) 4,0; 4) 2,0; 5) 3,0.
IV. Равновесие в системе
2 NO2 « 2 NО + О2
установилось при следующих концентрациях: [NO2] = 0,006 моль/дм3; [NO] = 0,024 моль/дм3. Чему равны исходная концентрация NO2 и равновесная концентрация O2 (в моль/дм3)?
И 0,024; 2) 0,036 и 0,030; 3) 0,048 и 0,006;
И 0,012; 5) 0,048 и 0,030.
V. Укажите направления смещения равновесия обратимой реакции
CO(г)+ 3 H2(г) « CH4(г)+ Н2О(г) + Q,
если: а) увеличить давление, б) увеличить температуру.
1) (а) ¬, (б) ®; 2) (а) ®, (б) ¬; 3) (а) ®, (б) ®;
4) (а) ¬, (б) ¬; 5) (а) не влияет, (б) ®.
Вариант 10
I.Для реакции
СН4(г)+ СО2(г)= 2 CO(г)+ 2 H2(г)– 247 кДж
DS о = +256 Дж/К. Определите, возможно ли ее самопроизвольное протекание при: а) 900 К, б) 1000 К.
А) да, (б) да; 2) (а) нет, (б) нет; 3) (а) нет, (б) да;
А) да, (б) нет; 5) (а) нет, (б) равновесие.
С2Н5ОН(ж)+ 3 О2(г)= 2 СО2(г) + 3 Н2О(г)? 1) –357 кДж; 2) –1790 кДж; 3) +357 кДж; 4) –1234 кДж; 5) +1234 кДж.1) 4,0; 2) 2,0; 3) 3,0; 4) 2,5; 5) 3,5.
IV. Как изменится скорость прямой реакции
2 SO2(г) + O2(г) = 2 SО3(г),
если увеличить объем системы в 2 раза?
Уменьшится в 8 раз; 2) увеличится в 2 раза; 3) уменьшится в 2 раза;
Уменьшится в 4 раза; 5) увеличится в 8 раз.
4 НСl(г)+ О2(г) = 2 Н2О(г) + 2 Сl2(г); DН = –114 кДж, если: а) увеличить давление, б) уменьшить температуру? 1) (а) ¬, (б) ¬; 2) (а) ®, (б) ¬; 3) (а) ®, (б) ®;К; 2) 385,5 К; 3) 298 К; 4) 273 К; 5) 2,59 К.
III. Снижение температуры от 425 до 375 К замедлило реакцию в 243 раза. Чему равен температурный коэффициент этой реакции?
1) 2,0; 2) 4,0; 3) 5,0; 4) 3,0; 5) 2,5.
IV.Как изменится скорость прямой реакции
2 NO(г)+ О2(г) = 2 NO2(г),
если давление в системе увеличить в 3 раза?
Увеличится в 27 раз; 2) увеличится в 3 раза; 3) уменьшится в 3 раза;
Увеличится в 9 раз; 5) уменьшится в 27 раз.
СО(г)+ 3 Н2(г) « СН4(г)+ Н2О(г) ; DН < 0, если: а) увеличить объем системы, б) уменьшить температуру? 1) (а) ®, (б) ¬; 2) (а) ®, (б) ®; 3) (а) ¬, (б) ®;А) да, (б) да; 2) (а) нет, (б) да; 3) (а) нет, (б) равновесие;
А) нет, (б) нет; 5) (а) да, (б) нет.
1) 399 К; 2) 389 К; 3) 319 К; 4) 329 К; 5) 409 К. IV. Равновесие в системе 2 NО2 « 2 NО + О2И 0,024; 2) 0,030 и 0,048; 3) 0,048 и 0,006;
И 0,012; 5) 0,048 и 0,030.
V. В каком направлении сместится равновесие реакции
СаСО3(к) « СаО(к)+ СО2(г); DН = +178 кДж
при: а) понижении давления, б) повышении температуры?
1) (а) ¬, (б) ®; 2) (а) ®, (б) ¬; 3) (а) ®, (б) ®;
4) (а) ¬, (б) ¬; 5) (а) не влияет, (б) ®.
Вариант 13
I. При взаимодействии 2 молей Н2 с 2 молями F2 выделилось 1080 кДж теплоты. Чему равна энтальпия образования НF?
1) –270 кДж/моль; 2) –1080 кДж/моль; 3) –540 кДж/моль;
4) +540 кДж/моль; 5) +270 кДж/моль.
II. Для реакции
2 NO2(г) = N2O4 (г)+ 57 кДж
DS о = –177 Дж/К. Определите, возможно ли ее самопроизвольное протекание при: а) 300 К, б) 400 К?
А) нет, (б) нет; 2) (а) нет, (б) да; 3) (а) да, (б) нет;
А) да, (б) равновесие; 5) (а) да, (б) да.
III.Температурный коэффициент некоторой реакции равен 4. На сколько градусов надо охладить систему, чтобы скорость реакции уменьшилась в 256 раз?
1) 40; 2) 20; 3) 4; 4) 30; 5) 10.
IV. Как изменится скорость реакции
2 NO(г)+ O2(г) = 2 NO2(г) ,
если объем системы уменьшить в 2 раза?
Уменьшится в 2 раза; 2) увеличится 2 раза; 3) увеличится в 4 раза;
Уменьшится в 8 раз; 5) увеличится в 8 раз.
СО(г)+ 3 Н2(г) « СН4(г)+ Н2О(г) ; ΔН < 0, если: а) увеличить давление, б) уменьшить температуру? 1) (а) ¬, (б) ®; 2) (а) ¬, (б) ¬; 3) (а) ®, (б) ¬;1) 4,0; 2) 3,5; 3) 2,5; 4) 3,0; 5) 5,0.
IV. Через некоторое время после начала реакции
4 НСl + О2 = 2 Н2О + 2 Сl2
концентрации веществ стали соответственно равны: [НСl] = 0,01 моль/дм3; [О2] = 0,02 моль/дм3; [Сl2] = 0,02 моль/дм3. Какими были исходные концентрации НСl и О2 (в моль/дм3)?
И 0,04; 2) 0,05 и 0,03; 3) 0,03 и 0,03; 4) 0,05 и 0,06; 5) 0,01 и 0,02.
СО + 3 Н2 « СН4 + Н2О+ Q, если: а) увеличить объем системы, б) уменьшить температуру? 1) (а) ®, (б)¬; 2) (а) ¬, (б) ¬; 3) (а) ¬, (б)®;А) да, (б) да; 2) (а) да, (б) нет; 3) (а) нет, (б) нет;
А) нет, (б) равновесие; 5) (а) нет, (б) да.
III.При изменении температуры от 295 до 335 К скорость реакции увеличилась в 81 раз. Какое значение имеет температурный коэффициент этой реакции?
1) 2,5; 2) 3,0; 3) 4,0; 4) 2,0; 5) 3,5.
IV. Как изменится скорость прямой реакции
2 NO(г)+ О2(г) = 2 NO2(г) ,
если объем системы уменьшить в 3 раза?
Увеличится в 9 раз; 2) уменьшится в 27 раз; 3) уменьшится в 3 раза;