рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Физико-химические основы процессов коагуляции и флокуляции
Реферат Курсовая Конспект
Физико-химические основы процессов коагуляции и флокуляции
Физико-химические основы процессов коагуляции и флокуляции - раздел Химия, Физико-химические основы процессов коагуляции и флокуляции Нерастворимые В Воде Частицы Подразделяют На Взвеси...
Нерастворимые в воде частицы подразделяют на взвеси и коллоиды. Взвеси – присутствующие в воде вещества, размер частиц которых позволяет им оседать под действием силы тяжести. Такие примеси удаляются в процессе грубой фильтрации или отстаиванием. С коллоидами дело обстоит по-другому. В таблице 3.1 приведены различные типы коллоидных систем. Размер коллоидных частиц дисперсной фазы составляет 10–9–10–7 см, т.е. лежит в интервале от нанометров до долей микрометров. Эта область превосходит размер типичной малой молекулы, но меньше размера объекта, видимого в обычном оптическом микроскопе. То есть такие загрязнения невозможно удалить методом обычной фильтрации.
Таблица 3.1 – Типы коллоидных систем
| Дисперсная фаза | Дисперсионная среда | Наименование | Примеры |
| Жидкость | Газ | Жидкие аэрозоли | Туман |
| Твердое тело | Газ | Твердые аэрозоли | Дым, пыль |
| Газ | Жидкость | Пены | Мыльные пены |
| Жидкость | Жидкость | Эмульсии | Молоко (М/В), масло (В/М) |
| Твердое тело | Жидкость | Золи | Жидкая глина, зубная паста |
| Газ | Твердое тело | Твердые пены | Пенополистирол |
| Жидкость | Твердое тело | Твердые эмульсии | Опал, жемчуг |
| Твердое тело | Твердое тело | Твердые суспензии | Окрашенные пластмассы |
Для того чтобы очистить воду от взвешенных в ней коллоидных частиц необходимо разрушить равновесие, убрать силы не дающие частицам осесть. В этом нам помогают процессы коагуляции и флокуляции.
Коагуляция (от лат. Coagulatio – свертывание, сгущение) – это слипание частиц коллоидной системы при их столкновениях в процессе теплового движения, перемешивания или направленного перемещения во внешнем силовом поле. В результате коагуляции образуются агрегаты – более крупные (вторичные) частицы, состоящие из скопления мелких (первичных). Первичные частицы в таких агрегатах соединены силами межмолекулярного взаимодействия непосредственно или через прослойку окружающей (дисперсионной) среды. Коагуляция сопровождается прогрессирующим укрупнением частиц и уменьшением их общего числа в объеме дисперсионной среды (в нашем случае – жидкости). Слипание однородных частиц называется гомокоагуляцией, а разнородных – гетерокоагуляцией.
Производственные сточные воды в большинстве случаев представляют собой слабоконцентрированные эмульсии или суспензии, содержащие коллоидные частицы размером 0,001–0,1 мкм, мелкодисперсные частицы размером 0,1–10 мкм, а также частицы размером 10 мкм и более.
В процессе механической очистки из сточных вод достаточно легко удаляются частицы размером 10 мкм и более, мелкодисперсные и коллоидные частицы практически не удаляются. Таким образом, сточные воды многих производств после сооружений механической очистки представляют собой агрегативно-устойчивую систему. Для их очистки применяют методы коагуляции. Агрегативная устойчивость при этом нарушается, образуются более крупные агрегаты частиц, которые удаляют из сточных вод механическими методами.
Одним из видов коагуляции является флокуляция, при которой мелкие частицы, находящиеся во взвешенном состоянии, под влиянием добавляемых веществ (флокулянтов) образуют интенсивно оседающие рыхлые хлопьевидные скопления.
Методы коагуляции и флокуляция широко распространены для очистки сточных вод предприятий химической, нефтехимической, нефтеперерабатывающей, целлюлозно-бумажной, легкой, текстильной и других отрасли промышленности.
Эффективность коагуляционной очистки зависит от следующих факторов:
1. вида коллоидных частиц;
2. их концентрации и степени дисперсности;
3. наличия сточных водах электролитов и других примесей;
4. величины электрокинетического потенциала.
Обладая большой удельной площадью поверхности, коллоидные частицы адсорбируют находящиеся в воде ионы преимущественно одного знака, значительно понижающие свободную поверхностную энергию коллоидных частиц. Ионы, непосредственно прилегающие к ядру, образуют слой поверхностно-ядерных ионов, или так называемый адсорбционный слой. В этом слое может находиться также небольшое число противоположно заряженных ионов, суммарный заряд которых, однако, не компенсирует заряда поверхностно-ядерных ионов. В связи с тем, что на границе адсорбционного слоя создается электрический заряд, вокруг гранулы (ядра с адсорбционным слоем) образуется диффузионный слой, в котором находятся остальные противоположно заряженные ионы, компенсирующие заряд грянул. Гранула вместе с диффузионным слоем называется мицеллой. На рисунке 3.1 показано изменение напряженности электрического поля мицеллы. Потенциал на границе ядра – термодинамический потенциал (ζ-потенциал) – равен сумме зарядов всех поверхностно-ядерных ионов. На границе адсорбционного слоя потенциал уменьшается на величину, равную сумме зарядов, находящихся в адсорбционном слое противоположно заряженных ионов. Потенциал на границе адсорбционного слоя называется электрокинетическим потенциалом (ε-потенциал).
На частицы коллоидов действуют диффузионные силы, и частицы стремятся равномерно распределиться во всем объеме жидкой фазы. Наличие у частиц электрических зарядов одного знака вызывает их взаимное отталкивание. Одновременно между коллоидными частицами имеются молекулярные силы взаимного притяжения, которые проявляются лишь при небольших расстояниях между частицами. При снижении электрического заряда частиц, т.е. при уменьшении ζ-потенциала, силы отталкивания уменьшаются и становится возможным слипание частиц – процесс коагуляции коллоида. Силы взаимного притяжения между коллоидными частицами начинают преобладать над электрическими силами отталкивания при ζ-потенциале системы менее 0,03 В. При ζ-потенциале, равном нулю, коагуляция происходит максимальной интенсивностью, состояние коллоидной системы в этом случае носит название изоэлектрического состояния, а величина рН называется изоэлектрической точкой системы.
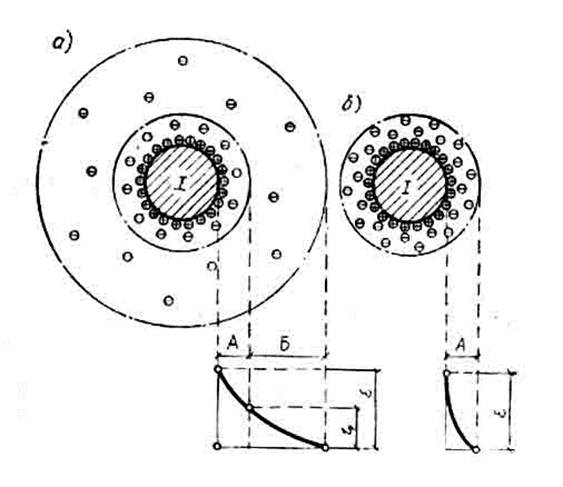
а – ζ>0,03; б – ζ=0;
А – адсорбционный слой; Б – диффузионный слой; I – ядро
Рисунок 3.1 – Строение мицеллы
Одним из методов снижения ζ-потенциала коллоидной системы является увеличение концентрации в воде электролитов. Способность электролита вызыватькоагуляцию коллоидной системы возрастает с увеличением валентности коагулирующего иона, обладающего зарядом, который противоположен заряду коллоидных частиц.
Коагуляция – самопроизвольный процесс, который, в соответствии с законами термодинамики, является следствием стремления системы перейти в состояние с более низкой свободной энергией. Однако такой переход затруднен, а иногда практически невозможен, если система агрегативно устойчива, т. е. способна противостоять укрупнению (агрегированию) частиц. Защитой от коагуляции при этом может быть электрический заряд и (или) адсорбционно-сольватный слой на поверхности частиц, препятствующий их сближению. Нарушить агрегативную устойчивость можно, например, повышением температуры (термокоагуляция), перемешиванием или встряхиванием, введением коагулирующих веществ (коагулянтов) и другими видами внешнего воздействия на систему. Минимальная концентрация введенного вещества, электролита или неэлектролита, вызывающая коагуляцию в системе с жидкой дисперсионной средой, называется порогом коагуляции.
При коагуляции хлопья образуются сначала за счет части взвешенных частиц и коагулянта или только коагулянта. Образовавшиеся хлопья последнего сорбируют вещества, загрязняющие сточные воды и, осаждаясь вместе с ними, очищают воду.
Основным процессом коагуляционной очистки производственных сточных вод является гетерокоагуляция – взаимодействие коллоидных и мелкодисперсных частиц сточных вод с агрегатами, образующимися при введении в сточную воду коагулянтов.
При использовании в качестве коагулянтов солей алюминия и железа в результате реакции гидролиза образуются малорастворимые в воде гидроксиды железа и алюминия, которые сорбируют на развитой хлопьевидной поверхности взвешенные, мелкодисперсные и коллоидные вещества и при благоприятных гидродинамических условиях оседают на дно отстойника, образуя осадок:
Al2(SO4)3 + 6H2O → 2Al(OH)3 + 3H2SO4
FeCl3 + 3H2O → Fe(OH)3 + 3HCl
FeSO4 + 2H2O → Fe(OH)2 + H2SO4
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3.
Образующиеся в процессе гидролиза серную и соляную кислоты следует нейтрализовать известью или другими щелочами. Нейтрализация образующихся при гидролизе коагулянтов кислот может также протекать за счет щелочного резерва сточной жидкости:
H+ + HCO-3 → СО2 + Н2О.
В целях уменьшения расходов коагулянтов процесс коагуляции следует осуществлять в диапазоне оптимальных величин рН. Так, значения рН при оптимальных условиях коагуляции: для Al(OH)3 – от 4,5 до 7; для Fe(OH)2 – от 8,5 до 10,5, а для Fe(OH)3 – от 4 до 6 и от 8 до 10.
Для очистки производственных сточных вод применяют различные минеральные коагулянты.
1. Соли алюминия. Сульфат алюминия (глинозем) Al2(SO4)3∙18H2O. В результате применения сульфата алюминия степень минерализации воды увеличивается. Алюминат натрия NaAlO2, оксихлорид алюминия Аl2(ОН)5Сl, полихлорид алюминия [Al2(OH)nCl6-n]m(SO4)x, алюмокалиевые AlK(SO4)2∙18H2O и алюмоаммонийные Al(NH4) (SO4)2∙12H2O квасцы имеют меньшую стоимость и дефицитность, чем сульфат алюминия.
2. Соли железа. Сульфат двухвалентного железа (железный купорос) FeSO4∙7H2O. Гидроксид железа – плотные, тяжелые, быстро осаждающиеся хлопья, что является несомненным преимуществом его применения. Хлорид железа FeCl3∙6H2O; сульфат железа Fe2(SO4)3∙9H2O.
3. Соли магния. Хлорид магния MgCl2∙6H2O; сульфат магния MgSO4∙7 H2O.
4. Известь.
5. Шламовые отходы и отработанные растворы отдельных производств. Хлорид алюминия (производство этилбензола), сульфат двухвалентного железа (травление металлов), известковый шлам и др.
Количество коагулянта, необходимое для осуществления процесса коагуляции, зависит от вида коагулянта, расхода, состава, требуемой степени очистки сточных вод и определяется по СНиП 2.04.03–85 «Строительные нормы и правила. Канализация. Наружные сети и сооружения» или экспериментально.
Недостатками коагуляции является: значительный расход коагулянтов, большой объем получающегося осадка, сложность его обработки и последующего складирования, увеличение степени минерализации обрабатываемых сточных вод.
Коагуляционный метод очистки применяется в основном при небольших расходах сточных вод и при наличии дешевых коагулянтов.
– Конец работы –
Эта тема принадлежит разделу:
Физико-химические основы процессов коагуляции и флокуляции
На сайте allrefs.net читайте: Физико-химические основы процессов коагуляции и флокуляции.
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Физико-химические основы процессов коагуляции и флокуляции
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов