Скорость химической реакции. Закон действующих масс.
Химическая кинетика – раздел химии, изучающий скорость химических реакций и механизм протекания химических реакций.
Скорость химической реакции – количество благоприятных столкновений частиц в единицу времени.
По характеру взаимодействия реагирующих веществ различают:
А) Гомогенные реакции – реакции, протекающие по всему объёму системы, т.к. отсутствует граничная поверхность раздела фаз, реагенты находятся в одном фазовом состоянии.
Vгом=Δс/Δt=Δν/VΔt [моль/л*с]
Б) Гетерогенные реакции – реакции, в которых реагенты находятся в разных фазовых состояниях, т.к. присутствует поверхность раздела фаз.
Vгет=Δν/Δt*S [моль/с*м2]
По механизму протекания различают:
А) Простые реакции – реакции, протекающие в одну стадию (элементарные).
Б) Сложные реакции – реакции, протекающие в несколько стадий, скорость такой реакции будет определяться самой медленной (лимитирующей) стадией.
Закон действующих масс: скорость элементарной гомогенной реакции прямо пропорциональна произведению молярных концентраций реагентов в степени их стехиометрических коэффициентов.
nA + mB = cD V=k*cn(A)*cm(B)
27. Скорость химической реакции и факторы, влияющие на неё.
Скорость химической реакции – количество благоприятных столкновений частиц в единицу времени.
Влияние концентрация реагентов
Чтобы осуществлялось химическое взаимодействие веществ А и В, их молекулы (частицы) должны столкнуться. Чем больше столкновений, тем быстрее протекает реакция. Число же столкновений тем больше, чем выше концентрация реагирующих веществ. Отсюда на основе обширного экспериментального материала сформулирован основной закон химической кинетики, устанавливающий зависимость скорости реакции от концентрации реагирующих веществ:
Скорость химической реакции пропорциональна произведению концентраций реагирующих веществ.
Для реакции ( I ) этот закон выразится уравнением
v = kcA cB , (1)
где сА и сВ - концентрации веществ А и В, моль/л; k - коэффициент пропорциональности, называемый константой скорости реакции. Основной закон химической кинетики часто называют законом действующих масс.
Из уравнения (1) нетрудно установить физический смысл константы скорости k: она численно равна скорости реакции, когда концентрации каждого из реагирующих веществ составляют 1 моль/л или когда их произведение равно единице.
Константа скорости реакции k зависит от природы реагирующих веществ и от температуры, но не зависит от их концентраций.
Уравнение (1), связывающее скорость реакции с концентрацией реагирующих веществ, называется кинетическим уравнением реакции. Если опытным путем определено кинетическое уравнение реакции, то с его помощью можно вычислять скорости при других концентрациях тех же реагирующих веществ.
Влияние температуры.
Зависимость скорости реакции от температуры определяется правилом Вант-Гоффа:
При повышении температуры на каждые 10о скорость большинства реакций увеличивается в 2-4 раза.
Математически эта зависимость выражается соотношением
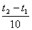
vt 2 = vt 1 γ ,
где vt 1 , vt 2 - скорости реакции соответственно при начальной ( t 1 ) и конечной ( t 2 ) температурах, а γ - температурный коэффициент скорости реакции, который показывает, во сколько раз увеличивается скорость реакции с повышением температуры реагирующих веществ на 10°.
Правило Вант-Гоффа является приближенным и применимо лишь для ориентировочной оценки влияния температуры на скорость реакции. Температура влияет на скорость химической реакции, увеличивая константу скорости.
Влияние катализатора.
Катализатор – вещество, изменяющее скорость химической реакции, но не вступающее в химическое взаимодействие и выводящееся в конце реакции в чистом виде.
Процесс ускорения реакции в присутствии катализатора называют катализом, процесс замедления – ингибированием.