рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Периодическая система стала одним из важнейших источников информации о химических элементах, образуемых ими простых веществах и соединениях
Реферат Курсовая Конспект
Периодическая система стала одним из важнейших источников информации о химических элементах, образуемых ими простых веществах и соединениях
Периодическая система стала одним из важнейших источников информации о химических элементах, образуемых ими простых веществах и соединениях - раздел Химия, Билет № 1 ...
Билет № 1
Периодический закон и периодическая система химических элементов Д. И. Менделеева. Закономерности изменения свойств элементов малых периодов и главных подгрупп в зависимости от их порядкового (атомного) номера.
Периодическая система стала одним из важнейших источников информации о химических элементах, образуемых ими простых веществах и соединениях.
Дмитрий Иванович Менделеев создал Периодическую систему в процессе работы над своим учебником «Основы химии», добиваясь максимальной логичности в изложении материала. Закономерность изменения свойств элементов, образующих систему, получила название Периодического закона.
Согласно периодическому закону, сформулированному Менделеевым в 1869 году, свойства химических элементов находятся в периодической зависимости от их атомных масс. То есть с увеличением относительной атомной массы, свойства элементов периодически повторяются.*
Сравните: периодичность смены времен года с течением времени.
Данная закономерность иногда нарушается, например, аргон (инертный газ) превышает по массе следующий за ним калий (щелочной металл). Это противоречие было объяснено в 1914 году при изучении строения атома. Порядковый номер элемента в Периодической системе — это не просто очередность, он имеет физический смысл — равен заряду ядра атома. Поэтому
современная формулировка Периодического закона звучит так:
Свойства химических элементов, а также образованных ими веществ находятся в периодической зависимости от заряда ядра атома.
В периоде, с увеличением заряда ядра, растет электроотрицательность элемента, ослабевают металлические (восстановительные) свойства и растут… (Третий период снова начинается щелочным металлом — это и есть… 1–3 периоды являются малыми (содержат один ряд: 2 или 8 элементов), 4–7 — большие периоды, состоят из 18 и более…Опыт. Проведение реакций, подтверждающих химические свойства хлороводородной кислоты.
1. Окрашивает растворы индикаторов лакмуса и метилового оранжевого в красный цвет, вследствие диссоциации в водном растворе: HCl → H+ +… 2. Взаимодействует с металлами, находящимися в ряду напряжений левее водорода,… 3. Взаимодействует с оснóвными оксидами с образованием соли и воды: CuO + 2HCl = CuCl2 + H2O (при проведении…Билет № 2
Простые вещества состоят из одного химического элемента. К ним относятся металлы и неметаллы. Сложные вещества состоят из двух или более химических элементов. Сложные… · оксидыЗадача. Вычисление массовой доли вещества, находящегося в растворе.
ω = масса компонента / масса целого, где ω — массовая доля Для растворенного вещества формула расчета массовой доли будет иметь следующий вид:Рассчитайте массовую долю растворенного вещества, если при выпаривании 20 г раствора было получено 4 г соли.
Решение:
m растворенного вещества = 4г
m раствора = 20г
ω = 4г/20г = 0,2 = 20%
Ответ: 0,2 или 20%.
Билет № 3
Строение атомов химических элементов. Состав атомного ядра. Строение электронных оболочек атомов первых 20 химических элементов периодической системы Д. И. Менделеева
Атом — наименьшая частица вещества, неделимая химическим путем. В XX веке было выяснено сложное строение атома. Атомы состоят из положительно заряженного ядра и оболочки, образованной отрицательно заряженными электронами. Общий заряд свободного атома* равен нулю, так как заряды ядра и электронной оболочки уравновешивают друг друга. При этом величина заряда ядра равна номеру элемента в периодической таблице (атомному номеру) и равна общему числу электронов (заряд электрона равен −1).
Атомное ядро состоит из положительно заряженных протонов и нейтральных частиц — нейтронов, не имеющих заряда. Обобщенные характеристики элементарных частиц в составе атома можно представить в виде таблицы:
| Название частицы | Обозначение | Заряд | Масса |
| протон | p | +1 | |
| нейтрон | n | ||
| электрон | e− | −1 | принимается равной 0 |
Число протонов равно заряду ядра, следовательно, равно атомному номеру. Чтобы найти число нейтронов в атоме, нужно от атомной массы (складывающейся из масс протонов и нейтронов) отнять заряд ядра (число протонов).
Например, в атоме натрия 23Na число протонов p = 11, а число нейтронов n = 23 — 11 = 12
Число нейтронов в атомах одного и того же элемента может быть различным. Такие атомы называют изотопами.
Электронная оболочка атома также имеет сложное строение. Электроны располагаются на энергетических уровнях (электронных слоях).
Номер уровня характеризует энергию электрона. Связано это с тем, что элементарные частицы могут передавать и принимать энергию не сколь угодно малыми величинами, а определенными порциями — квáнтами. Чем выше уровень, тем большей энергией обладает электрон. Поскольку чем ниже энергия системы, тем она устойчивее (сравните низкую устойчивость камня на вершине горы, обладающего большой потенциальной энергией, и устойчивое положение того же камня внизу на равнине, когда его энергия значительно ниже), вначале заполняются уровни с низкой энергией электрона и только затем — высокие.
Максимальное число электронов, которое может вместить уровень, можно рассчитать по формуле: N = 2n2, где N — максимальное число электронов на уровне,
n — номер уровня.
Тогда для первого уровня N = 2 · 12 = 2,
для второго N = 2 · 22 = 8 и т.д.
Число электронов на внешнем уровне для элементов главных (А) подгрупп равно номеру группы.
В большинстве современных периодических таблиц расположение электронов по уровням указано в клеточке с элементом. Очень важно понимать, что уровни читаются снизу вверх, что соответствует их энергии. Поэтому столбик цифр в клеточке с натрием :
1
8
2
следует читать так:
на 1-м уровне — 2 электрона,
на 2-м уровне — 8 электронов,
на 3-м уровне — 1 электрон
Будьте внимательны, очень распространенная ошибка!
Распределение электронов по уровням можно представить в виде схемы:
11Na ) ) )
2 8 1
Если в периодической таблице не указано распределение электронов по уровням, можно руководствоваться:
· максимальным количеством электронов: на 1-м уровне не больше 2 e−,
на 2-м — 8 e−,
на внешнем уровне — 8 e−;
· числом электронов на внешнем уровне (для первых 20 элементов совпадает с номером группы)
Тогда для натрия ход рассуждений будет следующий:
1. Общее число электронов равно 11, следовательно, первый уровень заполнен и содержит 2 e−;
2. Третий, наружный уровень содержит 1 e− (I группа)
3. Второй уровень содержит остальные электроны: 11 − (2 + 1) = 8 (заполнен полностью)
* Ряд авторов для более четкого разграничения свободного атома и атома в составе соединения предлагают использовать термин «атом» только для обозначения свободного (нейтрального) атома, а для обозначения всех атомов, в том числе и в составе соединений, предлагают термин «атомные частицы». Время покажет, как сложится судьба этих терминов. С нашей точки зрения, атом по определению является частицей, следовательно, выражение «атомные частицы» можно рассматривать как тавтологию («масло масляное»).
Задача. Вычисление количества вещества одного из продуктов реакции, если известна масса исходного вещества.
Какое количество вещества водорода выделится при взаимодействии цинка с соляной кислотой массой 146 г? Решение: 1. Записываем уравнение реакции: Zn + 2HCl = ZnCl2 + H2↑Билет № 4
Элементы, образующие простые вещества — металлы, занимают левую нижнюю часть периодической системы (для наглядности можно сказать, что они… Для атомов металлов характерно небольшое число электронов на внешнем уровне.… · электрическую проводимость,Опыт. Получение и собирание кислорода. Доказательство наличия кислорода в сосуде.
2H2O2 = 2H2O + O2↑ или разложением перманганата калия при нагревании: 2KMnO4 = K2MnO4 + MnO2 + O2↑Билет № 5
Простые вещества — неметаллы образуют элементы главных подгрупп, расположенные в правой верхней части периодической системы (правее диагонали,… Для их атомов характерно наличие на внешнем уровне 4-8 электронов. Так, у… Электроны в атомах этих элементов прочнее связаны с ядром, поэтому для неметаллов характерны такие физические…Химические свойства
1. Например, порошок серы при нагревании реагирует с железными опилками с образованием сульфида железа: Fe0 + S0 = Fe+2S−2 2. При высокой температуре сера реагирует с водородом (например, если пропускать водород через расплавленную серу).…Задача. Вычисление объема полученного газа, если известна масса исходного вещества.
v = 22,4 л/моль • n, где 22,4 — молярный объем, т.е. объем одного моля любого газа, n — количество вещества (моль)Билет № 6
Ковалентной связью называется химическая связь между двумя атомами за счет образования общей электронной пары. Ковалентная связь может быть… Рассмотреть образование ковалентной неполярной связи удобно на примере… H• + •H → H : HОпыт. Получение и собирание аммиака.
Осторожно нагреваем пробирку на спиртовке. Уравнение реакции: 2NH4Cl + Ca(OH)2 = CaCl2 + 2H2O + 2NH3↑ Аммиак обнаруживаем по характерному резкому запаху (нюхать осторожно!) или поднеся к трубке бумажку, смоченную…Билет № 7
Между классами неорганических соединений возможны взаимные превращения. Осно́вные оксиды (щелочных и щелочноземельных металлов) реагируют с… CaO + H2O = Ca(OH)2 Нерастворимые основания не могут быть получены таким путем, но они разлагаются при нагревании с образованием основных…Задача. Вычисление количества вещества (или объема) газа, необходимого для реакции с определенным количеством вещества (или объемом) другого газа.
2. Сколько литров кислорода необходимо для сгорания 89,6 литров водорода? Решение: 1. Объем газа пропорционален количеству вещества: v = 22,4 л/моль • n, где 22,4 — молярный объем, т.е. объем одного…Билет № 8
♦ По числу и составу исходных и полученных веществ химические реакции бывают: 1. Соединения — из двух или нескольких веществ образуется одно сложное… 2. Разложения — из одного сложного вещества образуется два или несколько веществ: 2H2O = 2H2 + O2 (вода разлагается на…Опыт. Проведение реакций, подтверждающих качественный состав предложенной соли, например сульфата меди(II).
Качественный состав соли доказывают с помощью реакций, сопровождающихся выпадением осадка или выделением газа с характерным запахом или цветом. Образование осадка происходит в случае получения нерастворимых веществ (определяем по таблице растворимости). Газы выделяются при образовании слабых кислот (для многих требуется нагревание) или гидроксида аммония.
Наличие иона меди можно доказать добавлением гидроксида натрия, выпадает синий осадок гидроксида меди (II):
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4
Дополнительно можно провести разложение гидроксида меди (II) при нагревании, образуется черный оксид меди (II):
Cu(OH)2 = CuO + H2O
Наличие сульфат-иона доказывается выпадением белого кристаллического осадка, нерастворимого в концентрированной азотной кислоте, при добавлении растворимой соли бария:
CuSO4 + BaCl2 = BaSO4↓ + CuCl2
Билет № 9
Окислительно-восстановительные реакции. Окислитель и восстановитель (на примере двух реакций).
Окислительно-восстановительные реакции протекают с изменением степени окисления. Широко распространенными реакциями этого типа являются реакции горения. Также сюда относятся реакции медленного окисления (коррозия металлов, гниение органических веществ).
Степень окисления элемента показывает число смещенных (притянутых или отданных) электронов. В простых веществах она равна нулю. В бинарных соединениях (состоящих из 2-х элементов) равна валентности, перед которой ставится знак (поэтому иногда ее называют «условным зарядом»).
В веществах, состоящих из 3-х и более элементов, степень окисления можно рассчитать с помощью уравнения, взяв неизвестную степень окисления за «икс», а общую сумму приравняв к нулю. Например, в азотной кислоте HNO3 степень окисления водорода +1, кислорода −2, получаем уравнение: +1 + x −2 • 3 = 0
x = +5
Элемент, присоединяющий электроны, называется окислителем. Элемент, являющийся донором электронов (отдающий электроны), называется восстановителем.
_2 e−_
l ↓
Fe0 + S0 = Fe+2S−2
При нагревании порошков железа и серы образуется сульфид железа. Железо является восстановителем (окисляется), сера — окислителем (восстанавливается).
S0 + O20 = S+4O2−2
В этой реакции сера является восстановителем, кислород окислителем. Образуется оксид серы (IV)
Можно привести пример с участием сложного вещества:
Zn0 + 2H+1Cl = Zn+2Cl2 + H20↑
цинк — восстановитель, водород соляной кислоты — окислитель.
Можно привести пример с участием сложного вещества и составить электронный баланс:
Cu0 + 4HN+5O3 = Cu+2(NO3)2 + 2H2O + 2N+4O2↑
конц.
| Cu0 − 2e− → Cu+2 | — восстановитель | ||
| N+5 + 1e− → N+4 | — окислитель |
2. Задача. Вычисление массы продукта реакции, если для его получения взят раствор с определенной массовой долей (%) исходного вещества.
m растворенного вещества = m раствора • ω
где ω — массовая доля
Можно получить ту же формулу, составляя пропорцию:
m раствора — 100%
х — ω %
х = m раствора • ω : 100
Пример:
Сколько граммов хлорида цинка получится при растворении избытка цинка в 20 граммах 10%-ного раствора соляной кислоты?
Решение:
1) Находим массу HCl в растворе:
m HCl = 20г • 10% : 100% = 2 г
2) Находим количество вещества HCl:
M (HCl) = 35,5 + 1 = 36,5 г/моль
n = m/M = 2 г : 36,5 г/моль = 0,055 моль
3) Подписываем данные над уравнением реакции, а число моль согласно уравнению (равно коэффициентам) под ним:
0,055 моль x моль
Zn + 2HCl = ZnCl2 + H2↑
2 моль 1 моль
Составляем пропорцию:
0,055 моль — x моль
2 моль — 1 моль
Находим x:
x = 0,055 моль • 1 моль / 2 моль = 0,028 моль
4) Находим массу соли:
M (ZnCl2) = 65 + 35,5 • 2 = 136 г/моль
m = M • n = 136 г/моль • 0,028 моль = 3,8 г
Ответ: 3,8 г.
(Если подставлять в уравнение не моли, а граммы, то получится точнее — 3,7 г)
Билет № 10
Реакции ионного обмена, условия их протекания до конца (на примере двух реакций). Отличие реакций ионного обмена от реакций окислительно-восстановительных.
Реакции обмена в растворах электролитов получили название реакций ионного обмена. Эти реакции протекают до конца в 3-х случаях:
1. Если в результате реакции выпадает осадок (образуется нерастворимое или малорастворимое вещество, что можно определить по таблице растворимости):
CuSO4 + BaCl2 = BaSO4↓ + CuCl2
2. Если выделяется газ (образуется часто при разложении слабых кислот):
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
3. Если образуется малодиссоциирующее вещество. Например, вода, уксусная кислота:
HCl + NaOH = NaCl + H2O
Это связано со смещением химического равновесия вправо, что вызвано удалением одного из продуктов из зоны реакции.
Реакции ионного обмена не сопровождаются переходом электронов и изменением степени окисления элементов в отличие от окислительно-восстановительных реакций.
Если попросят написать уравнение в ионном виде, можно проверять правильность написания ионов по таблице растворимости. Не забывайте менять индексы на коэффициенты. Нерастворимые вещества, выделяющиеся газы, воду (и другие оксиды) на ионы не раскладываем.
Cu2+ + SO42− + Ba2+ + 2Cl− = BaSO4↓ + Cu2+ + 2Cl−
Вычеркиваем не изменившиеся ионы:
SO42− + Ba2+ = BaSO4↓
2. Задача. Вычисление массовой доли (%) химического элемента в веществе, формула которого приведена.
Формулу для вычисления массовой доли в общем виде можно записать так:
ω = масса компонента / масса целого,
где ω — массовая доля
Для расчета массовой доли элемента в сложном веществе формула будет иметь следующий вид:
ω = Ar • n / Mr ,
где Ar — относительная атомная масса,
n — число атомов в молекуле,
Mr — относительная молекулярная масса (численно равна M — молярной массе)
Пример:
Рассчитайте массовую долю элементов в оксиде серы (VI) SO3.
Решение:
Mr (SO3) = 32 + 16 • 3 = 80
ω (S) = 32 : 80 = 0,4 = 40%
ω (O) = 16 • 3 : 80 = 0,6 = 60%
проверка: 40% + 60% = 100%
Ответ: 40%; 60%.
Билет № 11
С точки зрения теории электролитической диссоциации кислотами называются вещества, диссоциирующие в растворах с образованием ионов водорода: HCl → H+ + Cl− Более строгая формулировка: отщепляющие в качестве катионов (положительных ионов) только ионы водорода.Опыт. Выделение поваренной соли из ее смеси с речным песком.
2. Профильтровать полученную смесь. Если нет фильтра, дать отстояться и слить верхнюю часть воды с растворенной солью. (Здесь мы используем различную растворимость соли и песка в воде) 3. Выпарить соль из раствора в фарфоровой чашке.Билет № 12
Амфотерные гидроксиды — вещества, состоящие из металла (цинка, алюминия и некоторых других) и гидроксогрупп OH. Могут быть получены действием щелочей на растворы солей цинка: ZnCl2 + 2NaOH = Zn(OH)2↓ + 2NaClОпыт. Получение и собирание водорода. Доказательство наличия водорода в пробирке.
Zn + 2HCl = ZnCl2 + H2↑ Водород легче воздуха, поэтому его собирают в пробирку, перевернутую дном… Чтобы доказать наличие водорода в пробирке и проверить его на чистоту, пробирку с водородом подносят к пламени…Билет № 13
Щёлочи — это растворимые основания. С точки зрения теории электролитической диссоциации основаниями являются… NaOH → Na+ + OH−Задача. Вычисление массы исходного вещества, если известно количество вещества одного из продуктов реакции.
Сколько граммов соляной кислоты необходимо для получения 4 моль хлорида цинка? Решение: 1. Записываем уравнение реакции: Zn + 2HCl = ZnCl2 + H2↑Билет № 14
Водород находится в 1-м периоде, I группе, главной (А) подгруппе. Химический знак водорода обычно проставляют и в VII группе. Это связано с тем, что ядро атома водорода представляет из себя протон… В то же время водороду недостает только одного электрона, чтобы заполнить внешний электронный уровень (т.к. на I…Задача. Вычисление количества вещества газа, необходимого для реакции с определенным количеством вещества другого газа.
Какое количество вещества водорода прореагирует с 4 моль кислорода? Решение: 1. Записываем уравнение реакции.Билет № 15
Состав воды можно выяснить с помощью реакции разложения электрическим током. Образуется два объема водорода на один объем кислорода (объем газа… 2H2O = 2H2↑ + O2↑ Вода состоит из молекул. Каждая молекула содержит два атома водорода, соединенные ковалентными связями с одним атомом…Опыт. Распознавание соли угольной кислоты среди трех предложенных солей.
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑ или, в ионном виде: CO32− + 2H+ = H2O + CO2↑Билет № 16
Положение в периодической системе: сера находится в 3 периоде, VI группе, главной (А) подгруппе. Атомный номер серы 16, следовательно, заряд атома серы равен + 16, число… Схема расположения электронов по уровням: 16S ) ) ) 2 8 6Опыт. Проведение реакций, подтверждающих свойства гидроксида кальция.
2. Сливаем раствор, фильтруем (если нет фильтра, ждем пока отстоится). Прозрачный раствор гидроксида кальция называется известковой водой. Делим на… 3. Во вторую пробирку пропускаем углекислый газ, известковая вода мутнеет в… Если придется делать эти реакции на практике, углекислый газ можно получить в пробирке с газоотводной трубкой, добавив…Билет № 17
Оксиды — сложные вещества, состоящие из двух элементов, один из которых кислород. Оксиды делят на кислотные, осно́вные, амфотерные и несолеобразующие… Кислотным оксидам соответствуют кислоты. Кислотными свойствами обладают большинство оксидов неметаллов и оксиды…Задача. Вычисление массы продукта реакции, если известно количество вещества одного из исходных веществ.
Сколько г хлорида цинка можно получить, имея 0,5 моль соляной кислоты? Решение: 1. Записываем уравнение реакции.Билет № 18
Положение в периодической системе: углерод находится во 2 периоде, IV группе, главной (А) подгруппе. Атомный номер углерода 6, следовательно, заряд атома равен + 6, число… Схема расположения электронов по уровням: 6C ) ) 2 4Опыт. Распознавание раствора соли соляной (хлороводородной) кислоты среди трех предложенных растворов.
Добавляем во все три пробирки немного нитрата серебра. В которой выпадет белый творожистый осадок — находится соль соляной кислоты (хлорид): AgNO3 +… или в ионном виде: Ag+ + Cl− = AgCl↓Билет № 19
Положение в периодической системе: кальций находится в 4 периоде, II группе, главной (А) подгруппе. Атомный номер кальция 20, следовательно, заряд атома равен + 20, число… Схема расположения электронов по уровням: 20Ca ) ) ) ) 2 8 8 2Задача. Вычисление количества вещества продукта реакции, если известна масса одного из исходных веществ.
Сколько моль хлорида цинка можно получить, имея 365 г соляной кислоты? Решение: 1. Записываем уравнение реакции.Билет № 20
Положение в периодической системе: железо находится в 4 периоде, побочной (Б) подгруппе VIII группы. Атомный номер железа 26. Заряд атома равен + 26, число электронов 26. Четыре электронных уровня, на… Схема расположения электронов по уровням: 26Fe ) ) ) ) 2 8 14 2Опыт. Распознавание среди трех предложенных веществ кислоты и щелочи.
2. Чтобы распознать среди трех растворов кислоту, капаем в первые три пробирки индикатор лакмус синий или метилоранж (метиловый оранжевый). В… 3. Чтобы распознать щелочь, капаем в оставшиеся три пробирки индикатор… Можно воспользоваться универсальным индикатором: капаем исследуемый раствор на полоску индикаторной бумаги и…Билет № 21
Серная кислота, ее химические свойства в свете представлений об электролитической диссоциации и окислительно-восстановительных реакциях (взаимодействие с металлами, оксидами металлов, основаниями и солями).
Серная кислота — важнейший продукт химической промышленности. Формула серной кислоты H2SO4. Бесцветная маслянистая жидкость, тяжелее воды. При смешивании с водой образуются гидраты, происходит сильное разогревание, поэтому категорически запрещено вливать воду в концентрированную серную кислоту. Следует вливать серную кислоту в воду тонкой струйкой при постоянном перемешивании.
Серная кислота отнимает воду от органических веществ, обугливая их. В промышленности способность концентрированной серной кислоты связывать воду используется для осушения газов.
Серная кислота — сильный электролит, в водном растворе диссоциирует полностью. Окрашивает индикаторы лакмус и метилоранж в красный цвет.
Строго говоря, отщепляется один ион водорода (диссоциация по второй ступени очень мала):
H2SO4 = H+ + HSO4−
Металлы, расположенные в ряду напряжений левее водорода, вытесняют из растворов серной кислоты водород:
Zn + H2SO4 = ZnSO4 + H2↑ (образуется соль — сульфат цинка)
Окислителем в данной реакции является водород кислоты:
Zn0 + H2+1SO4 = Zn+2SO4 + H20↑
Концентрированная серная кислота взаимодействует при нагревании и с металлами правее водорода, кроме золота и платины. Окислителем будет сера. В реакции с медью восстанавливается до оксида серы (IV):
Cu + 2H2SO4 = CuSO4 + SO2↑ + 2H2O (выделяется бесцветный газ)
с указанием степеней окисления:
Cu0 + 2H2S+6O4 = Cu+2SO4 + S+4O2↑ + 2H2O
При концентрации близкой к 100% серная кислота пассивирует железо*, реакция не идет.
С оксидами металлов реакция протекает с образованием соли и воды:
MgO + H2SO4 = MgSO4 + H2O
в ионном виде (оксиды на ионы не раскладываем!):
MgO + 2H+ + SO42− = Mg2+ + SO42− + H2O
MgO + 2H+ = Mg2+ + H2O
Серная кислота реагирует с основаниями, с образованием соли и воды:
2NaOH + H2SO4 = Na2SO4 + 2H2O
в ионном виде:
2Na+ + 2OH− + 2H+ + SO42−= 2Na+ + SO42−+ 2H2O
OH− + H+ = H2O
Качественной реакцией на сульфат-ион является взаимодействие с солями бария — выпадает белый кристаллический осадок сульфата бария, нерастворимый в азотной кислоте:
H2SO4 + BaCl2 = BaSO4↓ + 2HCl
2H+ + SO42− + Ba2+ + 2Cl− = BaSO4↓ + 2H+ + 2Cl−
SO42− + Ba2+ = BaSO4↓
Серная кислота используется для получения многих кислот, так как вытесняет их из солей. В лаборатории так можно получать соляную кислоту (при нагревании, с последующим растворением в воде выделяющегося хлороводорода) и др.:
2NaCl + H2SO4 = Na2SO4 + 2HCl↑
сокращенное ионное уравнение:
Cl− + H+ = HCl↑
Серная кислота применяется в промышленности для очистки нефтепродуктов, поверхности металлов перед нанесением покрытий, очистки (рафинирования) меди, в производстве удобрений, глюкозы и пр.
Получение и собирание углекислого газа. Доказательство наличия этого газа в сосуде.
1. соляную кислоту к мелу: CaCO3 + 2HCl = CaCl2 + H2O + CO2↑ 2. соляной или серной кислоты к соде: Na2CO3 + 2HCl = 2NaCl + H2O +… Закрываем пробирку, где идет реакция, пробкой с газоотводной трубкой. Трубку опускаем в колбу (углекислый газ тяжелее…Билет № 22
Положение в периодической системе: натрий находится в 3 периоде, I группе, главной (А) подгруппе. Атомный номер натрия 11, следовательно, заряд атома натрия равен + 11, число… Схема расположения электронов по уровням: 11Na ) ) ) 2 8 1Билет № 23
Круговорот химических элементов в природе (на примере углерода или азота). Роль живых существ в круговороте химических элементов.
Углерод в природе содержится в различных осадочных горных породах: меле, известняке. Большое количество углерода входит в состав растительной биомассы. Содержание в атмосфере углекислого газа сравнительно невелико — менее 1 % (точнее 0,03 % по объему), но именно этот углерод приковывает сегодня внимание ученых.
Углекислый газ необходим растениям для фотосинтеза. В процессе фотосинтеза образуются органические вещества, служащие источником питания для всех живых организмов. В то же время углекислый газ способен вызывать парниковый эффект.
Это связано с тем, что солнечный свет проходит сквозь атмосферу, нагревает земную поверхность, которая отдает в космос избыток тепла в виде инфракрасных тепловых лучей. Углекислый газ пропускает солнечный свет, но задерживает инфракрасное излучение. В результате повышения концентрации CO2 может произойти глобальное потепление климата, угрожающее таянием полярных льдов. Это вызовет подъем уровня океана и затопление больших площадей суши.
Фотосинтез — основной процесс, постоянно изымающий углекислый газ из атмосферы. В настоящее время происходит сокращение площади лесов, что особенно пагубно — влажных тропических лесов. Загрязнение поверхности океана нефтепродуктами препятствует нормальному газообмену и фотосинтезу водорослей.
В то же время неуклонно растет потребление ископаемого топлива: природного газа, нефти, каменного угля, — при сжигании которого в атмосферу выбрасывается углекислый газ. Углекислый газ выделяется также при гниении органических веществ, дыхании животных и человека.
В создавшейся ситуации, важную роль в регуляции содержания CO2 в атмосфере играют донные отложения карбоната кальция, образующиеся при отмирании мелких морских беспозвоночных. При повышении содержания в атмосфере углекислого газа, он растворяется в воде, известняк вступает с ним в реакцию с образованием гидрокарбонатов, что связывает избыток углекислоты:
CaCO3 + CO2 + H2O 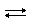 Ca(HCO3)2
Ca(HCO3)2
Если в атмосфере возникает недостаток углекислого газа, равновесие смещается влево, гидрокарбонаты разлагаются с освобождением CO2.
Эти процессы можно представить в виде схемы:
Круговорот углерода в природе
Если попросят написать уравнения, можно привести суммарное уравнение образования глюкозы при фотосинтезе: 6CO2 + 6H2O → C6H12O6 + 6O2 Сжигание метана в составе природного газа:Задача. Вычисление объема газа, вступившего в реакцию, если известна масса одного из продуктов реакции.
2. Сколько литров водорода сгорело, если образовалось 72 г воды? Решение: 1. M (H2O) = 1 • 2 + 16 = 18 г/моль 2. Находим количество вещества воды по условию задачи: n = m / M = 72 г : 18 г/моль = 4 мольБилет № 24
Молекулярная формула аммиака NH3. Три атома водорода соединены с азотом ковалентными полярными связями (азот более электроотрицателен). В… Аммиак — бесцветный газ с характерным резким запахом. Легче воздуха, его можно… Аммиак химически активен. Наличие у атома азота неподелённой электронной пары, не участвующей в образовании связей,…Опыт. Распознавание раствора соли серной кислоты среди трех предложенных растворов солей.
Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl или в ионном виде: Ba2+ + SO42−= BaSO4↓Билет № 25
Источники химического загрязнения воздуха. Пагубные последствия химического загрязнения воздуха. Меры предупреждения химических загрязнений воздуха.
Для уменьшения выбросов необходимо устанавливать очистные сооружения. Снижать потребление металлов за счет производства изделий с меньшими затратами… Перспективным направлением считается разработка способов получения металлов с… 2) Во многих регионах основным источником загрязнений является транспорт, главным образом, автомобильный. Выхлопы…Задача. Вычисление объема газа, необходимого для реакции с определенным количеством вещества другого вещества.
2. Сколько литров кислорода потребуется для сгорания 10 моль водорода? Решение: 1. Записываем над уравнением реакции имеющиеся данные, а под уравнением —… 2. Составляем пропорцию: 10 моль — x моль 2 моль — 1 моль Находим x: x = 10 моль • 1 моль / 2 моль = 5 моль– Конец работы –
Используемые теги: периодическая, система, стала, одним, важ, ших, источников, информации, химических, элементах, образуемых, ими, простых, веществах, соединениях0.175
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Периодическая система стала одним из важнейших источников информации о химических элементах, образуемых ими простых веществах и соединениях
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов