рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Специфичность действия
Реферат Курсовая Конспект
Специфичность действия
Специфичность действия - раздел Химия, БИОХИМИЯ- биологическая химия- это наука, которая изучает биохимический состав и превращения биомолекул, входящих в состав живых организмов · Абсолютная Специфичность- Уреаза- Действует На 1 Субстрат · Относи...
· абсолютная специфичность- уреаза- действует на 1 субстрат
· относительная специфичность –эстеразы- на эфирную связь, пепсин- на пептидную связь
· стереоспецифичность- фермент выбирает в качестве субстрата один из изомеров, например, глицерокиназа- фосфорилирует глицерин, всегда синтезирует L-глицеролфосфат
4) способность катализировать как прямую, так и обратную реакции (обратимость ферментативных реакций ) в зависимости от условий
5) термолабильность- чувствительность к температуре- предпосылка к управлению ходом химических реакций в организме, используется в кардиохирургии
6) чувствительность к изменению рН среды
Каждый фермент- имеет оптимум рН. Для большинства ферментов это рН~6-7, а в кислой или щелочной среде их активность падает.
Исключения: пепсин- рН~1,5-2
Аргиназа -рН ~9,7-10
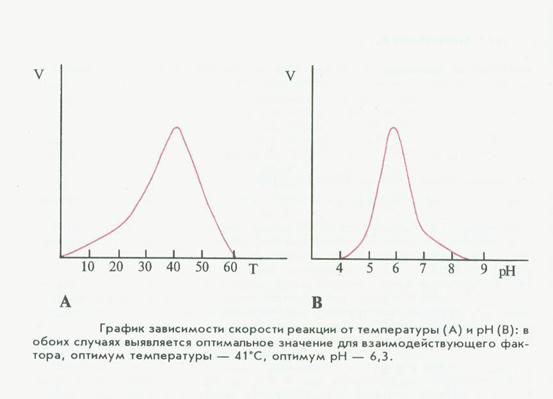
7) зависимость скорости реакции от времени

8) зависимость скорости реакции от концентрации фермента – выражается линейным отрезком до известного предела концентраций, затем- прирост скорости замедляется.

9) зависимость скорости ферментативной реакции от концентрации субстрата
Михаэлис и Ментен- изучали явление насыщения, разработали общую теорию ферментативной кинетики.
10) способность ферментов изменять активность в присутствии активаторов и ингибиторов
5. Единицы измерения активности фермента
Скорость реакции- измеряют количеством продукта, образовавшегося под действием фермента, или количеством исчезающего субстрата ( за единицу времени ).
МЕ- международная единица- количество фермента, катализирующего превращение 1 мкмоля субстрата в минуту ( мкмоль/мин );
Катал(кат)- количество катализатора ( фермента ), способное превращать 1 моль субстрата в секунду)(моль/с).
Когда выразить количество фермента в весовых величинах нельзя- пользуются условными единицами активности ферментов (ЕА).
Удельная активность- мкмоль/мин/мг белка учитывает число ЕА, соотнесенное к массе белка в том же образце.
Молярная активность- количество молекул субстрата, превращенное одной молекулой фермента за 1 минуту
( число оборотов ).
6. Классификация ферментов
1) Систематическая номенклатура.- Конец ХIХст.
Дюкло- предложил добавлять к названию субстрата
суффикс «аза»
Уреаза- гидролиз мочевины ( от англ. «urea» )
Аргиназа
2) Тривиальная номенклатура - названия, не связанные с названием субстрата:
Пепсин, трипсин, тромбин.
3) Международная номенклатура- соглашение 1961г.- 6 классов в
зависимости от типа катализируемой реакции.
1 класс. ОКСИДОРЕДУКТАЗЫ
2 класс. ТРАНСФЕРАЗЫ
3 класс. ГИДРОЛАЗЫ
4 класс ЛИАЗЫ
5 класс ИЗОМЕРАЗЫ
6 класс ЛИГАЗЫ
Каждому ферменту- 4-значный шифр, например
ЛДГ – 1.1.1.27
1.- номер класса- оксидоредуктазы;
1.- подкласс- основные виды субстратов, участвующих в
данном типе химических превращений; ЛДГ действует
на СН-ОН-группу доноров;
1.- подподкласс-акцептором Н+ служит НАД или
НАДФ ( у гидролаз эта цифра уточняет тип гидролизуемой
связи );
27.- порядковый номер- L-лактат:НАД-оксидоредуктаза.
АсАТ- 2.6.1.1
2.- класс трансферазы
2.6. –переносят азотистые группы
2.6.1- аминотрансферазы
2.6.1.1- L-аспартат:2-оксоглутарат-аминотрансфераза.
7. Понятие об изоферментах
ИЗОФЕРМЕНТЫ-различные молекулярные формы ферментов: обусловленные генетически или возникающие в результате посттрансляционной модификации.
Классическим примером изоферментов являются изоферменты ЛДГ
М М ЛДГ5
М М
М М ЛДГ4
М Н
М М ЛДГ3
Н Н
М Н ЛДГ2
Н Н
Н Н ЛДГ1
Н Н
Преобладают:
ЛДГ1, ЛДГ2- сердце, почки, эритроциты,головной мозг;
ЛДГ3 – яичники, лейкоциты, селезенка, лимфоузлы, эпителий, гладкая мускулатура кишечника,, мочеточники, матка, поджелудочная железа;
ЛДГ4,ЛДГ5- печень, скелетные мышцы, кожа.
Действуют на один и тот же субстрат, но отличаются по:
- по химической природе субъединиц, входящих в структуру
- электрофоретической подвижности
- адсорбционным свойствам
- оптимуму рН
- термостабильности
- чувствительности к ингибиторам
- сродству к субстрату и др.
Биологический смысл существования изоферментов
Клиническое значение
8. Понятие об активном центре фермента
АКТИВНЫЙ ЦЕНТР фермента- уникальная комбинация аминокислотных остатков в молекуле фермента, обеспечивающая непосредственное взаимодействие ее с молекулой субстрата ( зона молекулы фермента, которая специфически взаимодействует с субстратом ).
Э.Фишер: фермент и субстрат подходят друг к другу как ключ к замку.
Д.Кошланд: как рука и перчатка
В активном центре различают
а) каталитический участок, непосредственно вступающий в химическое взаимодействие с субстратом
б) связывающий участок- якорную площадку, которая обеспечивает специфическое сродство к субстрату и формирование его комплекса с ферментом

Активный центр химотрипсина
Помимо активного центра, в молекуле фермента
может присутствовать аллостерический центр
( от греч. Аллос-другой, иной, стереос-
пространственный, структурный )
Аллостерические ( регуляторные) ферменты.
Аллостерические ферменты- это разновидность регуляторных ферментов, которые, помимо активного центра, имеют аллостерический ( иной, другой ) центр регуляции, с которым взаимодействуют аллостерические регуляторы ( эффекторы, модуляторы ) – активаторы или ингибиторы.
По своему молекулярному строению эти ферменты состоят из нескольких полипептидных цепей- имеют четвертичную структуру.
В их состав входят каталитический и регуляторный центры, которые находятся на разных белковых субъединицах.
Модификация каталитической активности такого фермента происходит путем передачи на каталитические субъединицы конформационных изменений с регуляторных субъединиц, где они происходят под влиянием эффекторов.
В состав активных центров разных ферментов входят радикалы определенных аминокислотных остатков: ОН-группы серина, треонина, тирозина; имидазольное кольцо гистидина; SH-группа цистеина, СООН-группы дикарбоновых аминокислот, NH3+ группы аргинина и лизина. В образовании активных центров принимают участие кофакторы данного фермента: простетические группы, ионы металлов.
Кривая зависимости скорости реакции от концентрации субстрата для этих ферментов имеет не форму гиперболы, а S-образную, что связано с кооперативными эффектами взаимодействия между субъединицами фермента.
9. Медицинская энзимология
4 направления
Энзимопатология
Энзимодиагностика
Энзимотерапия
Использование ферментов в качестве специфических химреактивов
– Конец работы –
Эта тема принадлежит разделу:
БИОХИМИЯ- биологическая химия- это наука, которая изучает биохимический состав и превращения биомолекул, входящих в состав живых организмов
БИОМОЛЕКУЛЫ обязательные компоненты живых организмов создающие их характерные свойства способность к обмену веществ и энергии... ОБЪЕКТЫ ИЗУЧЕНИЯ БИОХИМИИ живые организмы на разных этапах эволюционного... МЕДИЦИНСКАЯ БИОХИМИЯ биохимия человека раздел биохимии который изучает закономерности обмена веществ и их...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Специфичность действия
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов