Реакции нуклеофильного замещения в ряду карбоновых кислот.
Только с чисто формальных позиций можно рассматривать карбоксильную группу как комбинацию карбонильной и гидроксильной функций. Фактически их взаимное влияние друг на друга таково, что полностью изменяет их собственные свойства.
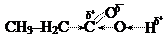 Поляризация двойной связи С=О сильно возрастает за счет дополнительного сдвига свободной электронной пары с соседнего атома кислорода гидроксильной группы:
Поляризация двойной связи С=О сильно возрастает за счет дополнительного сдвига свободной электронной пары с соседнего атома кислорода гидроксильной группы:
Следствием является значительное ослабление связи О–Н в гидроксиле и легкость отщепления атома водорода от него в виде протона (Н+). Появление пониженной электронной плотности (d+) на центральном углеродном атоме карбоксила приводит также к оттягиванию s-электронов соседней связи С – С к карбоксильной группе и появлению (как у альдегидов и кетонов) пониженной электронной плотности (d+) на a- углеродном атоме кислоты.
Самыми слабыми кислотными свойствами обладают предельные монокарбоновые кислоты. Кислотность двухосновных, непредельных или замещённых кислот (галогенкислоты, гидрокси- и оксокислоты и т.п.) заметно выще, что определяется электроноакцепторным действием заместителей и стабилизацией промежуточного аниона.
В общем производные карбоновых кислот по сравнению с альдегидами и кетонами труднее подвергаются нуклеофильной атаке, так как электрофильность карбонильного атома углерода обычно снижается за счет - М-эффекта функционального заместителя, связанного с атомом углерода карбонильной группы. По этой причине для проведения реакций оказывается необходимым кислотный катализ – протонирование aтома кислорода карбонильной группы, что ведет к появлению дополнительного заряда на атоме углерода, что облегчает атаку нуклеофилом.
В итоге механизм катализируемой кислотой реакции по сравнению с механизмом некатализируемой реакции включает предварительную стадию протонирования и заключительную стадию депротонирования.
Реакции конденсации, в основе которых лежит способность одного карбонильного соединения присоединяться к карбонильной группе этого же или другого карбонильного вбединения, характерны и для производных карбоновых кислот, в частности рюжных эфиров и тиоэфиров. Такие реакции имеют большое биологическое значение. С их помощью в организме происходит образование новых связей углерод—углерод. Непременными участниками реакций по типу альдольного присоединения in vivo являются тиоэфиры карбоновых кислот — производные кофермента А. При конденсации ацетилкофермента А по типу альдольного присоединения из двух молекул ацетилкофермента А образуются ацетоацетилкофермент А и кофермент А.