Пространственное строение полипептидов и белков
Для высокомолекулярных полипептидов и белков наряду с первичной структурой характерны более высокие уровни организации, которые принято называть вторичной, третичной и четвертичной структурами.
Вторичная структура описывается пространственной ориентацией основной полипептидной цепи, третичная – трехмерной архитектурой всей белковой молекулы. Как вторичная, так и третичная структуры связаны с упорядоченным расположением макромолекулярной цепи в пространстве. Вторичная структура закрепляется, как правило, с помощью водородных связей между пептидными группами, довольно близко расположенными в цепи α-аминокислотных остатков. Ее основные виды — α-спираль и β-структура. Третичная структура (глобулярная или фибриллярная) стабилизируется не только водородными связями, но и другими видами взаимодействий, например ионным, гидрофобным, а также «сульфидными» связями.
Первые три уровня характерны для структурной организации всех белковых молекул. Четвертый уровень встречается при образовании единых белковых комплексов, состоящих из нескольких полипептидных цепей.
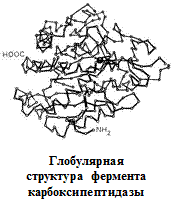
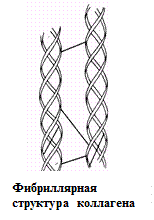
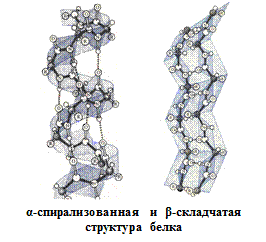 Определяющее значение в формировании более высоких уровней организации белковых молекул имеет их первичная структура. Природа α-аминокислотных остатков и порядок их соединения обусловливают характер стабилизации более высокоорганизованных структур.
Определяющее значение в формировании более высоких уровней организации белковых молекул имеет их первичная структура. Природа α-аминокислотных остатков и порядок их соединения обусловливают характер стабилизации более высокоорганизованных структур.