рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Лабораторна робота №1
Реферат Курсовая Конспект
Лабораторна робота №1
Лабораторна робота №1 - раздел Химия, ХІМІЯ. Лабораторний практикум Техніка Безпеки При Роботі У Хімічній Лабораторії. Методи Виділенн...
Техніка безпеки при роботі у хімічній лабораторії. Методи виділення і очищення речовин.
Основні теоретичні питання.
Правила поводження в хімічній лабораторії, поняття речовини, класифікація речовин за ступенем чистоти, методи очищення твердих та рідких речовин, основний хімічний посуд (назви та призначення).
Мета роботи: ознайомити студентів з основними правилами техніки безпеки при роботі у хімічній лабораторії; навчити організації праці і робочого місця для наступних робіт; засвоїти основні прийоми лабораторного експерименту.
Обладнання та реактиви: хімічний посуд; штатив з набором реактивів; технічні ваги і рівноваги до них; фільтрувальний папір (фільтри), хімічні склянки різної ємності, скляні палички, штатив з кільцем.
Хід роботи
Дослід 1. Фільтрування.
В хімічну склянку або колбу налити води, яка містить механічні домішки (пісок) та розчинені солі (наприклад, NaCl), приготувати складчастий паперовий фільтр і помістити його у лійку, закріплену у кільці штативу. Під лійку поставити другу хімічну склянку так, щоб витягнутий кінець лійки торкався стінки склянки і рідина при фільтруванні не розбризкувалась, а стікала по стінці. Воду в лійку необхідно наливати на 2-3 мм нижче країв фільтру, обережно, за допомогою скляної палички, яку тримати над лійкою під кутом.
Якщо на дні склянки залишився нерозчинний осад, необхідно перенести його на фільтр, додавши трохи води та збовтавши.
Записати спостереження. Намалювати прилад.
Дослід 2. Возгонка (сублімація).
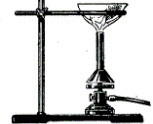
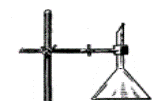 Одержати у лаборанта кристалічний йод та помістити його у порцелянову чашку. Закріпити її в штативі над пальником, а зверху над нею розмістити скляну лійку або колбу з водою. За допомогою газового пальника обережно, на маленькому полум’ї, нагрівати чашку, слідкуючи, щоб пари йоду не виходили назовні, а охолоджуючись, осідали на стінках лійки або дні колби.
Одержати у лаборанта кристалічний йод та помістити його у порцелянову чашку. Закріпити її в штативі над пальником, а зверху над нею розмістити скляну лійку або колбу з водою. За допомогою газового пальника обережно, на маленькому полум’ї, нагрівати чашку, слідкуючи, щоб пари йоду не виходили назовні, а охолоджуючись, осідали на стінках лійки або дні колби.
По закінченні охолодити прилад, обережно шматочком фільтрувального паперу перенести йод з колби у чистий бюкс з притертою кришкою. Записати спостереження. Возгонкою очищають також кристалічний амоній хлорид, бензойну кислоту.
Дослід 3. Перегонка (дистиляція)
Проста перегонка при атмосферному тиску доцільна для очищення рідин від нелетких або важколетких речовин. На рисунку наведено прилад для дистиляції води, який складається з колби (1), холодильника Лібіха (2), форштоса (3), алонжа (4) та приймача (5). 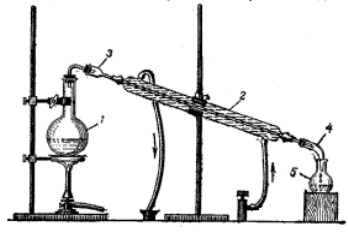 Зібрати прилад для перегонки, як показано на рисунку. Провести перегонку розчину етилового спирту.
Зібрати прилад для перегонки, як показано на рисунку. Провести перегонку розчину етилового спирту.
Дослід 4. Перекристалізація
Необхідно приготувати насичений розчин мідного купоросу. Для цього до хімічної склянки внести невелику кількість солі СuSO4∙H2O. Додати 25-30 мл води і розчинити сіль при нагріванні. Охолодити розчин. Спостерігати, як частина розчиненої солі випадає в осад. Утворені чисті кристали відокремити від розчину фільтруванням, висушити та порівняти їх за кольором з вихідною забрудненою сіллю. Зробити висновки.
Дослід 5. Лабораторний посуд
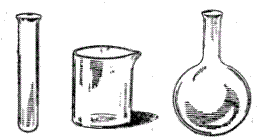
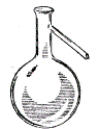
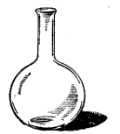
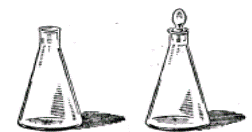
Найчастіше в лабораторній практиці для проведення хімічних реакцій, приготування і зберігання розчинів використовується наступний посуд (рис.1): скляні пробірки (1); хімічні склянки (2); колби круглодонні (3), плоскодонні (4), Вюрца (5), конічні (6, 7); реторти (8) та колби для промивання (10). Для перекристалізації речовин використовують кристалізатор (9).
 | |||
 | |||
1 2 3 4 5
 | |||
 | |||
6 7 8 9 10
рис.1
З метою запобігання поглинання речовинами вологи з повітря їх зберігають в ексикаторі (рис. 2 а), який заповнений сухим повітрям та водопоглинаючими речовинами і застосовується для повільного висушування та збереження речовин, що легко поглинають вологу повітря.
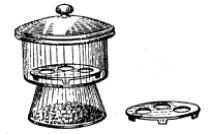

Як водопоглинаючі речовини в ексикаторах застосовуються прожарений кальцій хлорид або концентрована сульфатна кислота.
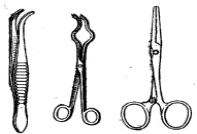
Гарячі предмети переносять з одного місця на інше за допомогою порцелянової підставки (б), пінцетів (в) або тигельних щипців (г, д) (рис. 2).
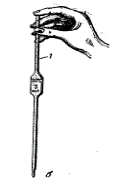
Для закріплення посуду під час роботи застосовують залізні штативи з затискачами (1) та кільцями (2) (рис. 3). Якщо треба прогріти пробірку нетривалий час, то її можна не закріпляти на штативі, а тримати в руці за допомогою тримача для пробірок.
При проведенні хімічних дослідів часто доводиться розчиняти речовини, фільтрувати рідини, промивати осади та визначати густину розчинів ареометром.


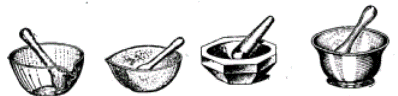
 Для подрібнення кристалічних речовин перед розчиненням до порошкоподібного стану використовують скляні (рис. 4, а), порцелянові (рис. 4, б), агатові (рис. 4, в) та металеві (рис. 4, г) ступки.
Для подрібнення кристалічних речовин перед розчиненням до порошкоподібного стану використовують скляні (рис. 4, а), порцелянові (рис. 4, б), агатові (рис. 4, в) та металеві (рис. 4, г) ступки.
При випарюванні рідин найчастіше застосовуються порцелянові чашки.
|
Для вимірювання об¢єму рідини використовують мірний посуд: колби, циліндри (рис.4,д), мензурки (рис.4,е). Мірними колбами (рис.5,а) користуються в тих випадках, коли необхідно одержати певний об¢єм рідини. Ці колби можуть бути різної місткості: від 25 мл до 2 л включно.
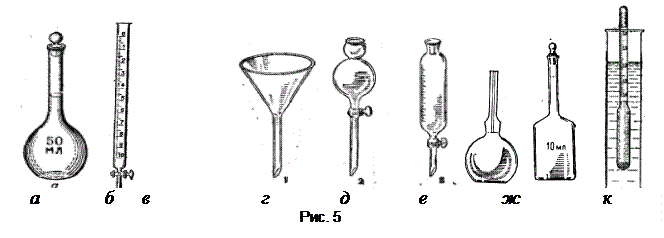
Для точного вимірювання об¢єму рідини також використовують титрувальні бюретки (рис.5,б) та піпетки (рис.5,в) місткістю від 1 до 100 мл. Для фільтрування осадів застосовують скляні лійки (рис. 5,г).
Для дозування рідин користуються крапельними лійками (рис.5,д), а для розділення рідин, що не змішуються, – ділильними лійками (рис.5,е).
Кожний розчин певної густини має відповідну концентрацію. Для визначення концентрації розчину за його відносною густиною користуються ареометром (рис.5, к). Ареометром можна визначати густину розчину швидко, але досить приблизно. Тому для точного визначення густини розчину застосовують пікнометри (рис. 5, ж).
– Конец работы –
Эта тема принадлежит разделу:
ХІМІЯ. Лабораторний практикум
Київський національний університет технологій та дизайну... ХІМІЯ Лабораторний практикум...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Лабораторна робота №1
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов