Основні теоретичні питання.
Визначення та формули для обчислення молярних мас еквівалентів простих та складних речовин різних класів; еквівалентний об’єм газоподібних речовин; формулювання та математичний вираз закону еквівалентів.
Мета роботи: ознайомитись з методом визначення молярної маси еквіваленту металу за об’ємом водню, що витискається металом при взаємодії з кислотами - неокисниками.
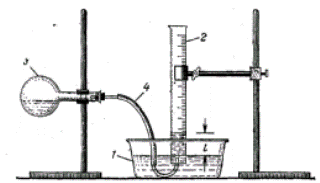 Обладнання і реактиви: прилад для визначення еквіваленту металу (див. рис.); наважку металу; розчин хлоридної кислоти (2 н); термометр, барометр.
Обладнання і реактиви: прилад для визначення еквіваленту металу (див. рис.); наважку металу; розчин хлоридної кислоти (2 н); термометр, барометр.
Хід роботи
В основі методу визначення еквівалентної маси металу лежить реакція взаємодії металів, які розташовані в електрохімічному ряді напруг металів до Гідрогену, з кислотами-неокисниками:
Ме + nНСІ = МеСІn + 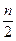 Н2↑, n-валентність металу.
Н2↑, n-валентність металу.
Для роботи необхідно взяти порошок металу (магнію, алюмінію, цинку і т.д.).
В колбу ємкістю 100 мл (3) налити 10 мл розведеної хлоридної кислоти і закріпити її в штативі.
В мірний циліндр (2) налити воду, закрити скляною пластиною так, щоб не було пухирців повітря, перевернути догори дном та опустити його отвором в кристалізатор з водою (1). Зняти під водою скляну пластину. Циліндр закріпити вертикально. В горло колби (3) покласти наважку металу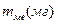 , щільно закрити пробкою з газовідвідною трубкою (4). Кінець трубки ввести в отвір циліндра. Перевести колбу (3) у вертикальне положення, щоб метал впав у кислоту. В ході реакції водень, що утворюється, надходить у циліндр і витискає з нього воду. Після закінчення реакції необхідно визначити в циліндрі об’єм утвореного газу,
, щільно закрити пробкою з газовідвідною трубкою (4). Кінець трубки ввести в отвір циліндра. Перевести колбу (3) у вертикальне положення, щоб метал впав у кислоту. В ході реакції водень, що утворюється, надходить у циліндр і витискає з нього воду. Після закінчення реакції необхідно визначити в циліндрі об’єм утвореного газу, 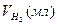 , висоту стовпчика води в циліндрі від поверхні води в кристалізаторі, h(мм), записати показники барометра –
, висоту стовпчика води в циліндрі від поверхні води в кристалізаторі, h(мм), записати показники барометра – 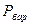 (кПа) та термометра – tдосл.(
(кПа) та термометра – tдосл.(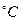 ).
).
Розрахункова частина
Всі необхідні для розрахунків експериментальні дані по варіантах наведено в таблиці 3.1. Номер варіанту відповідає порядковому номеру студента у списку. Виконавши потрібні розрахунки, студент має визначити еквівалентну масу і назву металу.
Таблиця 3.1
| № п/п | 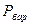 (кПа) (кПа)
| tдосл.(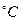 ) )
| h(мм) | 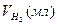
| 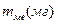
| Валентність |
| 99,2 | 92,5 | ІІ | ||||
| 98,7 | І | |||||
| 101,6 | 38,5 | ІІ | ||||
| 102,3 | ІІ | |||||
| 99,5 | ІІ | |||||
| 98,3 | І | |||||
| 100,5 | ІІІ | |||||
| 102,4 | ІІ | |||||
| 99,8 | ІІ | |||||
| 98,9 | ІІ | |||||
| 100,1 | І | |||||
| 100,7 | ІІ | |||||
| 98,6 | ІІ | |||||
| 102,1 | ІІ | |||||
| 101,8 | ІІ |
Молярну масу еквівалента металу за законом еквівалентів розраховуємо двома способами:
1. Через масу виділеного водню.
Застосовуючи рівняння стану ідеального газу Клапейрона - Менделєєва 
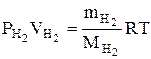 ,
,
визначити масу водню 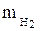 , який виділився в ході хімічної реакції.
, який виділився в ході хімічної реакції.
Тиск водню в циліндрі (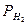 ) визначити із співвідношення:
) визначити із співвідношення:
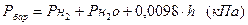 ,
,
де 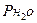 - тиск насиченої водяної пари (кПа) при температурі досліду (табл. 3.2),
- тиск насиченої водяної пари (кПа) при температурі досліду (табл. 3.2),
h – висота стовпчика води в циліндрі від поверхні води в кристалізаторі, мм.
Таблиця 3.2