Наследственные изменения как ошибки матричных и генетических процессов
Возникновение наследственных изменений следует рассматривать как закономерный итог ошибок или нарушений двух процессов: матричных и генетических. Предложение выделять особо матричные процессы — РЕПЛИКАЦИЮ, ТРАНСКРИПЦИЮ и ТРАНСЛЯЦИЮ — от остальных метаболических процессов в клетке было сделано в 1966 году английским генетиком G. Pontecorvo (цит. по Инге-Вечтомову, 1976, с. 58). Матричные процессы связаны с перекодированием генетической информации на новые матрицы ДНК — ДНК, ДНК — РНК и РНК — белок.
Под понятием "генетические процессы" в узком смысле слова можно понимать процессы, которые определяют относительную устойчивость, структурную и функциональную стабильность носителей генетической информации и закономерный характер их распределения между дочерними клетками. К генетическим процессам относятся РЕПАРАЦИЯ, РЕКОМБИНАЦИЯ и СЕГРЕГАЦИЯ.
На рис. 4 схематически представлены две группы процессов и взаимосвязи между ними, которые определяют появление наследственных изменений. Детали процессов описаны в соответствующих сводках (Стент, Кэлинджер , 1981; Инге-Вечтомов, 1983; Льюин, 1987). Мы остановимся лишь на некоторых моментах.
Необходимо особо подчеркнуть аспект факультативности в осуществлении всех трех видов матричных процессов у эукариот (рис. 4).
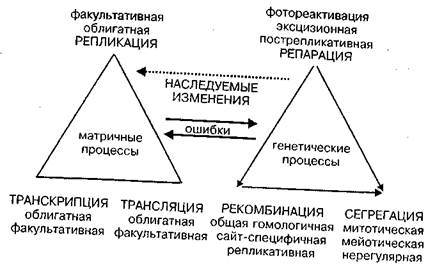
Рис. 4. Наследуемые изменения как процесс, результат ошибок в матричных и генетических процессах. Метаболические связи между процессами указаны стрелками
Системы ДНК-репарации определяют стабильность и степень ошибок в ходе матричных и генетических процессов и связаны с физиологией клетки.
Факультативность матричных и генетических процессов служит важным доводом в пользу сформулированного нами ранее принципа облигатности — факультативности в структуре и функции генома (глава 4). Факультативность репликации означает возможность относительно автономной гипер- или гипорепликации отдельных сегментов ДНК, независимо от плановой закономерной репликации всей молекулы ДНК или хромосомы на определенной стадии клеточного цикла. Такими свойствами обладают участки гетерохроматина. Факультативная репликация приводит к амплификации отдельных участков в пределах хромосом, либо к их автономному существованию в цитоплазме в виде линейных или кольцевых плазмид. Регулярность спонтанной факультативной амплификации доказана прямыми опытами (Johnston, et. al, 1983).
Факультативность транскрипции состоит в возможности появления разных мРНК с одной и той же матрицы за счет существования альтернативных промоторов и альтернативного сплайсинга. Наконец, факультативность трансляции проявляется в разных вариантах опознания одного и того же кодона, например опознания его как стоп–кодона, или как значащего кодона для включения определенной аминокислоты в белке. Эта факультативность, или, как ее иногда называют, неоднозначность трансляции зависит от физиологических условий клетки и ее генотипа (Инге-Вечтомов, 1983).
В физиологической теории мутационного процесса М. Е. Лобашева появление мутации впервые связывалось со способностью клетки к репарации повреждений. Отсюда следовал вывод о том, что появлению мутации предшествует предмутационое состояние, когда потенциальное повреждение либо полностью обратимо, либо может реализоваться в виде мутации, понимаемой как "нетождественная репарация" (Лобашев, 1976). В своей гипотезе М. Е. Лобашев следовал концепции паранекроза, разработанной Д. Н. Насоновым и В. Я. Александровым и установившими закономерности ответа клетки на повреждения (Александров, 1985).
Действительно, определяющим звеном в возникновении генетических изменений и в триаде матричных, и в триаде генетических процессов является феномен репарации. Уже к началу 70-х годов стало ясно, что "высокая стабильность ДНК в клетке не является имманентным свойством самих молекул ДНК, а поддерживается особой ферментативной системой, находящейся, в свою очередь, под генетическим контролем" (Захаров, 1976).
Представим на миг, что репарации нет. В. А. Кордюм (1993) суммировал оценки потенциального давления мутаций и эффективности репараций для генома человека. В клетках млекопитающих каждый час происходит не менее 5000 спонтанных повреждений ДНК или 120 000 повреждений генома в сутки. Из расчета на один ген и одно клеточное деление, из 252 потенциальных повреждений ДНК лишь одно реализуется в виде изменения. Это дает эффективность репарации 0,996!
Процессы репарации разнообразны, они сочетают специфичные и неспецифичные ответы (Корогодин, 1985). Особенно удивительна система быстрого реагирования, так называемый SOS-ответ, когда после самых разных повреждений клетки, вызывающих появление однонитевых разрывов ДНК, происходит одновременная дерепрессия около 15 белков, участвующих в процессах репарации. Об этом упоминалось ранее, но отметим основные звенья удивительной системы. Ключевыми являются два гена recА и lexA, которые эпигенетически негативно регулируют друг друга на уровне взаимодействий ДНК — белок и белок –белок. RecA, будучи активирован в ответ на повреждения, расщепляет белок LexA, который в остальное время (когда повреждений нет) подавляет транскрипцию гена recА.
Продукт структурного гена lexA, белок-димер, тормозит уровень собственной транскрипции. В терминах динамической наследственности lexA представляет собой однокомпонентный эпиген с отрицательной обратной связью. LexA белок является негативным транскрипционным регулятором для примерно 15 генов, участвующих в разных формах репарации ДНК, и в их числе ген recА — ведущий в SOS-ответе.
Белок RecA многофункционален: в норме он вовлечен в рекомбинацию молекул ДНК и в то же время является сигнальным геном для запуска SOS-систем. При появлении повреждений в ДНК (однонитевые разрывы) ген recА меняет свою конформацию, приобретая свойства фермента-протеазы. Он расщепляет димеры белка LexA, в результате чего этот белок утрачивает свои репрессорные функции. Таким образом, меняя свою конформацию при повреждениии и превращаясь в протеазу, RecA — белок снимает тормоз, налагаемый LexA белком, со считывания своей мРНК. Интенсивность синтеза RecA при стрессовом воздействии возрастает в среднем в 50 раз. При устранении повреждения SOS-ответ останавливается.
Когда знакомишься с системой SOS-ответа бактериальной клетки на вызов среды, то становится очевидной правота одного из основных тезисов современного французского эволюциониста П. Грасси (Р. Grasse), что "жить — значит реагировать, а отнюдь не быть жертвой" (цит. по Чайковский, 1991, с. 163). Клетка обладает не только запрограммированными в ее геноме ответами на стресс, вроде SOS-реакций или генов теплового шока, но способна к генетическому поиску путем активации ранее молчащих мобильных генетических элементов, понижения информационных барьеров для проникновения в клетку и рекомбинационной интеграции чужеродной ДНК, а также запуска других систем непредсказуемой реорганизации генома в поисках ответа на стрессовый вызов среды (Корогодин, 1986). Поисковые функции генетической системы в условиях геномного стресса — важная тема в Нобелевской лекции Б. МакКлинток (McClintock, 1984).
Рассмотрим теперь вкратце связь мутаций и рекомбинацией. С середины 70-х годов стала выявляться существенная эволюционная роль "ошибок рекомбинации" как поставщика наследственных изменений, гораздо более мощного, чем ошибки редупликации. Теперь очевидно, что генетическая рекомбинация "во всем многообразии ее форм и механизмов является главным фактором непостоянства генома, основой большинства его изменений, которые служат материалом для отбора, для микро- и макроэволюции. Именно рекомбинационные события приводят к возникновению или получению извне качественно новых генов, о которых до этого вид не мог даже мечтать" (Хесин, 1984, с. 294).
На молекулярном уровне различают три вида рекомбинации: общую, сайт-специфичную и репликативную. Для первой или "законной", регулярной рекомбинации (кроссинговер) необходимы длинные районы гомологии ДНК. Она осуществляется "врожденными" клеточными системами при конъюгации у бактерий и при мейозе у эукариот. И рекомбинационный акт, и репарация включают разрывы в цепи ДНК, их сшивку и восстановление. Сайт-специфичная рекомбинация довольствуется короткими, в несколько оснований, участками гомологии, какие, к примеру, имеют ДНК фага лямбда и хромосомы бактерии. По сходному сценарию происходят включение в геном мобильных генетических .элементов и регулярно происходящая в течение онтогенеза соматическая локальная рекомбинация между иммуноглобулиновыми генами, создающая их поразительное разнообразие.
Ошибки гомологичной рекомбинации можно рассматривать как закономерные последствия не точковой, а линейно протяженной структуры генов. Возникает своеобразная дилемма: "Вообще можно говорить, что митотические рекомбинации являются своеобразным типом мутагенеза или, наоборот, что некоторые виды мутагенеза (хромосомные аберрации) являются результатом "ошибок" митотических рекомбинаций" (Хесин, 1984, с. 310).
Расширились и рамки понятия "соматические мутации", под которыми теперь подразумеваются "любые наследуемые в клеточных поколениях изменения нуклеотидной последовательности, числа или топографии генов и регуляторных участков ДНК: точковые и другие микроизменения, мультипликация генов, разные хромосомные аберрации, включая нехватки, транслокации генов, перемещения к ним подвижных элементов, изменения числа хромосом и т. д." (Хесин., 1984, с. 279).
Если перемещения мобильных элементов или рекомбинация участков запрограммированы в онтогенезе, опять возникает трудность классификации таких наследственных изменений. Трансформацию пола у дрожжей долго считали мутационным событием, но оказалось, что на определенной стадии развития аскоспор она происходит с вероятностью, близкой к 1, в результате сайт-специфичной рекомбинации (Инге-Вечтомов С. Г, 1982).
Ошибки гомологичной рекомбинации приводят к дупликации сегментов ДНК. А. С. Серебровский в 1938 г. впервые выдвинул идею, что возникновение новых генов может быть основано на их дупликации и последующей дивергенции с утратой "дуплетных" (общих с гомологом) функций. Теперь очевидно, что дупликация генов, их организация в мультигенные семейства разной структуры — одна из характерных черт организации генома эукариот.
В мультигенные семейства организованы основные жизненно важные гены или "гены домашнего хозяйства" — локусы, контролирующие белки рибосом — клеточных органелл, где происходит синтез белка, локусы, кодирующие гистоновые гены, транспортные РНК. При этом блоки могут быть организованы из тандемно повторенных генных копий, скоплений копий, разделенных промежуточной ДНК (спейсерами) и из разбросанных по геному копий (как в случае транспортной РНК).
Стоит только образоваться тандемной копии гена, как этот тандем, словно участок кристаллизации, закономерно ведет к процессу дальнейшего умножения копий. Число копий в тандеме или семействе — видовой признак. Видовые ограничители числа копий еще предстоит познать.
Существует механизм закономерного образования копий за счет действия ревертазы, когда с мРНК гена образуется его ДНК — копия, которая рекомбинационно интегрируется в разные места генома, образуя "псевдоген", неспособный к транскрипции. Около 10% генов Генома имеют варианты псевдогенов, создавая своеобразный эволюционный потенциал.
Транспозоны и вирусы, способные интегрироваться в геном эукариот, создают множество гомологичных участков в удаленных по разным хромосомам точках. По ним происходят рекомбинационные события. Закономерные рекомбинационные перемещения участков ДНК лежат в основе колоссального разнообразия клеточных клонов В-лимфоцитов — продуцентов специфических антител. После того, как такое разнообразие создано, включается селективный механизм размножения определенного клона, обеспечивающего защитную реакцию по отношению к данному антигену (Хесин, 1984).
Эти несколько примеров показывают, что рекомбинацию ни в коем случае нельзя сводить к перетасовке уже существующих генов, как в колоде карт. Рекомбинация — мощный источник новообразований внутри имеющихся генов, источник создания новых генных конструктов, способ репарации и механизм включения новых генетических элементов и обеспечения потока генов между клетками одного вида и генными системами разных видов. Если продолжить аналогию с колодой карт, то в результате рекомбинации происходит не только перетасовка, но изменяется их число, появляются "дамо — валеты" или "дамо — короли", "двойные тузы" или "тройка — семерка — туз" в одной карте, причем разных мастей, и прочие трудновообразимые новации. По такому сценарию, полагают, возникли белки с множественными функциональными сайтами, новые системы генного регулирования.
Впервые пример образования новых необычных генных конструкций в природе с участием мобильных элементов был обнаружен нами при исследовании вспышек мутаций в естественных популяциях дрозофил D. melanogaster. Два соседних вполне независимых друг от друга гена singed "вильчатые щетинки" и "зачаточные крылья" оказались "сшитыми" друг с другом и попали под контроль мобильного элемента. В результате эти гены стали совместно проявляться и совместно мутировать, так что от двойного нестабильного мутанта при разных перемещениях транспозона возникали нормальные особи и от них вновь двойные мутанты.
В 1978 году инсерционный механизм появления этого двойного "крылощетинкового" мутанта (модель перспективного монстра по Гольдшмидту) был предсказан на основании генетического анализа (Голубовский, Захаров, 1979; Golubovsky, 1980). 20 лет спустя гипотеза нашло полное молекулярное подтверждение. Обнаружена инсерция транспозона hobo в первый интрон гена singed и вызванные этим транспозоном внутрилокусные перестройки при переходах норма — двойной мутант — норма и т, д. (О'Hare, et al., 1998).
Все белки ферменты, с которыми работают генные инженеры — рестриктазы, лигазы, полимеразы, эндо- и экзонулеазы и прочие — все до одного выделены из живых организмов. Все это созданные самой природой инструменты для перестроек генома, перетосовок генов, собирания модулей и создания новых генных конструкций. Полностью оправдалось предвидение. МакКлинток, что клетки имеют системы для реорганизации своего генома в ответ на стрессовые условия, вызов среды (McClintock, 1978, 1984). В продолжение этой идеи, совокупность клеточных механизмов структурно–функциональной реорганизации генома было предложено удачно именовать как "natural genetic engineering" — или природная генетическая инженерия (Shapiro J., 1992, 1995). Возможно, отдельные звенья этих запрограммированных геномных ответов на стресс перекрываются с теми, которые активируются при SOS-ответе или тепловом шоке. Конкретные примеры действия таких механизмов у прокариот и эукариот собраны в специальном томе статей, написанных крупными современными генетиками к 90-летию Б. МакКлинток (The Dynamic genome..., 1991).