Репликация вирусов с линейными двуцепочечными ДНК
Сем. Adenoviridae.
Названы так потому, что были выделены из опухоли, называемой аденомой. Вирусы животных, не имеют липопротеидной оболочки, капсид икосаэдрический, Ø 70 нм. Геном представлен линейной двуцепочечной ДНК длиной около 40 000 п.н. На концах имеются инвертированные повторы длиной 100-200 п.н. C 5’-концами цепи ковалентно связан вирусный терминальный белок (Terminal protein) массой 55 кДа. Связь фосфодиэфирная между серином белка и 5’-концевым остатком дезоксицитидиловой кислоты. Белок может олигомеризоваться, поэтому в электронный микроскоп молекулы ДНК выглядят кольцевыми.
|

Репликация, как у большинства ДНК-содержащих вирусов, проходит в ядре. Необходимо, чтобы клетка находилась в S-фазе клеточного цикла. Однако, вирус может размножаться и в неделящихся клетках, стимулируя их переход к делению. В ядре вирусная ДНК, видимо, благодаря терминальному белку фиксируется на определенных структурах, где и происходит ее репликация.
Общая схема репликации.
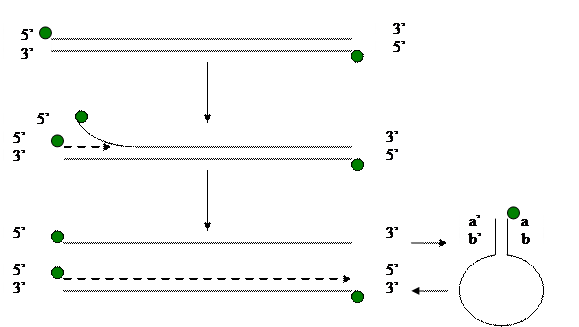
На дуплексе ДНК синтезируется дочерняя цепь с вытеснением материнской цепи. Вытесненная цепь за счет инвертированных повторов образует структуру типа «сковородки с ручкой» и на этой структуре происходит синтез второй цепи по типу репаративного синтеза ДНК.
Теперь рассмотрим процесс репликации более детально.
I. Синтез нуклеотид-белковой затравки.
В процессе участвуют следующие вирусные белки продукты экспрессии генов, находящихся в одной транскрипционной единице (о транскрипции позже). Это ДНК-полимераза (~140 кДа), pTP (precurser TP) (80 кДа) предшественник терминального белка. Белки образуют прочный комплекс друг с другом и вместе находят соответствующее место на дуплексе ДНК, попавшем в клетку. На концах находятся последовательности, консервативные у аденовирусов всех серотипов и необходимые для присоединения полимеразы с pTP (участок 9-18 п.н.). Однако это взаимодействие слабое и в отсутствии дополнительных белков полимераза и рТР осуществляют инициацию репликации неэффективно. Взаимодействие вирусных белков с ДНК стабилизируют клеточные белки. К участку 9-18 п.н. примыкает сайт связывания транскрипционного фактора NF-1(Nuclear Factor) (18 – 40п.н.), узнающего элемент СААТ (другие названия белка: CTF-1, CAT-1). Связываясь с ДНК, NF-1 взаимодействует с комплексом полимеразы и рТР и способствует их посадке на ДНК. К сайту связывания NF-1 примыкает сайт связывания другого транскрипционного фактора – Oct1 (OTF). В инициации участвует еще один вирусный белок – ДНК-связывающий белок взаимодействующий преимущественного с одноцепочечной ДНК. Он нужен в основном для элонгации, а здесь он, возможно, способствует подплавлению конца дуплекса.

В образовавшемся комплексе рТР через серин ковалентно связывается с С, но этот С комплементарно присоединен к G второго триплета. Далее полимераза синтезирует CAT и происходит скольжение триплета назад, теперь он связан с первым GAT-триплетом.
Если 3’-конец будет поврежден, то перед инициацией сначала произойдет достройка этой цепи по комплементарной. Ковалентное присоединение С к рТР может происходить и вне комплекса с ДНК.
Далее мы неоднократно будем встречаться с подобной ситуацией, когда при инициации чтение матрицы происходит чуть подальше от концевого нуклеотида с последующим скольжением назад олигонуклеотид-полимеразного комплекса.
Полагают, что посредством терминального белка ДНК закреплена в ядре и репликация происходит на фиксированной матрице. Если учесть, что терминальный белок способен к олигомеризации, то тогда получается, что, возможно, репликация происходит на циркуляризованной ДНК. In vitro показано, что помимо выше перечисленных белков в репликации участвует топоизомераза. Возможно, она сбрасывает сверхвитки, образующиеся при репликации закрепленного дуплекса ДНК. Это еще является гипотезой.
II. Элонагция репликации.
Осуществляется вирусспецифической ДНК-полимеразой с вытеснением цепи. Процесс не требует участия хеликазы. Нужен вирусный ДНК-связывающий белок. Этот белок состоит из двух доменов: один собственно – ДНК-связывающий, другой – домен олигомеризации. По мере появления одноцепочечных участков ДНК, белок кооперативно связывается с ними. Клеточный аналог не может заменить вирусный ДНК-связывающий белок.
Полимераза высокопроцессивна, обладает также 3’-5’ экзонуклеазной активностью (proofreading activity), позволяющей исправлять ошибки включения нуклеотидов.
III. Терминация репликации.
Особых механизмов нет, синтез run-off: достигнув конца матрицы, полимераза отделяется от нее.
Процессинг терминального не имеет отношения к репликации и осуществляется одной из вирусных протеаз при сборке вирусных частиц.
В вирионе ДНК образует довольно прочный нуклеопротеидный комплекс с вирусными щелочными белками, аналогичный клеточным нуклеосомам. Эти щелочные белки препятствуют репликации; в клетке они удаляются с помощью клеточных кислых белков.
Упаковка ДНК начинается с «левого» конца, где на расстоянии 200-400 п.н. находится сигнал упаковки. Механизм неясен.
Возможно, существует минорный путь репликации ДНК аденовирусов с участием кольцевых молекул. В 1970-1980 годах в Nature канадец Грэм опубликовал три работы по механизмам репликации аденовирусов. В инфицированных аденовирусами клетках он обнаружил кольцевые ковалентно-непрерывные ДНК сшитые по типу «голова к хвосту». Они инфекционны и при заражении ими клеток в клетках обнаруживаются линейные ДНК. Грэм предположил, что существует еще один способ репликации ДНК аденовирусов.
Может быть предложенная схема правильная, тогда, каким образом, из кольцевых молекул можно получить линейные с помощью нуклеотид-белковой затравки? Грэм предложил вполне правдоподобную, но до конца не доказанную модель.
В кольцевой молекуле концы дуплекса сочленены голова к хвосту, а на концах имеются палиндромные последовательности. Тогда, эти палиндромы могут образовать шпилечную структуру.
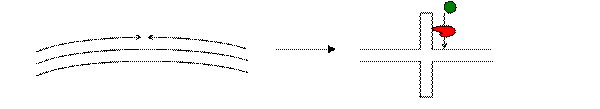
В таком случае вершина этой шпилечной структуры соответствует концу линейного дуплекса. В шпильке имеются все последовательности, необходимые для связывания полимеразы, рТР и факторов NF-1 и Oct-1. В принципе, ничто не мешает инициации репликации на этой структуре.
Если это так, то мы видим, что нуклеотид-белковая затравка может использоваться не только для терминальной, но и для внутренней инициации репликации. С ее участием репликация может инициироваться не только на линейных, но и на кольцевых молекулах ДНК. Может быть, и в эволюции был такой переход.
Использование аденовирусов в генной терапии. В принципе, можно заражать неделящиеся клетки. Проблема заключается в снижении активности вирусных онкобелков, во избежание побочных эффектов вирусной инфекции. У отдельных серотипов аденовирусов есть предпочтение в отношении типа инфицируемых клеток. Существовал проект по лечению такого заболевания легких как кистозный фиброз с помощью адновирусных векторов. На молекулярном уровне заболевание связано с повреждением гена одного из ионных каналов, и лечение заключалось во введении в составе вирусного вектора этого гена.