Пространственная (стереоизомерия)
Пространственная изомерия обусловлена различным пространственным расположением атомов при одинаковом порядке их связывания.
Различают:
1) геометричекую (цис-, транс-изомерию)
Наиболее устойчивы транс-изомеры, поэтому в природе они наиболее распространены.
Цис-форма — 2 заместителя расположены по одну сторону плоскости двойной связи.
Транс-форма – 2 заместителя расположены по разные стороны плоскости двойной связи.
2) Оптическая изомерия
Для описания пространственных различий используют два важнейших понятия: конфигурация и конформация молекул.
Конфигурация –определенное пространственное расположение атомов в молекуле, без учета различий, возникающих вследствие вращения вокруг одинарных связей.
В основе пространственного строения лежит предположение Вант-Гоффа (1874 г) о тетраэдрической конфигурации атома углерода, которое впоследствии было полностью подтверждено. Если у атома углерода все четыре заместителя одинаковые, то пространственная модель - тетраэдр, валентный угол – 109,50. Если заместители разные, то угол несколько отличается от нормального. На плоскости обычно изображают атом углерода и две связи. Связь, направленную к наблюдателю показывают жирной чертой, от наблюдателя за плоскостью — пунктирной или заштрихованной линией.
Термин конформациябыл предложен в 1929 году Хеуорсом,
Конформации молекулы представляют собой различные ее геометрические формы, возникающие в результате вращения вокруг одинарных связей. Оперировать бесчисленным множеством конформаций практически невозможно, поэтому принимают во внимание молекулярные структуры, в которых последовательно осуществлен поворот вокруг простой связи на 600 , При полном обороте вокруг центральной связи возникает 6 конформаций.
7. Оптическая изомерия; хиральность молекул органических соединений. Энантиомеры и диастереомеры. Связь пространственного строения с физиологической активностью органических соединений.
Энантиомеры — пара стереоизомеров, представляющих собой зеркальные отражения друг друга, не совмещаемые в пространстве. Простейший пример такой молекулы — это атом углерода с четырьмя разными заместителями. К примеру, СHClBrF или аланин CH3CHNH2COOH (рис. 1). Наличие у такой молекулы двух разных конфигураций связано с тем, что у атома углерода, образующего четыре одинарные связи, эти связи направлены к вершинам тетраэдра.
|
Диастереомеры — стереоизомеры, не являющиеся зеркальными отражениями друг друга Диастереомерия возникает, когда соединение имеет несколько стереоцентров. Если два стереоизомера имеют противоположные конфигурации всех соответствующих стереоцентров, то они являются энантиомерами. Однако, если конфигурация различается лишь у некоторых (а не у всех) стереоцентров, то такие стереизомеры являются диастереомерами. Если диастереомеры отличаются конфигурацией лишь одного стереоцентра, то они называются эпимерами.

Атом углерода с четырьмя разными заместителями называется хиральным атомом (от греческого heiros «ладонь» — тот же корень, что и в слове «хиромантия»). Чем больше хиральных атомов в молекуле, тем больше у вещества может быть оптических изомеров. Интересно, что возможны органические вещества, которые имеют оптические изомеры, хотя в них формально нет ни одного хирального атома — центра изомерии.
Биологическая активность зависит от оптического строения. Некоторые ферменты могут взаимодействовать только с одним изомером одного вещества (абсолютная специфичность) либо с определенным изомером веществ гомологического ряда (стереоспецифичность)
8. Типы реакций в биоорганической химии: SR, SE, SN, AE, AN, E. Примеры
В настоящее время приняты три типа классификаций химических реакций.
1. По направлению реакции.
Этот тип делится на две большие группы. К первой группе относят реакции, протекающие без изменения структуры углеродного скелета (порядок соединения атомов углерода в молекуле продукта реакции аналогичен порядку соединения атомов углерода в исходном веществе). Ко
второй группе относят реакции, протекающие с изменением структуры углеродного скелета (порядок соединения атомов углерода в продукте реакции отличается от порядка соединения атомов углерода в исходном веществе). Первую группу реакций (I) составляют реакции замещения (S), присоединения (А), элиминирования или отщепления (Е), некоторые реакции перегруппировки и изомеризации. Вторую группу реакций (II) составляют реакции удлинения углеродной цепи, укорочения углеродной цепи, некоторые реакции изомеризации и перегруппировки, циклизации, раскрытия цикла, сжатия и расширения цикла и некоторые другие.
2. По характеру атакующих частиц – реагентов (по типу разрыва связей).
Бывают гомолитическими (или радикальными) и гетеролитическими (или полярными), которые рассмотрим ниже.
В реакциях принято различать атакуемое вещество – субстрат и атакующее вещество (или частицу) – реагент. В зависимости от характера реагента различают реакции нуклеофильные, радикальные и электрофильные. Часто эту классификацию сочетают с классификацией по направлению реакции, что обычно и используют в органической химии. Тогда говорят о реакциях радикального присоединения (AR), электрофильного присоединения (AE), нуклеофильного присоединения (AN), радикального замещения (SR), нуклеофильного замещения (SN), электрофильного замещения (SE), где A,S,E – тип реакции, а индексы R,N,E – тип атакующей частицы (реагента)

3. По молекулярности реакции.
«Молекулярность» реакции указывает на число молекул, в которых происходит изменение ковалентных связей в стадии, определяющей (лимитирующей) суммарную скорость реакции – самой медленной стадии реакции. Если в стадии, лимитирующей скорость реакции, участвует одна молекула, то реакцию считают мономолекулярной, если две – то бимолекулярной. Полимолекулярные реакции встречаются очень редко.
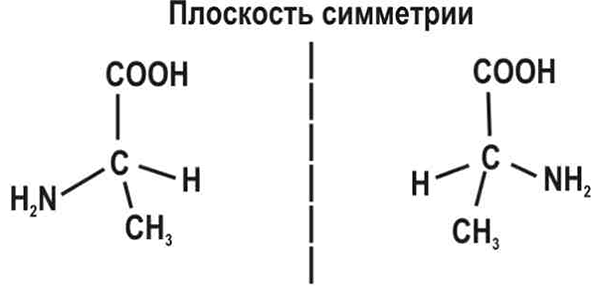 Рис. 1. Аминокислота аланин CH3CHNH2COOH. Две молекулы, состоящие из атома углерода с четырьмя разными заместителями, — оптические изомеры. Живые существа используют только левовращающие изомеры аминокислот (на рисунке справа)
Рис. 1. Аминокислота аланин CH3CHNH2COOH. Две молекулы, состоящие из атома углерода с четырьмя разными заместителями, — оптические изомеры. Живые существа используют только левовращающие изомеры аминокислот (на рисунке справа)