Лекция 3. Химический состав подземных вод
План:
1. Физические свойства подземных вод
2. Реакция воды
3. Общая минерализация воды
4. Химический состав воды
5. Формы выражения химического состава воды
6. Оценка пригодности воды для различных целей
7. Оценка агрессивности свойств подземных вод
8. Формирование химического состава подземных вод
9. Зональность подземных вод
I. К физическим свойствам подземных вод относятся прозрачность, цвет, запах, вкус, температура.
Природная вода может быть прозрачной и мутной. Мутность воды обуславливается присутствием в ней взвешенных частиц минерального и органического происхождения. Механические примеси могут попадать в воду источника вследствие неисправности водозабора или просачивания в водоносный пласт дождевых, поводковых, речных вод (карстовые районы). Иногда мутность подземных вод обуславливается растворенными в ней химическими соединениями (железо и пр.).
Цвет. Чистая вода бесцветная. Окраска объясняется наличием в ней тех или иных примесей (железо придает ржавый оттенок, сероводород – голубоватый).
Запах. Подземные воды обычно без запаха. Наличие запаха свидетельствует о наличии различный химических соединений (сероводород придает запах тухлых яиц и др.)
Вкус. Появляется при определенном содержании в воде тех или иных соединений (соленый – NaCl, кислый – в районах сульфидных месторождений).
Температура – изменяется от 4-5ºС до 60-90ºС. При температуре выше 20ºС воды называются субтермальными. В Республике Башкортостан температура подземных вод неглубокого залегания составляет от 5 до 20ºС. Пресная вода при tº=4ºС имеет наибольшую плотность.
II. Реакция воды(величина pH). Для того, чтобы судить о химическом составе подземных вод необходимо в первую очередь знать реакцию воды т.е. концентрацию водородных ионов. По теории электролитической диссоциации вода диссоцирует на водородный(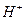 ) и гидроксильный(
) и гидроксильный(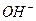 ) ионы, величина произведения которых при данной температуре всегда постоянна. Если реакция нейтральная, то концентрация
) ионы, величина произведения которых при данной температуре всегда постоянна. Если реакция нейтральная, то концентрация 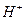 и
и 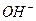 одинакова и равна 10–7мг-экв/л. Поэтому степень кислотности или щелочности воды характеризуется концентрацией водородных ионов. Для выражения концентрации водородных ионов принято пользоваться логарифмом концентрации их (т. е. количества грамм-экв этого иона в 1 л воды), взятым с обратным знаком и обозначаемым pH= –lg(H+). При нейтральной реакции pH=7, при кислой pH – меньше 7, а при щелочной pH больше 7. Определение pH производится специальными приборами (рН-метрами) калориметрическим методом, в полевых условиях применяется лакмусовая бумага.
одинакова и равна 10–7мг-экв/л. Поэтому степень кислотности или щелочности воды характеризуется концентрацией водородных ионов. Для выражения концентрации водородных ионов принято пользоваться логарифмом концентрации их (т. е. количества грамм-экв этого иона в 1 л воды), взятым с обратным знаком и обозначаемым pH= –lg(H+). При нейтральной реакции pH=7, при кислой pH – меньше 7, а при щелочной pH больше 7. Определение pH производится специальными приборами (рН-метрами) калориметрическим методом, в полевых условиях применяется лакмусовая бумага.
III. Общая минерализация воды выражается суммой содержащихся в воде химических элементов, их соединений и газов. Оценивается по сухому остатку, который получается после выпаривания воды при температуре 105ºС, или суммированием массы всех ионов, полученных при химическом анализе. Выражается в миллиграммах (граммах) на литр (дм3), граммах на кг (мг/л, г/кг). По минерализации подразделяются:
до 0,2 г/л – ультрапресные, до 1,0 г/л – пресные,
1-10 – солоноватые: 1-3 – слабо, 3-5 – средне, 5-10 – сильносолоноватые, 10-35 – соленые, более 35 г/л – рассолы.
IV. Главными химическими компонентами в подземных водах обычно являются: анионы 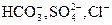 (гидрокарбонатный ион, сульфат-ион, хлор-ион), катионы (
(гидрокарбонатный ион, сульфат-ион, хлор-ион), катионы (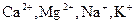 ). В воде часто присутствует карбонатный ион, нитрит-ион, нитрат-ион (
). В воде часто присутствует карбонатный ион, нитрит-ион, нитрат-ион (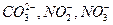 ), углекислый газ, сероводород, метан, железо 2-х и 3-х валентное и др. Содержание соединений азота в подземных водах обычно невелико (1-2 мг/л), но иногда достигает 0,5-0,8 мг/л. Наличие даже небольшого их количества указывает на загрязнение воды и возможность нахождения в ней вредных опасных бактерий. Если присутствуют нитрит ион (
), углекислый газ, сероводород, метан, железо 2-х и 3-х валентное и др. Содержание соединений азота в подземных водах обычно невелико (1-2 мг/л), но иногда достигает 0,5-0,8 мг/л. Наличие даже небольшого их количества указывает на загрязнение воды и возможность нахождения в ней вредных опасных бактерий. Если присутствуют нитрит ион (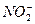 ) – загрязнение свежее, а нитрат ион – загрязнение старое. В целом подземных водах присутствуют до 60-80 различных химических элементов в растворенном состоянии.
) – загрязнение свежее, а нитрат ион – загрязнение старое. В целом подземных водах присутствуют до 60-80 различных химических элементов в растворенном состоянии.
Жесткость воды обусловлена наличием ионов кальция и магния. По ГОСТ 2874-73 и СанПиН 2.1.4.1074-01 жесткость воды выражается в миллиграммах-эквивалентах 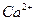 и
и  на 1 л воды. 1 мг-экв. жесткости соответствует содержанию 20,04 мг/л
на 1 л воды. 1 мг-экв. жесткости соответствует содержанию 20,04 мг/л 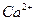 и 12,6 мг/л
и 12,6 мг/л  . По жесткости вóды делятся на:
. По жесткости вóды делятся на:
очень мягкие – до 1,5 мг-экв/л,
мягкие – 1,51-3,0 мг-экв/л,
умеренно жесткие – 3,01-6,0 мг-экв/л,
жесткие – 6,01-9,0 мг-экв/л,
очень жесткие – более 9,0 мг-экв/л.
V. Существует несколько форм выражения анализа воды: ионная, эквивалентная, процент-эквивалентная.
При ионной форме содержание ионов приводят в граммах или миллиграммах на литр (г/л, мг/л).
Эквивалентная форма позволяет судить о возможных сочетаниях катионов и анионов. Сумма эквивалентных единиц катионов и анионов, выражается в миллиграмм-эквивалентах на 1 литр и получают путем умножения мг/л на пересчетный коэффициент (табл. 1, 2).
Таблица 1