рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Энергетика
- /
- Вид работы: Лекции
- /
- Многоэлектронные атомы
Реферат Курсовая Конспект
Многоэлектронные атомы
Многоэлектронные атомы - Лекция, раздел Энергетика, Лекция 14 Рассмотрим, Как Меняются Физико-Химические Свойства Вещества С Ростом Их Поря...
Рассмотрим, как меняются физико-химические свойства вещества с ростом их порядкового номера z.
z = 1 – атом водорода. Один электрон находится в состоянии с п = 1, энергия электрона равна – 13,6 эВ. Энергия связи равна энергии ионизации 13,6 эВ. Если принять разность потенциалов 13,6 В, то электрон ионизирует атом. 13,6 В - ионизационный потенциал.
z = 2 — гелий. Ион гелия Не+ - водородоподобный ион. Любое ядро с атомным номером z и одним электроном аналогично атому водорода, в котором сила электрического взаимодействия увеличивается в z раз. Энергия 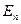 определяется формулой:
определяется формулой:

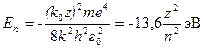 .
.
Ионизационный потенциал равен 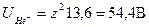 . Если в окрестности Не+ поместить второй электрон, то он первоначально «видит» заряд (z - 1)е. Однако после того, как этот электрон попадает на оболочку с п = 1, он будет «видеть» и заряд ядра z. Если взять среднее, то в среднем электрон «видит» заряд (z- l/2)е. Это эффективный заряд атома гелия. Обобщая полученный результат, мы имеем
. Если в окрестности Не+ поместить второй электрон, то он первоначально «видит» заряд (z - 1)е. Однако после того, как этот электрон попадает на оболочку с п = 1, он будет «видеть» и заряд ядра z. Если взять среднее, то в среднем электрон «видит» заряд (z- l/2)е. Это эффективный заряд атома гелия. Обобщая полученный результат, мы имеем
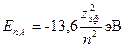 ,
,
где zэф - эффективный порядковый номер, он зависит от п и 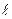 . Тогда ионизационный потенциал гелия
. Тогда ионизационный потенциал гелия 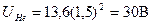 (экспериментально найдено, что
(экспериментально найдено, что 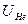 = 24,6 B). Так как в оболочке п = 1 нет места третьему электрону, гелий химически инертен. Химические силы не в состоянии создать энергию связи 24,6 эВ, чтобы ионизировать атом. Если попытаться образовать отрицательный ион Не-, то третий электрон расположится на уровне
= 24,6 B). Так как в оболочке п = 1 нет места третьему электрону, гелий химически инертен. Химические силы не в состоянии создать энергию связи 24,6 эВ, чтобы ионизировать атом. Если попытаться образовать отрицательный ион Не-, то третий электрон расположится на уровне 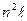 , этот электрон достаточно удален от ядра и для него суммарный заряд ядра и остатка равен нулю, поэтому третий электрон удерживаться атомом не будет. В связи с этим гелий не образует молекул ни с одним из элементов.
, этот электрон достаточно удален от ядра и для него суммарный заряд ядра и остатка равен нулю, поэтому третий электрон удерживаться атомом не будет. В связи с этим гелий не образует молекул ни с одним из элементов.
z = 3 - литий. Дважды ионизированный литий Li++ имеет водородоподобный спектр, у которого энергия уровней в З2 = 9 раз больше, чем у водорода. Спектр однократно ионизированного лития подобен спектру гелия, но 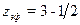 . Согласно принципу Паули третий электрон в нейтральном атоме лития должен находиться на оболочке п = 2. Для этого электрона zэф чуть больше 1, поэтому
. Согласно принципу Паули третий электрон в нейтральном атоме лития должен находиться на оболочке п = 2. Для этого электрона zэф чуть больше 1, поэтому 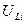 чуть больше, чем
чуть больше, чем
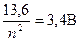
(экспериментально 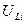 = 5,4 В; zэф, = 1,25). Второй ионизационный потенциал, соответствующий удалению второго электрона равен
= 5,4 В; zэф, = 1,25). Второй ионизационный потенциал, соответствующий удалению второго электрона равен 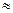 5,6 В (т.е. много больше, чем первый). Таким образом, в соединениях Li обнаруживает только валентность +1 (т.е. теряет только один электрон), и никогда не обнаруживает валентность +2 (т.е. не теряет два электрона).
5,6 В (т.е. много больше, чем первый). Таким образом, в соединениях Li обнаруживает только валентность +1 (т.е. теряет только один электрон), и никогда не обнаруживает валентность +2 (т.е. не теряет два электрона).
В состоянии с п = 2 орбитальное квантовое число 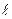 принимает два значения:
принимает два значения: 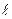 = 0 и
= 0 и 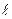 = 1. В обоих состояниях энергия электрона должна быть одинакова (Еn зависит только от п). Однако в состоянии с
= 1. В обоих состояниях энергия электрона должна быть одинакова (Еn зависит только от п). Однако в состоянии с 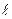 = 0 имеет место более сильная связь, чем в состоянии с
= 0 имеет место более сильная связь, чем в состоянии с 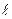 = 1. Волновая функция электрона с
= 1. Волновая функция электрона с 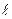 =0 (с меньшим моментом импульса) концентрируется ближе к ядру по сравнению с волновой функцией состояния с
=0 (с меньшим моментом импульса) концентрируется ближе к ядру по сравнению с волновой функцией состояния с 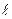 = 1 (с большим значением момента импульса). Для электронной волны, сосредоточенной вблизи ядра эффективный порядковый номер zэф ~ z, для удаленной от ядра волны zэф
= 1 (с большим значением момента импульса). Для электронной волны, сосредоточенной вблизи ядра эффективный порядковый номер zэф ~ z, для удаленной от ядра волны zэф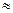 1. Таким образом, для волны с
1. Таким образом, для волны с 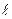 = 0 zэф больше, чем для волны с
= 0 zэф больше, чем для волны с 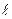 = 1. Это и объясняет зависимость zэф не только от п, но и от
= 1. Это и объясняет зависимость zэф не только от п, но и от 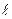 . Этот эффект может вызвать значительные различия в энергиях подоболочек с
. Этот эффект может вызвать значительные различия в энергиях подоболочек с 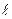 = 0,
= 0, 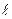 - 1,
- 1, 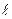 = 2. Действительно, при z = 19 (калий) энергетический уровень п = 4,
= 2. Действительно, при z = 19 (калий) энергетический уровень п = 4, 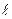 = 0 располагается ниже уровня п = 3,
= 0 располагается ниже уровня п = 3, 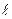 = 2.
= 2.
z = 4 - бериллий. Первый ионизационный потенциал выше, чем у Li , 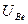 = 9,32 В. Второй ионизационный потенциал ненамного больше, т.к. второй электрон тоже находится на уровне п = 2. Поэтому в соединениях валентность Be равна +2.
= 9,32 В. Второй ионизационный потенциал ненамного больше, т.к. второй электрон тоже находится на уровне п = 2. Поэтому в соединениях валентность Be равна +2.
z = 5 (В - бор); z = 6 (С - углерод); z = 7 (N - азот); z = 8 (О - кислород); z = 9 (F - фтор); z = 10 (Ne - неон). В состоянии п = 2 в атомах В, С, N находятся 3, 4, 5 электронов, их валентности соответственно +3, +4, +5. Все три электрона в атомах бора ведут себя одинаково. Кислород и фтор обнаруживают так называемое электронное сродство (сродство к электрону). Отдельный атом F может приобрести дополнительный электрон и превратиться в стабильный ион F–. Соответствующая этому электрону волна частично «видит» большой эффективный заряд zэфе, и электрон оказывается связанным с энергией 3,6 эВ. Сродство к электрону при образовании 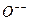 составляет 2,2 В. В химических соединениях кислород и азот имеют валентности соответственно -2 и -3. У неона все состояния с п = 2 заняты, т.е. оболочка заполнена. Электронные волны, соответствующие п = 2 частично расположены очень близко к ядру, zэф ~ 10, ионизационный потенциал поэтому очень высок
составляет 2,2 В. В химических соединениях кислород и азот имеют валентности соответственно -2 и -3. У неона все состояния с п = 2 заняты, т.е. оболочка заполнена. Электронные волны, соответствующие п = 2 частично расположены очень близко к ядру, zэф ~ 10, ионизационный потенциал поэтому очень высок 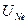 = 21,6 В. Таким образом, неон, как и гелий, является химически инертным.
= 21,6 В. Таким образом, неон, как и гелий, является химически инертным.
– Конец работы –
Эта тема принадлежит разделу:
Лекция 14
На сайте allrefs.net читайте: Лекция 14.
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Многоэлектронные атомы
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов