Структура (строение) ПЕРИОДИЧЕСКОЙ СИСТЕМЫ однозначно определена электронным строением атомов элементов
ПЕРИОДИЧЕСКАЯ СИСТЕМА Д. И. МЕНДЕЛЕЕВА И ЭЛЕКТРОННАЯ СТРУКТУРА АТОМОВ.
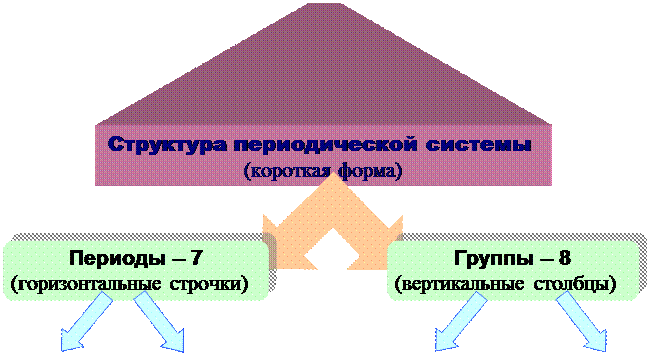
Структура (строение) ПЕРИОДИЧЕСКОЙ СИСТЕМЫ однозначно определена электронным строением атомов элементов.
Порядковый номер элемента N – совпадает с зарядом ядра и числом электронов в атоме данного элемента. Элементы располагаются в периодической системе в порядке возрастания заряда их ядер.
Короткие Длинные Главные Побочные
И 3-й 4, 5, 6 и 7-й А-подгруппы Б-подгруппы
Номер периода Nпер – совпадает со значением n (гл.квант.числа) внешнего энергетического уровня.
Номер группы Nгр – совпадает с максимальным числом валентных электронов.
В главных подгруппах находятся элементы, у которых заполняется s- или p- подуровень.
В побочных подгруппах находятся элементы, у которых формируется d-подуровень и f- подуровень.
В одной подгруппе находятся элементы-аналоги, обладающие аналогичной валентной формулой. Их свойства – сходные.
ПЕРИОДИЧЕСКИЙ ЗАКОН
Электроотрицательность элементов по Полингу
Условно принято ЭОLi =1 . Самым сильным окислителем является фтор ЭОF=4,0; самым сильным восстановителем является цезий ЭОCs = 0,7.
Изменение физико-химических свойств элементов
вдоль по периоду :
У элементов одного периода количество квантовых слоев одинаково, а заряд ядра возрастает слева направо. Поэтому в этом же направлении
2) Еи увеличивается ↑ 3) Еср увеличивается ↑ 4) ЭО увеличивается ↑При перемещении сверху вниз по группе у атомов растет заряд ядра и одновременно растет число квантовых слоев. Эти факторы противоположным образом действуют на внешние электроны. Решающую роль имеет степень экранирования заряда ядра предыдущими слоями.
У s- и p- элементов экранировка сильная, поэтому
2) Еи уменьшается ↓ 3) Еср уменьшается ↓ 4) ЭО уменьшается ↓Таким образом, самые сильные восстановители, имеющие наименьшие ЭО, расположены в нижней левой части ПСЭ (Fr, Сs, Rb, Rа). Самые сильные окислители, имеющие наибольшие величины ЭО, расположены в верхней правой части (F, Cl, О).
У атомов d- и f-элементов имеются особенности в изменении ЭО и окислительно-восстановительных свойств, вызванные более слабым экранированием d- и f-электронами электронов внешней оболочки и лантанидным сжатием.
| Самые сильные Окислители, max ЭО ПСЭ Самые сильные Восстановители, min ЭО |