рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Энергетика
- /
- Химическая коррозия
Реферат Курсовая Конспект
Химическая коррозия
Химическая коррозия - раздел Энергетика, Коррозия металлов Химическая Коррозия – Самопроизвольное Разрушение Металлов В ...
Химическая коррозия – самопроизвольное разрушение металлов в среде окислительного газа или в жидких неэлектролитах. Сущность процессов химической коррозии сводится к Ок-Восст реакции через непосредственный переход электронов металла на окислитель.
В жидкостях-неэлектролитах (нефть, бензин, керосин и т.п.) особо опасную роль играют примеси серы в виде меркаптанов (R-SH), которые образуют с металлами растворимые меркаптиды и рыхлые сульфиды.
Наиболее часто химическая коррозия встречается в форме газовой коррозии.
Наиболее часто активным коррозионным агентом является кислород:
 Fe + O2 FeO + Fe2O3 + Fe3O4 (окалина)
Fe + O2 FeO + Fe2O3 + Fe3O4 (окалина)
ΔG р-ции окисления металлов < 0, т.е. ионное состояние энергетически более выгодно, оно характеризуется меньшей внутренней энергией, чем атомарное. Поэтому большинство металлов (кроме Ag, Au, Pt, Cu) встречаются в природе в виде руды (в ионном состоянии). Т.о., первопричиной коррозии является термодинамическая неустойчивость металлов в заданной среде.
Скорость химической коррозии зависит от многих факторов и в первую очередь от характера продуктов коррозии. В процессе окисления на поверхности металлов образуется твердая пленка оксидов. Для продолжения коррозии необходимо, чтобы ионы металла и/или кислород проникали через образовавшуюся оксидную пленку. Поэтому скорость окисления определяется сплошностью и защитными свойствами оксидной пленки и зависят от наличия в ней трещин и пор. Образование трещин зависит от эластичности пленки.
Обычно скорость газовой коррозии rδ выражают через скорость роста толщины оксидной пленки 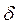 :
:
rδ = 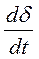
Экспериментально обнаружено, что интегрирование этого уравнения приводит к трем законам: линейному (1), параболическому (2) и логарифмическому (3).
СЛАЙД 6
По первому закону, соответствующему случаю свободного доступа кислорода к поверхности металла, происходит окисление щелочных и щелочно-земельных металлов, а также ванадия, вольфрама и молибдена при высоких температурах.
По второму закону, когда скорость процесса определяется законами диффузии через образовавшуюся защитную пленку оксида, окисляются вольфрам, кобальт, никель и медь в интервале температур от 300 оС до 1000 оС, а железо – при температурах от 500 оС до 1000 оС.
По третьему закону, реализующемуся при уплотнении защитной пленки или возникновении в ней дефектов, тормозящих процесс диффузии, окисляются медь при температуре ниже 100 оС, тантал ниже 150 оС, железо ниже 400 оС, а также алюминий, цинк, хром и никель при температурах ниже 300 оС.
При образовании на поверхности металла оксидных пленок зона роста оксидного слоя оказывается расположенной в его глубине. Это приводит к возникновению напряжений и, во многих случаях, к растрескиванию пленки.
Защитными свойствами обладают, как правило, тонкие (до 40 нм) пленки, обладающие достаточной пластичностью и плотностью, которые сплошным слоем покрывают поверхность металла, имеют хорошее сцепление с поверхностью металла и и одинаковый с ним коэффициент линейного расширения.
Сплошность покрытия определяется значением фактора Пиллинга-Бэдвордса 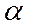 :
:
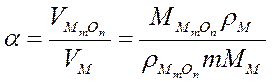
где 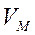 - объем окислившегося металла,
- объем окислившегося металла, 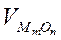 - объем образовавшегося оксида,
- объем образовавшегося оксида, 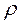 и M с соответствующими индексами – плотности и молярные массы металла и оксида.
и M с соответствующими индексами – плотности и молярные массы металла и оксида.
Если 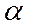 <1, (линейный закон) то объем продуктов коррозии меньше объема окисленного металла, и пленка не является сплошной и не может защитить металл.
<1, (линейный закон) то объем продуктов коррозии меньше объема окисленного металла, и пленка не является сплошной и не может защитить металл.
Если 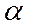 >2,5 (параболический закон?), то она оказывается настолько напряженной, что легко трескается и отслаивается от поверхности, также прекращая свое защитное действие.
>2,5 (параболический закон?), то она оказывается настолько напряженной, что легко трескается и отслаивается от поверхности, также прекращая свое защитное действие.
Если 1 <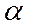 < 2,5
< 2,5
СЛАЙД 7
Но коррозионно-активными кроме кислорода являются и CO2, Н2О, Cl2, SO2).
При высокой температуре СО2 взаимодействует с железом и содержащимся в стали цементитом, провоцируя межкристаллитную коррозию:
Fe3С + CO2 = 3Fe + 2CO
Их агрессивность по отношению к различным металлам неодинакова. Например, Al и его сплавы, Cr и стали с высоким содержанием Cr устойчивы в кислороде, но неустойчивы в прсутствии Cl2. Ni неустойчив в атмосфере SO2, а Cu устойчива. Повышенное содержание СО ослабляет коррозию.
– Конец работы –
Эта тема принадлежит разделу:
Коррозия металлов
Коррозионные процессы классифицируются по следующим основаниям...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Химическая коррозия
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов