При работе вырабатывается электрический ток под действием электрического тока

При работе ГЭÞвырабатывается электрический токÞ под действием электрического токаÞ возникают потери:
► ΔЕА , ΔЕК – поляризационные потери на аноде и катоде за счет скопления продуктов реакции на электроде и за счет недостатка исходных веществ для реакции на электроде и за счет замедленности самой электрохимической реакцииÞ
Þ { Е анода Þ более положительным
{ Е катода Þ более отрицательным
► ΔЕ ОМ – омические потери в электролите ( ! ) и на электродахÞΔЕ ОМ = R . I
В результате в ГЭ напряжение U - уменьшается.
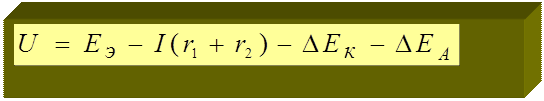
U – напряжение ГЭ;
U = ЕК – ЕА ( при I ≠ 0)
I(r1 + r2) - омическое падение напряжения;
R1- сопротивление в проводниках с электронной
проводимостью (проводники первого рода);
R2- сопротивление в электролите (проводник второго
рода);
ЕА , ΔЕК – поляризация анода и катода.
А v – активность ионов в объеме раствора.
Количественная оценка скорости электрохимической реакции – плотность тока - i , мА/см2:
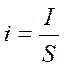 - отношение тока ( I ) к площади
- отношение тока ( I ) к площади
Поверхности электрода ( S ).
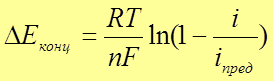
предельная плотность тока 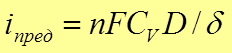
с v – концентрация ионов в объеме раствора,
D – коэффициент диффузии реагента,
D - толщина диффузного слоя – тонкий слой около поверхности электрода, в котором происходит перемешивание жидкости, отсутствует конвекция – молекулы переносятся лишь путем диффузии.
 |
● - коэффициент диффузии реагента D ;
- коэффициент диффузии реагента D ;
 ●- концентрацию ионов в объеме раствора Сv ;
●- концентрацию ионов в объеме раствора Сv ;
 ●- толщину диффузного слоя d ;
●- толщину диффузного слоя d ;
Перемешивать раствор.
► электрохимическая поляризацияСведены в таблицы.
Использовать электроды-катализаторы.
график зависимости Е = f(i) –
Поляризационные кривые

●…
Для увеличения ↑ U ГЭ необходимо:
► ↑ ΔЕЭ ● ↑ а ионов, исх. , ↑ р газов, исх. ТОР
А ионов, прод. , ↓ р газов, прод. ТОР
► ↓ ΔЕА ● ↑ температуру Т
↓ ΔЕК ● ↑ S электродов
● использовать электроды – kt
► ↓ ΔЕОМ ● ↑ температуру Т
Расстояния между электродами
Перемешивать электролит
● использовать добавки,
Увеличивающие
Электропроводность электролита.
Все материальные расчеты по ГЭ производятся
Из закона Фарадея Þ ток ( I ) пропорционален количеству вещества, прореагировавшему на электродах в единицу времени, т.е. скорости электрохимической реакции:

Þ значение I для оценки скорости
Электрохимической реакции