Лекция №4. ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ
Лекция №4.
ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ.
План
1. Основные положения теории электролитической диссоциации.
2. Электролиты сильные, средней силы, слабые.
3. Константа диссоциации.
4. Гидратация ионов.
5. Диссоциация воды. Понятие pH.
ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ
Основоположниками этой теории считаются Сванте Аррениус, И. А. Каблуков
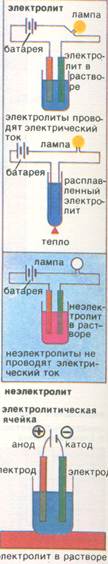
1. Электролиты – вещества, которые в расплавах и растворах диссоциируют на ионы и проводят электрический ток. 2. Неэлектролиты – вещества, в расплавах и растворах не проводящие… Под действием электрического тока ионы принимают направленное движение.Сильные электролиты
α α
HNO3 - 91% K2SO4 - 73%
HCl - 92% Ba(OH)2 - 92%
 HBr - 92% KOH - 84%
HBr - 92% KOH - 84%
H2SO4 - 58% NaOH - 84%
KCl - 86% Na2SO4 - 69%
NaCl - 84% MgCl2 - 76,5%
NH4Cl - 85% MgSO4 - 44,9%
Электролиты средней силы
α
H3PO4 - 26%
HF - 8,5%
HNO2 - 6,5%
H2SO3 - 26%
Слабые электролиты
Уксусная кислота CH3COOH - 1,3% Гидроксид аммония NH4OH - 1,3% Угольная кислота H2CO3 - 0,17%Гидратация ионов
К гидратам постоянного состава относится ион водорода, который может удерживать одну молекулу воды, такой ион называют ион гидроксония. Н+Сl- + H2Oo → H3O+ + Cl- ионДиссоциация воды, рН
Для выражения содержания ионов в растворе используют молярную концентрацию (моль/л). Величина Н+ и ОН- в ней одинаковы. Опытным путем установлено, что в 1 л воды при комнатной температуре лишь… Произведение концентрации ионов водорода и гидроксид-ионов в воде называется – ионным произведением воды (Кw).Вопросы для закрепления
2. Что такое катионы и анионы? 3. Классификация электролитов. 4. Классификация уравнений с точки зрения ТЭД.Интернет-ресурсы.