Гидратация ионов
Ионы, связанные с молекулами воды, называются гидратированными. В растворах могут содержаться только гидратированные ионы. Эти ионы могут содержать как постоянное, так и переменное количество воды.
К гидратам постоянного состава относится ион водорода, который может удерживать одну молекулу воды, такой ион называют ион гидроксония.
Н+Сl- + H2Oo → H3O+ + Cl-
ион
гидроксония
Механизм образования иона гидроксония – донорно-акцепторный. Протон водорода имеет свободную ячейку, а атом кислорода в молекуле воды – личную электронную пару, которую отдает в личное пользование с протоном водорода, то есть молекула воды – донор, протон – акцептор.
С точки зрения ТЭД кислоты – это электролиты, при диссоциации которых образуются катионы водорода и анионы кислотных остатков.
Основность кислоты – это величина, показывающая число катионов водорода, образующихся при диссоциации.
Основания – э то электролиты, при диссоциации которых образуются катионы металлов и анионы гидроксогрупп.
Кислотность оснований – это величина, показывающая, сколько гидроксид-ионов образуется при диссоциации.
Электролиты, которые при диссоциации одновременно образуют катионы водорода и гидроксид-ионы называются амфотерными или амфолитами.
Соли – это электролиты, при диссоциации которых образуются катионы металлов (а также, катионов аммония NH4+) и анионы кислотных остатков.
Все оксиды неэлектролиты.
С точки зрения ТЭД все уравнения делятся на:
1. молекулярные
2. краткие ионные
 3. полные ионные.
3. полные ионные.
|
Пример:
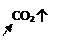 |
|

 (полное ионное уравнение)
(полное ионное уравнение)
|

|
|
|
Не расписывают на ионы слабые электролиты (малодиссоциируемые вещества), газы, осадки, оксиды. Чтобы перейти от полного к краткому ионному уравнению, надо вычеркнуть одинаковые ионы в левой и правой частях уравнения.
Признаки течения реакций до конца:
1. В результате реакции образуется осадок.↓
Пример:
 BaCl2 + H2SO4 → BaSO4↓ + 2HCl
BaCl2 + H2SO4 → BaSO4↓ + 2HCl
Ba2+ + 2Cl- + 2H+ + SO42- → BaSO4↓ + 2H+ + 2Cl-
Ba2+ + SO42 → BaSO4↓
2. Образуются газы.↑
3. Образуются малодиссоциируемые вещества.
4. Реакции, в результате которых образуются комплексные соединения.