Это уравнение необходимо решить для нахождения неполной радиальной функции R(r).
Уравнение (7.7) имеет решение, удовлетворяющее необходимому условию квадратной интегрируемой функции состояния, если выполняется равенство:
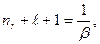
 (7.8)
(7.8)
где 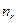 = 1,2,3,… - радиальное квантовое число. Обычно вводят
= 1,2,3,… - радиальное квантовое число. Обычно вводят
главное квантовое число: 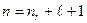 (7.9)
(7.9)
Тогда с учётом значений 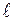 видно, что
видно, что 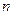 = 1,2,3,…
= 1,2,3,…
Из формулы (7.8) с учётом (7.7) имеем: 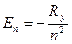 т.е. энергия стационарных состояний квантуется главным квантовым числом n.
т.е. энергия стационарных состояний квантуется главным квантовым числом n.
Таким образом, стационарные состояния электрона в атоме водорода определяются тройкой квантовых чисел n,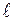 , m. Квантовые числа позволяют рассчитать для каждого состояния значение трёх физических величин, имеющих одновременно определённые значения.
, m. Квантовые числа позволяют рассчитать для каждого состояния значение трёх физических величин, имеющих одновременно определённые значения.
Это энергия момента импульса и его проекция:
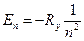 ,
, 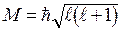 ,
, 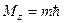 .
.
Согласно формуле (7.9) 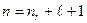 , т.е.
, т.е. 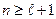 .
.
Поэтому при заданном главном квантовом числе орбитальное квантовое число пробегает n разных значений от 0 до (n-1). При фиксированном n и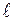 может быть
может быть 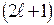 состояний отличающихся значениями магнитного квантового числа. Количество состояний с одним и тем же n, но разными
состояний отличающихся значениями магнитного квантового числа. Количество состояний с одним и тем же n, но разными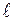 и m равно:
и m равно:
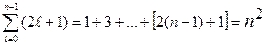 .
.
Состояния с фиксированным n имеют одну и ту же энергию и называются вырожденными. Число этих состояний называют кратностью вырождения, следовательно, 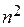 - кратность вырождения уровней энергии электрона в атоме. Полная функция состояния атома водорода − это произведение радиального и углового её соотношений:
- кратность вырождения уровней энергии электрона в атоме. Полная функция состояния атома водорода − это произведение радиального и углового её соотношений:
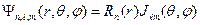 .
.
Исходя из квантово-механической модели установим, каким квантовым переходам в атоме водорода отвечает серия Лаймана. Разрешены не все переходы между стационарными квантовыми состояниями. Ограничений на изменение главного квантового числа нет, разность 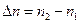 , может быть любой. В отношении орбитального числа действует запрет на любые переходы, кроме тех, для которых
, может быть любой. В отношении орбитального числа действует запрет на любые переходы, кроме тех, для которых 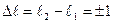 . Магнитное квантовое число должно оставаться прежним или изменяться на единицу:
. Магнитное квантовое число должно оставаться прежним или изменяться на единицу: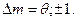 Это правило отбора по квантовым числам
Это правило отбора по квантовым числам 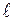 и m.
и m.
 Все состояния делятся на группы, которые называются термами. Терм объединяет состояния со сходными свойствами. Для водорода в соответствии с правилами отбора в термы включают состояния с одним и тем же
Все состояния делятся на группы, которые называются термами. Терм объединяет состояния со сходными свойствами. Для водорода в соответствии с правилами отбора в термы включают состояния с одним и тем же 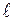 . Соответственно говорят о s-, p-, d- и т.д. термах. Переходы возможны только между соседними термами. Квантовые состояния электрона отличаются символом, состоящим из числа, равного n, и буквы, обозначающей значение
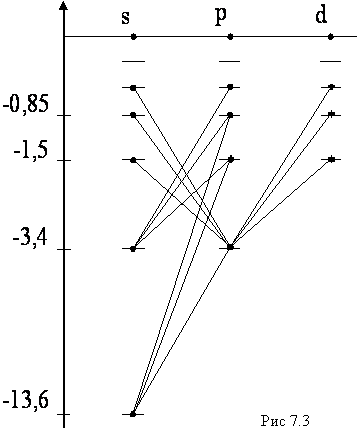
. Соответственно говорят о s-, p-, d- и т.д. термах. Переходы возможны только между соседними термами. Квантовые состояния электрона отличаются символом, состоящим из числа, равного n, и буквы, обозначающей значение 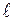 , например 1s, 2p, 2d и т.д. Если атомы не находятся в магнитном поле, то уровни энергии вырождены по квантовому числу m, и поэтому оно существенной роли не играет и в обозначении состояния не присутствует. Расположение самих нижних по энергии квантовых состояний атома водорода иллюстрируется диаграммой (рис. 7.3). Диаграмма наглядно показывает, каким квантовым переходам соответствуют те или иные линии в спектре. Серия Лаймана образуется переходами np→1s (n = 1, 3,…); Серия Бальмера ns→2p, np→2s, nd→2p (n = 3, 4,…). Состояние 1s является основным состоянием атома водорода. В этом состоянии атом обладает минимальной энергией. Чтобы перевести атом в возбуждённое (т.е. в состоянии с большей энергией) ему необходимо сообщить энергию.
, например 1s, 2p, 2d и т.д. Если атомы не находятся в магнитном поле, то уровни энергии вырождены по квантовому числу m, и поэтому оно существенной роли не играет и в обозначении состояния не присутствует. Расположение самих нижних по энергии квантовых состояний атома водорода иллюстрируется диаграммой (рис. 7.3). Диаграмма наглядно показывает, каким квантовым переходам соответствуют те или иные линии в спектре. Серия Лаймана образуется переходами np→1s (n = 1, 3,…); Серия Бальмера ns→2p, np→2s, nd→2p (n = 3, 4,…). Состояние 1s является основным состоянием атома водорода. В этом состоянии атом обладает минимальной энергией. Чтобы перевести атом в возбуждённое (т.е. в состоянии с большей энергией) ему необходимо сообщить энергию.
Это может быть осуществлено за счет теплового соударения атома, за счёт столкновения атома с достаточно быстрым электроном, или за счёт поглощения атомом фотона. Фотон при поглощении атомом, исчезает, передовая атому свою энергию. Атом не может поглотить только часть фотона, ибо фотон, как и электрон, является неделимым. Атом может поглощать только те фотоны, энергия которых в точности соответствует разности энергий двух его уровней. Поскольку поглощающий атом обычно находится в основном состоянии, спектр поглощения водородного атома должен состоять из линий, соответствующих переходам
1s→np (n = 2, 3…).