Принцип минимума энергии
Принцип минимума энергии: последовательное заполенние электронов в атоме должно отвечать как минимому энергии самого электрона, так и минимому энерги атома в целом. Или так: минимум энергии соответствует максимому устойчивости. Заполение идет в соответсвии с уравнением энергии орбитали: ns<(n-1)d» (n-2)f<np. На внешнем уровне не может быть более 8 электронов.
Правило Клечковского: сначала заполняются те подуровни, сумма n+l которых наименьшая. Если для двух подуровней сумма n+l равна, то сначала заполняется подуровень с меньшим n.
6)

8) Формулировка закона Мозли [править]
Согласно Закону Мозли, корень квадратный из частоты 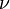 спектральной линии характеристического излучения элемента есть линейная функция его порядкового номера
спектральной линии характеристического излучения элемента есть линейная функция его порядкового номера 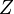 :
: 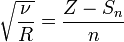
где 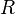 — постоянная Ридберга,
— постоянная Ридберга, 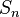 — постоянная экранирования,
— постоянная экранирования, 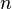 — главное квантовое число. На диаграмме Мозли зависимость от
— главное квантовое число. На диаграмме Мозли зависимость от 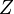 представляет собой ряд прямых (К-, L-, М- и т. д. серии, соответствующие значениям n = 1, 2, 3,...).
представляет собой ряд прямых (К-, L-, М- и т. д. серии, соответствующие значениям n = 1, 2, 3,...).
Закон Мозли явился неопровержимым доказательством правильности размещения элементов в периодической системе элементов Д. И. Менделеева и содействовал выяснению физического смысла 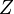 .
.
Д.И. Менделеев сформулировал Периодический закон: "Свойства
элементов, а потому и свойства образуемых ими простых и слож-
ных тел находятся в периодической зависимости от их атомного
веса".
новую формулировку:
"Свойства элементов, а также образуемых ими веществ находятся
в периодической зависимости от заряда их атомных ядер".
Главный принцип построения Периодической системы - выделение в ней периодов (горизонтальных рядов) и групп (вертикальных столбцов) элементов
9) Современная Периодическая система состоит из 7 периодов (седьмой период должен закончиться 118-м элементом)
==
Номер группы в Периодической системе определяет число валентных электронов в атомах s- и p-элементов.
Номер периода = Число энергетических уровней (слоѐв) , заполненных электронами = обозначение последнего энергетического уровня
В подгруппах радиусы в основном увеличиваются из-за возрастания числа электронных слоѐв.
10) Электроотрицательность- это способность атома элемента к притягивать к себе электроны в химической связи
Периодичность - это повторяемость свойств химических и некоторых физических свойств у простых веществ и их соединений при изменении порядкового номера элементов. Она связана, в первую очередь, с повторяемостью электронного строения атомов по мере увеличения порядкового номера (а, следовательно, заряда ядра и числа электронов в атоме).
Химическая периодичность проявляется в аналогии химического поведения, однотипности химических реакций. При этом число валентных электронов, характерные степени окисления, формулы соединений могут быть разными. Периодически повторяются не только сходные черты, но и существенные различия химических свойств элементов по мере роста их порядкового номера.
Некоторые физико-химические свойства атомов (потенциал ионизации, атомный радиус), простых и сложных веществ могут быть не только качественно, но и количественно представлены в виде зависимостей от порядкового номера элемента, причем для них периодически проявляются четко выраженные максимумы и минимумы.
| Периодическое изменение атомных радиусов Согласно представлениям квантовой механики, атомы не имеют четких границ, однако вероятность найти электрон, связанный с данным ядром, на определенном расстоянии от этого ядра быстро убывает с увеличением расстояния. Поэтому атому приписывают некоторый радиус, полагая, что в сфере этого радиуса заключена бóльшая часть электронной плотности (более 90%). |