Повышение температуры кипения растворов
Жидкость кипит при той температуре, при которой общее давление насыщенного пара становится равным внешнему давлению. Если растворённое вещество нелетуче (то есть давлением его насыщенных паров над раствором можно пренебречь), то общее давление насыщенного пара над раствором равно парциальному давлению паров растворителя. В этом случае давление насыщенных паров над раствором при любой температуре будет меньше, чем над чистым растворителем, и равенство его внешнему давлению будет достигаться при более высокой температуре. Таким образом, температура кипения раствора нелетучего вещества Tb всегда выше, чем температура кипения чистого растворителя при том же давлении T°b.
§ Повышение температуры кипения бесконечно разбавленных растворов нелетучих веществ не зависит от природы растворённого вещества и прямо пропорционально моляльной концентрации раствора

Антифриз- общее название для жидкостей, не замерзающих при низких температурах. Применяются в установках, работающих при низких температурах, для охлаждения двигателей внутреннего сгорания, в качестве авиационных противообледенительных жидкостей. В качестве базовых жидкостей антифризов используются смесиэтиленгликоля, пропиленгликоля, глицерина, спиртов и других веществ с водой
Автомобильные антифризы
· Традиционные антифризы
· Гибридные антифризы
· Карбоксилатные антифризы
23вопрос
Смотреть страницу 16 (растворы)
Законы Рауля не выполняются для растворов (даже бесконечно разбавленных), которые проводят электрический ток — растворов электролитов. Для учёта этих отклонений Вант-Гофф внёс в приведённые выше уравнения поправку —изотонический коэффициент i, неявно учитывающий диссоциацию молекул растворённого вещества:
 ;
; 
Неподчинение растворов электролитов законам Рауля и принципу Вант-Гоффа послужили отправной точкой для создания С. А. Аррениусом теории электролитической диссоциации.
24вопрос
Смотреть тетрадь 15 страница растворы
25вопрос
Ио́нное произведе́ние воды́ — произведение концентраций ионов водорода Н+ и ионов гидроксида OH− в воде или в водных растворах, константа автопротолиза воды.
Вода, хотя и является слабым электролитом, в небольшой степени диссоциирует:
H2O + H2O ↔ H3O+ + OH−
или
H2O ↔ H+ + OH−
Равновесие этой реакции сильно смещено влево. Константу диссоциации воды можно вычислить по формуле:
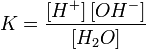 , ,
| (1) |
где:
§ [H+] — концентрация ионов гидроксония (протонов);
§ [OH−] — концентрация гидроксид-ионов;
§ [H2O] — концентрация воды (в молекулярной форме) в воде;
Концентрация воды в воде, учитывая её малую степень диссоциации, величина практически постоянная и составляет (1000 г/л)/(18 г/моль) = 55,56 моль/л.
При 25 °C константа диссоциации воды равна 1,8×10−16моль/л. Уравнение (1) можно переписать как:
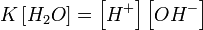 , ,
| (2) |
Обозначим произведение K·[H2O] = Kв = 1,8×10−16 моль/л·55,56 моль/л = 10−14моль²/л² = [H+]·[OH−] (при 25 °C).
Константа Kв, равная произведению концентраций протонов и гидроксид-ионов, называется ионным произведением воды. Она является постоянной не только для чистой воды, но также и для разбавленных водных растворов веществ. C повышением температуры диссоциация воды увеличивается, следовательно, растёт и Kв, при понижении температуры — наоборот.
26,27,28вопросы
Смотреть в тетрадке 17-20 страницы(Гидролиз)
29вопрос
Диспе́рсная систе́ма — это образования из двух или более числа фаз (тел), которые совершенно или практически не смешиваются и не реагируют друг с другом химически. Первое из веществ (дисперсная фаза) мелко распределено во втором (дисперсионная среда). Если фаз несколько, их можно отделить друг от друга физическим способом (центрифугировать, сепарировать и т. д.).
Обычно дисперсные системы — это коллоидные растворы, золи. К дисперсным системам относят также случай твёрдой дисперсной среды, в которой находится дисперсная фаза.
Дисперсные системы образования из двух или большего числа фаз (тел) с сильно развитой поверхностью раздела между ними. В Д. с. по крайней мере одна из фаз - дисперсная фаза - распределена в виде мелких частиц (кристалликов, нитей, плёнок или пластинок, капель, пузырьков) в другой, сплошной, фазе - дисперсионной среде. Д. с. по основной характеристике - размерам частиц или (что то же самое) дисперсности (определяемой отношением общей площади межфазной поверхности к объёму дисперсной фазы) - делятся на грубо (низко) дисперсные и тонко (высоко) дисперсные, или коллоидные системы (коллоиды). В грубодисперсных системах частицы имеют размер от 10-4 см и выше, в коллоидных - от 10-4-10-5 до 10-7 см. По агрегатному состоянию дисперсионной среды различают газодисперсные системы - аэрозоли (туманы, дымы), пыль; жидкодисперсные - золи, суспензии, эмульсии, пены; твёрдодисперсные - стеклообразные или кристаллические тела с включениями мельчайших твёрдых частиц, капель жидкости или пузырьков газа (см. табл.). Пыль, суспензии, лиофобные эмульсии (см. Лиофильные и лиофобные коллоиды) - грубодисперсные системы; как правило (при наличии разности плотностей), они седиментационно неустойчивы, т. е. их частицы оседают под действием силы тяжести или всплывают. Золи - типичные высокодисперсные коллоидные системы, частицы дисперсной фазы которых (мицеллы) участвуют в броуновском движении и потому седиментационно устойчивы. Жидкие и твёрдые пены, состоящие из газовых ячеек-пузырьков, разделённых тонкими прослойками непрерывной фазы, представляют особую группу структурированных ячеистых систем