Общая характеристика токсического действия. Токсикокинетика
Острые отравления целесообразно рассматривать как “химическую травму”, развивающуюся вследствие внедрения в организм токсической дозы чужеродного химического вещества. Последствия, связанные со специфическим воздействием на организм токсического вещества, относятся к токсикогенному эффекту химической травмы. Он носит характер патогенной реакции и наиболее ярко проявляется в ранней стадии острых отравлений — токсикогенной, когда токсический агент находится в организме в дозе, способной оказывать специфическое действие. Одновременно могут включаться патологические процессы, лишенные “химической” специфичности. Ядовитое вещество играет роль пускового фактора. Примерами являются гипофизарно-адреналовая реакция (стресс-реакция), “централизация кровообращения”, коагулопатия и другие сдвиги, которые относятся к соматогенному эффекту “химической травмы” и носят вначале характер “защитных” реакций. Они наиболее ярко проявляются во II клинической стадии острых отравлений—соматогенной, наступающей после удаления или разрушения токсического агента в виде “следового” поражения структуры и функции различных органов и систем организма.
Таким образом, общий токсический эффект является результатом специфического токсического действия и неспецифических реакций организма - соматогенного действия.
В процессе реализации “химической травмы” всегда обнаруживается сочетание патогенных и защитных реакций, которые на различных этапах заболевания могут менять свои роль и значение. Например, такие распространенные виды защитных реакций на отравление, как “централизация кровообращения” или “гипо-коагуляция н фибринолиз”, часто переходят в патогенные, что требует проведения корригирующего воздействия. Некоторые из этих явлений могут играть гораздо большую роль в развитии химической травмы, чем специфическое действие яда.
Распределение токсических веществ в организме зависит от трех основных факторов: пространственного, временного и концентрационного (рис. 2).Пространственный фактор определяет пути наружного поступления и распространения яда. Последнее во многом связано с кровообращением органов и тканей, поскольку количество яда, поступающее к данному органу, зависит от его объемного кровотока, отнесенного к единице массы тканей. Наибольшее количество яда в единицу времени поступает обычно в легкие, почки, печень, сердце и мозг. При ингаляционных отравлениях основная часть яда поступает в почки, а при пероральных—в печень, так как соотношение удельного кровотока печень/почки составляет примерно 1:2. Кроме того, токсический процесс определяется степенью чувствительности к яду рецепторов “избирательной токсичности”. Особенно опасны в этом отношении токсические вещества, вызывающие необратимые поражения клеточных структур (например, при химических ожогах тканей кислотами или щелочами). Менее опасны обратимые поражения (например, при наркозе), вызывающие только функциональные расстройства.
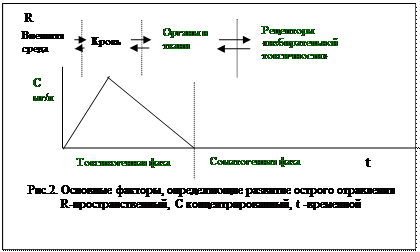
Под временным фактором подразумеваются скорость поступления яда в организм и скорость его выведения из организма, т. е. он отражает связь между временем действия яда и его токсическим эффектом.
Концентрационный фактор, т. е. концентрация яда в биологических средах, в частности в крови, считается основным в клинической токсикологии. Определение этого фактора позволяет различать токсикогенную и соматогенную фазы отравления и оценить эффективность дезинтоксикационной терапии. Исследование динамики концентрационного фактора помогает обнаружить в токсикогенной фазе отравлений два основных периода: периодрезорбции, продолжающийся до момента достижения максимальной концентрации токсического вещества в крови, и периодэлиминации, от этого момента до полного очищения крови от яда.
С точки зрения токсикодинамики (рис. 2), специфическая симптоматика отравлений, отражающая “избирательную токсичность” ядов, наиболее ярко проявляется в токсикогенной фазе, особенно в период резорбции. Для последнего характерно формирование таких тяжело протекающих патологических синдромов острых отравлений, как экзотоксический шок, токсическая кома, желудочно-кишечные отравления, асфиксия и др. В соматогенной фазе обычно развиваются патологические синдромы, лишенные выраженной токсикологической специфичности. Клинически они трактуются как осложнения острых отравлений: пневмония, острая почечная недостаточность (ОПН) или острая почечно-печеночная недостаточность (ОППН), сепсис и пр.
Представление о рецепторе как месте конкретного приложения и реализации токсического действия яда до настоящего времени остается недостаточно ясным, несмотря на то, что эта идея была выдвинута Дж. Ленгли более ста лет назад. Сам термин “рецептор” в токсикологическом понимании был предложен в начале ХХ века. Позже было показано, что между чужеродными веществами и их рецепторами возникает связь, по-видимому, аналогичная взаимодействию субстрата со специфическим ферментом. Во многих случаях рецепторы действительно представляют собой ферменты. Например, оксигруппа серина, входящая как составная часть в молекулу фермента ацетилхолинэстеразы, служит рецептором для фосфорорганических инсектицидов (хлорофос, карбофос и пр.), образующих с этим ферментом прочный комплекс. В итоге развивается специфический антихолинэстеразный эффект, присущий большинству фосфорорганических соединений. Взаимодействие ядов с ферментами как рецепторами токсичности нашло свое отражение в патохимической классификации ядов.
Кроме ферментов, рецепторами первичного действия ядов являются аминокислоты (гистидин, цистеин и др.), нуклеиновые кислоты, пуриновые и пиримидиновые нуклеотиды, витамины. Рецепторами часто бывают такие наиболее реакционноспособные функциональные группы органических соединений, как сульфгидрильные, гидроксильные, карбоксильные, амин- и фосфорсодержащие, которые играют жизненно важную роль в метаболизме клетки. Наконец, в роли рецепторов токсичности могут выступать различные медиаторы и гормоны. Например, недавно открытые опиатные рецепторы представляют собой участок гормона гипофиза β-липотропина.
Таким образом, любое химическое вещество, для того чтобы производить биологическое действие, должно обладать по крайней мере двумя независимыми признаками: сродством к рецепторам и собственной физико-химической активностью. Под сродством подразумевается степень связи вещества с рецептором, которая измеряется величиной обратной скорости диссоциации комплекса вещество+рецептор.
Максимальное токсическое действие яда проявляется, когда минимальное количество его молекул способно связывать и выводить из строя наиболее жизненноважные клетки-мишени. Например, токсины бактерий ботулинуса (Glostridium botulinum) способны накапливаться в окончаниях периферических двигательных нервов и в количестве 8 молекул на каждую нервную клетку вызывают их паралич. Таким образом, 1 мг этого токсина может “уничтожить” до 1200 т живого вещества, а 200 г способно погубить все население Земли. Стало быть, дело не столько в количестве пораженных ядом рецепторов, сколько в их значимости для жизнедеятельности организма. Немаловажными являются скорость образования комплексов яда с рецептором, их устойчивость и способность к обратной диссоциации, что нередко играет более важную роль, чем степень насыщения рецепторов ядом.
Однако в токсическом действии многих веществ отсутствует строгая избирательность. Их вмешательство в жизненные процессы основано не на специфических химических воздействиях с определенными клеточными рецепторами, а на взаимодействии со всей клеткой в целом. Этот принцип, вероятно, лежит в основе наркотического действия разнообразных органических и неорганических веществ, общим свойством которых является то, что они представляют собой неэлектролиты. Обнаружив это, известный советский токсиколог Н.В. Лазарев предложил термин “неэлектролитное действие” для обозначения всех эффектов, которые прямо определяются физико-химическими свойствами вещества (наркотическое, раздражающее, прижигающее, гемолитическое действия и др.).
Для клинической токсикологии большое значение имеет обратимость связи яда с рецептором. Большинство токсических веществ, по-видимому, непрочно связывается с рецепторами и их можно “отмыть”. Считают, что ковалентные связи ядов с рецепторами прочные и труднообратимые. К счастью, количество токсических веществ, способных образовывать ковалентные связи, невелико. К ним относятся, например, препараты мышьяка, ртути и сурьмы, механизм действия которых состоит во взаимодействии с сульфгидрильными группами белков; азотистые иприты и фосфорорганические антихолинэстеразные препараты, которые алкилируют (вытесняют) или ацетилируют (окисляют) определенные функциональные группы белков, в последнем примере – фермента холинэстеразы. Хотя указанные ковалентные связи достаточно прочны, в определенных условиях они могут разрушаться с образованием новых ковалентных связей. Так, сульфгидрильные группы пораженной ртутью клетки можно в какой-то мере регенерировать, если ввести достаточное количество антидота – унитиола, содержащего реакционно способные SН-группы.
Большинство известных в настоящее время токсических веществ и лекарственных средств взаимодействует с рецептором при помощи более лабильных, легко разрушающихся связей — ионных, водородных, ван-дер-ваальсовых, что дает возможность их успешного “отмывания” и удаления из организма, В табл. 5 представлены основные типы связей яда с рецептором, их прочность и влияние этих показателей на токсичность ядов.
Таблица 5
Основные типы связей яд + рецептор, влияющие на проявления
токсичности (по А. В. Филатову)
| Тип связи | Энергия связи, ккал/моль | Примеры |
| Ковалентная связь Ионная связь Водородная связь Ван-дер-ваальсова связь | 50-140 5-10 2-5 0,5-1 | Специальное антихолинэстеразное действие (необратимое) Неспецифическое наркотическое действие (обратимое) |
Как видно из данных табл. 5, снижение энергии связи яд + рецептор коррелирует с уменьшением специфических проявлений в ответной реакции организма и делает ее более обратимой.
Токсические вещества можно удалить с рецепторов посредством “отмывания”. Помещенная в раствор, содержащий гистамин, кишка морской свинки начинает сокращаться, а отмывание изотоническим раствором хлорида натрия приводит ее в исходное состояние.Таким образом, современные методы детоксикации базируются на возможности разрушения комплекса яд+рецептор.