ТОКСИКАНТОВ
Интенсивное изучение функции клеточных и внутриклеточных мембран позволило в последние годы выделить специальную группу веществ, оказывающих специфическое мембранотоксическое действие, так называемыемембранотоксины.
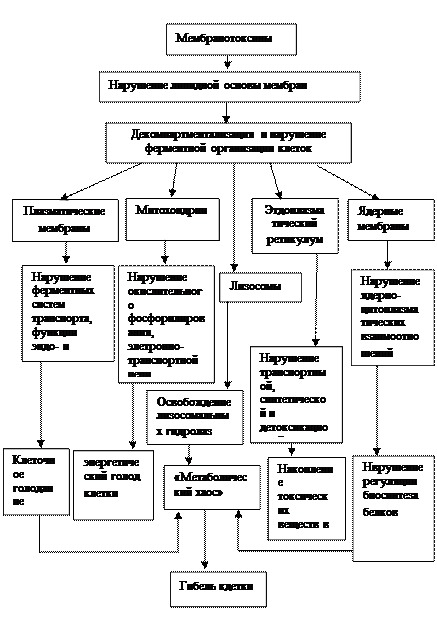
К их числу относят вещества, обладающие способностью разрушать фосфолипиды, в результате чего дезорганизуется и разрушается жидкокристаллическая структура мембран с последующей гибелью клеток.
Показано, что избыток или недостаток витаминов D и Е повышают проницаемость лизосомальных мембран. В этом отношении многие жирорастворимые витамины можно рассматривать как поставляемые с пищей экзогенные регуляторы или своеобразные “настройщики” свойств биологических мембран.
С другой стороны, холестерин, кортизон и ряд синтетических аналогов глюкокортикоидных гормонов, хлорохин, хлорпромазин (аминазин), салицилаты способствуют стабилизации мембран. Естественно, что эти препараты используются в качестве лекарственных средств при отравлениях многими мембранотоксинами. Итак, повреждение мембранных структур клеток является одной из основных причин нарушения их жизнедеятельности при самых разнообразных болезнях.
Существует, по-видимому, несколько механизмов повреждения мембран. Наиболее существенны четыре: а) разрушение собственной фосфолипазой, активируемой ионами Са2+; б) перекисное окисление, активируемое ионами Fе2+; ультрафиолетовым облучением и кислородом; в) механическое повреждение, проявляющееся, например, при изменении осмотического давления в клетке; г) разрушающее действие антител.
Три первые “болезни мембран” (кальциевая, перекисная и осмотическая) относятся как к клеточным (цитоплазматическим), так и к внутриклеточным мембранам (митохондрии, эндоплазматический ретикулум, ядерная мембрана и пр.). Четвертая “болезнь” (иммунологическая) относится преимущественно к клеточной мембране.
При острых отравлениях наиболее распространенной причиной повреждения является перекисное окисление липидов в мембранах митохондрий, липосом и пр., в результате чего происходит увеличение проницаемости мембран для ионов, в первую очередь Н+ (или ОН-), затем К+, Na+, Са2+. Следствием этого могут быть осмотические эффекты и разрывы мембран с выходом ферментов, в частности цитохрома С. Дальнейшее окисление липидов ведет к полному разрушению мембран и гибели клеток.
Повреждение мембран при гипоксии, сопровождающей многие заболевания химической этиологии, связано с недостатком энергии, выделяющейся при метаболизме АТФ, по следующему механизму: гипоксия → деэнергизация и падение мембранного потенциала митохондрий → выход Са2+→ активирование фосфолипазы →гидролиз фосфолипидов →увеличение ионной проницаемости →разобщение окислительного фосфорилирования.
|
Повреждение мембран при гипоксии, сопровождающей многие заболевания химической этиологии, связано с недостатком энергии, выделяющейся при метаболизме АТФ, по следующему механизму: гипоксия → деэнергизация и падение мембранного потенциала митохондрий → выход Са2+→ активирование фосфолипазы →гидролиз фосфолипидов →увеличение ионной проницаемости →разобщение окислительного фосфорилирования.
Видно, что повреждение мембранных структур обусловлено изменением поверхностного заряда на мембране и степени гидрофобности липидной фазы мембран. Это приводит к изменению их проницаемости для ионов, т.е происходит по универсальныму механизмаму. Оба эти фактора действуют одновременно, хотя их относительный вклад в итоговое изменение проницаемости мембран в разных случаях различен. Отсюда следует неспецифическое действие на проницаемость мембран разных соединений, например таких, как стероиды, белки и многие другие природные соединения.
Большинство органических и неорганических соединений являются электролитами: либо слабыми кислотами, либо основаниями. Поэтому скорость транспорта электролитов через мембраны, кроме градиента концентраций, будет прежде всего определяться степенью ионизации молекулы в данных условиях, а затем уже степенью растворимости нейтральной молекулы в жирах. Степень ионизации органических электролитов является функцией константы диссоциации (рКа) и рН среды, рассчитывается по уравнению Гендерсона:
рКа – рН == 1оg Cm/Ci - для кислот,
рКа – рН == 1оg Ci/Cm - для оснований,
где Сm – концентрация молекулярной формы; Сi – концентрация ионизированной формы. Отсюда следует, что каждая молекула в соответствии с рН биологической среды будет существовать в виде этих двух форм, имеющих различную биологическую активность. Возможность многократной ионизации молекулы приводит к появлению разных диссоциированных форм при различных значениях рН в соответствии с рКа этой формы.
Процессы диссоциации электролитов и законы “неионной диффузии” чрезвычайно важны для практической токсикологии, так как биологическое действие ионизированной и неионизированной форм часто бывает несравнимо. Например, показано, что действие барбитуратов на миокард прямо пропорционально концентрации в нем неионизированной формы, а ионизированные молекулы барбитуратов вообще не вызывают токсического эффекта. Для этого примера можно сказать, что накопление и токсическое действие электролитов прямо пропорционально концентрации нейтральной формы, а при значении рН, не допускающем накопления этой формы, токсическое действие вообще не обнаруживается.
Между внеклеточной средой и содержимым клетки, а также протоплазмой клетки и ее органеллами существует концентрационный градиент водородных ионов (рН). Именно этим градиентом во многом определяется накопление токсических веществ в тканях или отдельных органеллах клетки, также влияющих на избирательность токсического действия. Например, клеточная мембрана полностью непроницаема для ионов ртути: этому препятствует градиент Н+. Они могут проникнуть внутрь клетки только после разрушения ее участков за счет связи с сульфгидрильными группами белков. Органические соединения ртути, обладая большой жирорастворимостью, легко минуют мембраны гематоэнцефалического барьера и затем отщепляют ион ртути, оказывающий токсическое действие на центральную нервную систему (ЦНС). Вот почему этилмеркурхлорид на порядок токсичнее двухлористой ртути, при этом избирательная токсичность первого касается преимущественно ЦНС (куда он попадает вследствие своей гидрофобности), а второго — желудочно-кишечного тракта и почек (ворота их непосредственного поступления и выведения из организма).