Физико-химические свойства вещества
Физико-химические свойства веществ существенным образом сказываются на их токсичности. Определяющими являются: растворимость в воде, растворимость в липидах, кислотно-основная природа токсиканта.
А. Растворимость в воде.
Растворимость токсиканта в воде – необходимое условие его резорбции во внутренние среды организма: corpora non agunt nisi soluta (что не растворяется, то не действует). Для того, чтобы достичь структуры-мишени токсикант также должен попасть в водную фазу, так как вода – основа межклеточной жидкости организма. Полярность молекулы воды требует и от токсиканта известной полярности. Поэтому растворимость вещества в воде зависит от наличия и количества в его молекуле полярных групп и их строения (таблица 1).
Таблица 1 – Растворимость некоторых производных бензола в воде (г/100г; С300) 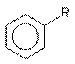
| R | –C2H5 | –J | –Br | –Cl | –CH3 | –F | –NO2 | –SO3H |
| г/100г воды | не раств. | 0,034 | 0,045 | 0,049 | 0,057 | 0,15 | 0,19 | раств. |
Некоторые вещества проявляют свойства кислот или оснований и, следовательно, могут находиться в растворе в протонированной или депротонированной форме. Это также сказывается на их растворимости (рисунок 2).
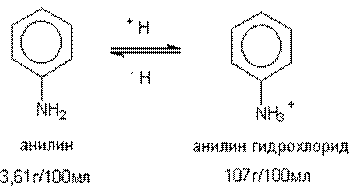
Рисунок 2 – Растворимость анилина и его протонированного производного
Как видно из приведенного рисунка, наличие заряда в молекуле токсиканта существенно сказывается на его способности растворяться в воде, усиливая диполь-диполь взаимодействие растворителя и растворенного соединения.
Б. Растворимость в липидах.
Растворимость в липидах имеет основное значение для процессов проникновения и распределения больших молекул токсикантов в организме. Кроме того, чем выше растворимость вещества в липидах, тем хуже оно выводится из организма. Мерой жиро-растворимости токсикантов является количество вещества, способное к растворению в единице объема жидких масел или органических растворителей. При анализе получаемых результатов следует иметь в виду, что в различных растворителях вещество растворяется по-разному. Так, растворимость амидопирина (г/100 г; 370 С) в бензоле составляет 0,81; в топленом сале – 1,7; растительном масле – 2,0; смеси бензола и лецитина (1:1) – 12,6; хлороформе – 120,6.
Нерастворимые в жирах молекулы могут попасть в организм из окружающей среды лишь в том случае, если они проходят через поры биологических мембран, либо переносятся через барьеры с помощью специальных механизмов, например, пиноцитоза и т.д. (см. раздел «Токсикокинетика»).
Большие, нерастворимые в липидах вещества, как правило, относятся к числу малотоксичных.
Жирорастворимость и водорастворимость – связанные между собой свойства. Чем полярнее молекула вещества, тем лучше она растворяется в воде и хуже – в липидах. Наибольшей биологической активностью, как правило, обладают токсиканты с промежуточной растворимостью. В этой связи важной для токсикологии характеристикой является коэффициент распределения вещества в средах: масло/вода или гептан/вода. Для некоторых веществ их биологическая активность пропорциональна величине этого коэффициента (таблица 2)
Таблица 2 – Зависимость токсичности алифатических спиртов от их жиро- и водорастворимости *.
| Параметры | СН3ОН | С2Н5ОН | С3Н7ОН | С4Н9ОН | С5Н11ОН | С6Н13ОН | С8Н17ОН |
| ЛД50 в/в (мМ/кг) Мыши | 53,7 | 18,2 | 5,09 | 2,09 | 1,01 | 0,53 | |
| Гемолиз эритроцитов кролика (М) | 7,43 | 4,11 | 0,80 | 0,44 | 0,18 | 0,06 | 0,02 |
| Угнетение активности каталазы на 50 % (М) | 3,6 | 3,47 | 2,36 | 1,95 | 1,33 | – | – |
* – жирорастворимость увеличивается с увеличением молекулярной массы спирта.
Четкую корреляцию можно проследить лишь в гомологичных рядах токсикантов, при этом оцениваемые эффекты, как правило, неспецифичны (денатурация энзима, нарушение свойств биологических мембран, наркоз, повреждение клетки, смерть).
Для специфического взаимодействия токсиканта со структурой-мишенью растворимость в воде или липидах имеет неупорядоченное значение.
В. Кислотно-основная природа токсиканта.
Многочисленные токсиканты являются слабыми кислотами или основаниями, то есть могут, в зависимости от рН среды, находиться в протонированной или депротонированной форме. Кислоты, находясь в протонированной форме – незаряженные молекулы, азотистые основания, напротив, представляют собой катионы. В депротонированной форме кислоты представляют собой анионы, а основания – не заряжены. Сила кислоты или основанияопределяется способностью к диссоциации, которая характеризуется величиной константы диссоциации (Ка или рКа – отрицательный десятичный логарифм значения Ка). Чем выше значение рКа, тем легче осуществляется процесс протонирования вещества. Основания с высоким значением рКа - более сильное основание; кислота с высоким рКа – слабая кислота. Так, диметиламин (рКа 10,7) – более сильное основание, чем N-метиланилин (рКа 4,7); фенол (карболовая кислота рКа 9,9) – более слабая кислота, чем бензойная кислота (рКа 4,2). Соотношение ионизированной и неионизированной форм токсиканта в среде помимо величины рКа, определяется рН среды. С увеличением рН увеличивается число незаряженных молекул оснований и заряженных анионов кислот.
Часто ионизация токсиканта сопровождается усилением его сродства к рецептору, однако одновременно затрудняется прохождение молекулы через биологические барьеры.
Сильные кислоты и щелочи (полностью диссоциирующие в водных растворах), при действии на ткани организма, резко изменяя рН, вызывают денатурацию макромолекул клеток. Этот процесс лежит в основе химического ожога покровных тканей.