Фазы и структурные составляющие металлических сплавов. Диаграммы состояния.
Основными техническими материалами являются металлические сплавы, состоящие из двух и более компонентов (металлов и неметаллов). Входящие в состав сплава компоненты, взаимодействуя между собой в, зависимости от своей химической природы, концентрации и внешних параметров системы (температуры) образуют различные фазы. Эти фазы в различных соотношениях и формах составляют микроструктуры сплава и определяют его свойства.
Фазы металлических систем можно разделить на граничные твердые растворы и промежуточные фазы или интерметаллидные соединения.
Граничные твердые растворы – гомогенные (однородные) фазы, которые имеют кристаллическую структуру такую же, как у основного вещества-растворителя. Атомы растворенного компонента могут статистически, то есть без какой-либо системы, замещать атомы растворителя в отдельных узлах его решетки. Такая фаза называется твердый раствор замещения.
Условия образования твердого раствора замещения:-близкие радиусы атомов; электроотрицательность и изоморфные структуры.
Чем полнее выполняются эти условия, тем шире область растворимости вплоть до неограниченной смешиваемости.
Некоторые растворы замещения при снижении температуры могут образовывать сверхструктуры – в которых примесные атомы занимают не произвольные, а строго определенные узлы в решетке растворителя. Такое упорядочение в кристаллической структуре изменяет свойства твердого раствора.
Если атомы растворенного элемента размещаются в междоузлиях, образуется твердый раствор внедрения.Образование такого типа твердого раствора возможно при малых размерах атомов примеси.
Так, например, по типу внедрения образуются твердые растворы неметаллов C, H, N, B, O в переходных металлах Fe, Mn, Ti, Mo, W, Ni, Cr.
Растворы внедрения имеют, как правило, ограниченную растворимость.
Лекция 2 (продолжение темы)
Компоненты с существенно разными электрохимическими свойствами и неизоморфными структурами склонны к образованию интерметаллидных или других химических соединений. Характерной отличительной чертой химического соединение является своя собственная кристаллическая структура, отличная от структуры каждого из его компонентов.
Компоненты могут входить в состав интерметаллидов в стехиометрических соотношениях, образуя дальтониды, или в нестехиометрических, давая бертоллиды. Бертоллиды могут рассматриваться как твердые растворы замещения на основе химического соединения, со стохастическим (произвольным) или упорядоченным замещением.
Структура и свойства интерметаллидов формируется, в основном, под действием геометрического фактора (соотношения атомных радиусов компонентов), предельной концентрации электронов, электрохимических свойств компонентов (разности электроотрицательности).
В зависимости от значимости каждого из этих факторов формируются основные интерметаллиды.
1. Под действием геометрического фактора образуются фазы Лавеса с плотнейшей упаковкой атомов в кристаллической структуре. Соотношение RA/RB = 1,06…1,38. Этим соединениям приписывается стехиометрия АВ2, хотя они являются бертоллидами и существуют в интервале концентраций.
2. Важнейшим фактором в формировании фаз Юм-Розери или электронных фаз является предельная электронная концентрация. Например, в системах Cu-Zn, Cu-Mg и сплавах меди с другими металлами по мере повышения концентрации второго металла повышается электронная концентрация, и при определенных предельных значениях электронной концентрации происходит изменение кристаллической структуры, т. е. одна фаза сменяется другой.
3. В формировании фаз Цинтля ведущую роль играет большая разница электроотрицательности компонентов. Эти фазы образуются активными металлами (ЩМ, ЩЗМ или РЗМ) и металлами II(B), III или IV группы, например Zn, Sn, а также Ag или Al. В фазах, образованных металлами и неметаллами с большой разницей электроотрицательности, химическая связь, наряду с металлической, имеет развитую ковалентную и даже ионную компоненты.
4. В соединениях металлов и неметаллов при значительной разнице в размерах атомов и электроотрицательности образуются фазы внедрения.К этому типу интерметаллидов относятся карбиды, бориды, нитриды и т.п.
Фазовое состояние сплава при тех или иных внешних (температура) и внутренних (концентрационное соотношение компонентов) параметрах описывает равновесная диаграмма состояния.
Диаграммы состояния двойных металлических сплавов изображают в координатах концентрация – температура. Поле диаграммы разделено линиями фазового равновесия на области стабильного существования равновесных фаз. Линия ликвидуса отделяет область жидкого состояния системы, то есть выше линии ликвидуса располагаются на диаграмме только жидкие фазы. Начинается линия ликвидуса в точке плавления одного чистого компонента и заканчивается в точке плавления второго компонента.
Линия солидуса отделяет на диаграмме область твердого состояния системы. Ниже линии солидуса на диаграмме располагаются только твердые фазы. Эта линия тоже начинается и заканчивается в точках плавления чистых компонентов. Каждый из сплавов системы имеет свои температуры ликвидуса (TL) и свою температуру солидуса (TS), при которых начинается и заканчивается равновесное затвердевание (в обратном направлении плавление) этого сплава. Эти температуры лежат соответственно на линиях ликвидуса и солидуса.
Таким образом, линии ликвидуса и солидуса в точках плавления чистых компонентов касаются друг друга, соответственно равновесные плавление и кристаллизация чистых веществ протекают при постоянной температуре. Кристаллизация и плавление сплавов часто происходит в интервале температур ликвидуса и солидуса (TL-TS ). На диаграмме состояния между линиями ликвидуса и солидуса расположена область двухфазного жидко-твердого состояния.
Двухкомпонентные системы могут описываться различными типами диаграмм состояния, основные из них:
1. Диаграмма с образованием непрерывных твердых растворов;
2. Диаграмма с идеальной эвтектикой;
3. Диаграммы с ограниченными твердыми растворами с эвтектикой и с перитектикой
4. Диаграммы с образованием химического соединения, конгруэнтно и инконгруэнтно плавящиеся.
5. Диаграммы систем, имеющих превращения в твердом состоянии.
Диаграмма с образованием непрерывного ряда твердых растворов
Основным методом построения диаграмм состояния является термографический анализ, который основан на изменении скорости охлаждения сплава при фазовом превращении, например, при кристаллизации, вследствие теплового эффекта этого превращения. При достижении температуры ликвидуса начинается выделение твердой фазы из жидкого раствора, и выделяется тепло кристаллизации, которое замедляет охлаждение. На термографической кривой образуется перегиб, точно отвечающий температуре ликвидуса сплава TL. Второй перегиб на кривой охлаждения фиксируется по окончании кристаллизации в точке солидуса TS.

В любом сплаве системы, образующей непрерывный ряд твердых растворов, например, в сплаве I-I при охлаждении ниже температуры ликвидуса (TLI) из жидкого раствора будут выделяться кристаллы a-твердого раствора. Равновесный состав твердого раствора при данной температуре показывает точка, лежащая на линии солидус, – нода солидуса. При температуре Т1 нода солидуса соответствует точке а. По мере увеличения количества твердой фазы состав жидкости будет изменяться в соответствии с ликвидусом. В процессе равновесной кристаллизации нода ликвидуса, показывающая состав жидкости, будет перемещаться по линии ликвидуса. Таким образом, при температуре Т1 состав жидкой фазы будет описываться точкой с.Положение равновесных нод позволяет узнать не только химический состав фаз, но и их объемное соотношение при данной температуре, используя правило равновесного рычага или правило фаз.
Если соединить равновесные ноды жидкой и твердой фаз прямой линией (конодой) ас, то линия I-I, соответствующая среднему составу сплава, поделит эту коноду на отрезки пропорциональные объемным долям равновесных фаз. То есть объемная доля жидкой фазы будет равна отношению длины отрезка аб, противолежащего ликвидусу, к длине всей коноды ас: 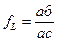 , а доля кристаллов твердого раствора составит
, а доля кристаллов твердого раствора составит 
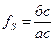 , при этом fL +fS=1.
, при этом fL +fS=1.