Спектр излучения атома водорода
Комбинируя условие движения по окружности
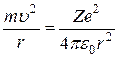
и правило квантования
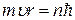
Н.Бор находит радиусы круговых орбит стационарных состояний
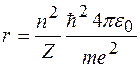 . (7)
. (7)
Величина

представляет собой радиус первой разрешенной орбиты электрона в атоме водорода (т.е. самого нижнего энергетического состояния атома). Его численное значение равно 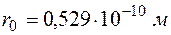 .
.
Полученный результат интересен тем, что впервые чисто теоретически был вычислен размер атома, и по порядку величины он совпал с экспериментальными оценками размеров атомов. Как видно из приведенной формулы, размер атома определяется фундаментальными свойствами электрона - массой и зарядом, и фундаментальными физическими константами  и
и  .
.
Итак,
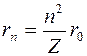 .
.
Радиусы орбит возбужденных состояний увеличиваются пропорционально квадрату номера состояния n (атом разбухает). Для водородоподобных ионов радиус орбит уменьшается с увеличением Z, так как увеличивается сила притяжения.
Подставим выражение (7) в формулу (6) и найдем скорости электрона в стационарных состояниях
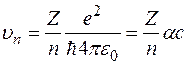 , (8)
, (8)
где с – скорость света,  - постоянная тонкой структуры.
- постоянная тонкой структуры.
Подставим выражение (7) в формулу (2) и найдем спектр энергий
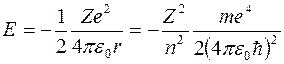 (9)
(9)
Полученная формула показывает, что энергия стационарных состояний определяется фундаментальными константами и обратно пропорциональна квадрату квантового числа n. Данное соотношение остается справедливым и в последовательной квантовой теории, основанной на уравнении Шредингера.
Величина абсолютного значения энергии основного состояния атома водорода

численно равна энергии ионизации невозбужденного атома водорода. Максимальное значение энергии электрона в атоме равно нулю. Для всех состояний электрона, совершающего ограниченное движение, вокруг ядра спектр энергии получается дискретным. Для состояний совершающих неограниченное движение возможны любые значения энергии, но при этом ядро и электрон не образуют связанную систему.
Схема атомных энергетических уровней водорода показана на рис. 5. Поскольку  , то схема энергетических уровней является зеркальным отражением схемы термов относительно их нулевого значения, с той разницей, что процессам излучения соответствуют переходы из состояния с большим значением энергии (меньшим значением терма) в состояние с меньшим значением энергии (большим значением терма). Каждая спектральная серия получается переходами со всех более высоких уровней на один и тот же нижний уровень. Так серия Лаймана получается при переходах со всех верхних уровней в основное состояние (n=1). Серия Бальмера получается при переходах с более высоких уровней на второй (n=2).
, то схема энергетических уровней является зеркальным отражением схемы термов относительно их нулевого значения, с той разницей, что процессам излучения соответствуют переходы из состояния с большим значением энергии (меньшим значением терма) в состояние с меньшим значением энергии (большим значением терма). Каждая спектральная серия получается переходами со всех более высоких уровней на один и тот же нижний уровень. Так серия Лаймана получается при переходах со всех верхних уровней в основное состояние (n=1). Серия Бальмера получается при переходах с более высоких уровней на второй (n=2).
4. Воспользовавшись боровским правилом частот и энергетическим спектром (4), определим частоты спектра излучения атома водорода и водородоподобных ионов
 . (5)
. (5)
Величина

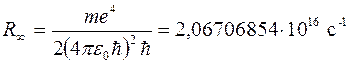 отличается от постоянной Ридберга для атома водорода в третьей значащей цифре. Для спектроскопической точности измерений этого не достаточно. Данное различие обусловлено тем, что масса ядра считалась бесконечной. Если учитывать конечность масс ядра, то вместо массы электрона нужно использовать приведенную массу системы электрон-ядро
отличается от постоянной Ридберга для атома водорода в третьей значащей цифре. Для спектроскопической точности измерений этого не достаточно. Данное различие обусловлено тем, что масса ядра считалась бесконечной. Если учитывать конечность масс ядра, то вместо массы электрона нужно использовать приведенную массу системы электрон-ядро  . В этом случае вместо
. В этом случае вместо 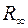 получаем
получаем
 .
.
Формула (10) позволяет вычислить частоты всех спектральных линий атома водорода и водородоподобных ионов хорошем согласии с экспериментальными значениями.
Все спектральные линии атома водорода (Z=1) объединяются в серии. Серия линий ультрафиолетовой области спектра называется серией Лаймана. Она получается при переходах со всех верхних уровней в основное состояние (n=1). Серия Бальмера, лежащая в видимой части спектра, получается при переходах с более высоких уровней на второй (n=2).
В серии Пашена (инфракрасное излучение) переходы оканчиваются на третьем уровне (n=3). Далее идут серии линий Брэкета (n=4), Пфунда (n=5) и т.д.
Теория Бора – важный этап в понимании внутриатомных явлений. Эта теория подготовила почву для уяснения того важнейшего факта, что понимания явлений микромира классических понятий и классических законов недостаточно. В области микромира нужны принципиально новые понятия и законы.
Теория Бора послужила мощным стимулом для постановки многих экспериментов, принесших новые результаты. Даже в тех случаях, когда теория была не в состоянии дать количественного объяснения многих явлений, два постулата служили руководящей нитью при классификации и качественной интерпретации этих явлений.
Но двух постулатов для построения теории недостаточно. Они должны быть дополнены, прежде всего, правилами квантования. Правило квантования, введенное Бором, распространить на другие атомные системы не удалось. Теория Бора оказалась неспособной дать приближенное решение задачи трех тел. Она тем более не могла дать решения и более сложного вопроса – образования молекулы.
Теория Бора даже в простейшем случае одноэлектронных атомов позволяла вычислять только частоты спектральных линий, но не их интенсивности и поляризацию. Правда для нахождения интенсивностей и поляризации она использовала принцип соответствия. Но принцип соответствия мог быть оправдан только при больших квантовых числах, где вычисления могли быть произведены классически. Теория Бора распространяла результат и на малые квантовые числа, для чего не было ни каких оснований.
Основной недостаток теории Бора – ее непоследовательности. Она принимала существование только стационарных состояний атома. это совершенно непонятно с точки зрения классической механики. В то же время к движению электрона в стационарных состояниях она использовала законы классической механики.
Два постулата Бора, если не пользоваться представлением об орбитах электронов в атомах, проверены экспериментально и потому должны считаться правильными. Но сама теория Бора в целом является только промежуточным этапом на пути к более совершенной и последовательной теории. Это хорошо понимал сам Бор, которому принадлежит главная заслуга в осмысливании принципиальных положений квантовой механики, пришедшей на смену теории Бора.
Планк ввел представление о квантовом характере процессов излучения света. Эйнштейн распространил квантование света и на его распространение в пространстве, введя представление о фотонах. Теория теплоемкостей Эйнштейна прямо указала, что введенная Планком постоянная  проявляется не только в световых явлениях, но и в процессах происходящих в веществе. Дальнейший шаг в развитие квантовых представлений сделал Бор. Успех теории Бора в вычислении постоянной Ридберга и размеров атома выявил значение постоянной Планка как универсальной фундаментальной величины для описания всех видов материи.
проявляется не только в световых явлениях, но и в процессах происходящих в веществе. Дальнейший шаг в развитие квантовых представлений сделал Бор. Успех теории Бора в вычислении постоянной Ридберга и размеров атома выявил значение постоянной Планка как универсальной фундаментальной величины для описания всех видов материи.