Результирующий механический момент атома
В многоэлектронных атомах все орбитальные и спиновые моменты электронов складываются в единый угловой момент атома. Конечно результирующий момент от порядка слагаемых не зависит, но, тем не менее, в реальных атомах возникает определенное предпочтение к тому или иному сложения угловых моментов. Так в легких и не очень тяжелых атомах орбитальные моменты взаимодействуют сильнее, чем взаимодействуют спиновый и орбитальный моменты одного электрона, и поэтому образуют единый результирующий момент орбитального движения
 ,
,
величина которого определяется квантовым числом 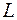
 .
.
Квантовые числа  являются целыми числами, поэтому и число
являются целыми числами, поэтому и число 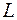 принимает только целые значения.
принимает только целые значения.
Соответственно складываются и спиновые моменты
 ,
,
величина которого определяется квантовым числом 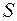
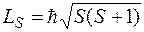 .
.
Состояние электронной оболочки атома характеризуется не только суммарными моментами  и
и  , но и полным моментом импульса
, но и полным моментом импульса

с квантовым числом 
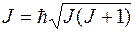 .
.
Квантовые числа  имеют смысл наибольших значений квантовых чисел проекций соответствующих моментов
имеют смысл наибольших значений квантовых чисел проекций соответствующих моментов
 ,
,
 ,
,
 .
.
Такой вид связи угловых моментов встречается чаще всего и называется нормальной связью ( - связью, связью Рёссель-Саундерса)
- связью, связью Рёссель-Саундерса)
Квантовое число 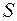 результирующего спинового момента атома может быть целым или полуцелым в зависимости от того, каким является число электронов в атоме – четным или нечетным. Например, при
результирующего спинового момента атома может быть целым или полуцелым в зависимости от того, каким является число электронов в атоме – четным или нечетным. Например, при 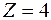
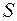 может принимать значения 2, 1, 0. При
может принимать значения 2, 1, 0. При 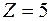 возможными значениями будут
возможными значениями будут 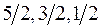 .
.
При данных 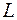 и
и 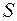 квантовое число
квантовое число  принимает значения
принимает значения
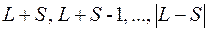 .
.
Следовательно,  будет целым при четном числе электронов и полуцелым – при нечетном числе электронов.
будет целым при четном числе электронов и полуцелым – при нечетном числе электронов.
Для полностью заполненных внутренних оболочек, как спиновые моменты, так и орбитальные полностью скомпенсированы, т.е. равны нулю. поэтому состояние атома характеризуется только состоянием валентных оболочек.
В спектроскопии состояние наружных оболочек электронов характеризуется квантовым числом 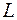 , причем вместо численного значения используются буквенные обозначения
, причем вместо численного значения используются буквенные обозначения 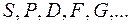 . Справа внизу у буквы указывается число
. Справа внизу у буквы указывается число  , а слева вверху указывается число
, а слева вверху указывается число 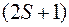 , называемое мультиплетностью уровня (состояния). По этому числу можно определить не только спиновое число, но и число подуровней на которое расщепляется данный уровень из-за спин-орбитального взаимодействия при
, называемое мультиплетностью уровня (состояния). По этому числу можно определить не только спиновое число, но и число подуровней на которое расщепляется данный уровень из-за спин-орбитального взаимодействия при  . При
. При 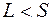 , фактическая мультиплетность равна
, фактическая мультиплетность равна 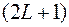 . Однако символ терма пишут в прежнем виде, иначе он не содержал бы информацию о значении квантового числа
. Однако символ терма пишут в прежнем виде, иначе он не содержал бы информацию о значении квантового числа 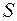 .
.
Например, когда наружная оболочка атома состоит из двух электронов, то возможны два случая: 1) спины электронов направлены противоположно, поэтому  ; 2) спины электронов параллельны, тогда
; 2) спины электронов параллельны, тогда 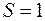 .
.
 В первом случае
В первом случае  ,
, 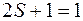 , т.е. все уровни синглетны. соответственно различным значениям
, т.е. все уровни синглетны. соответственно различным значениям 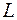 получаются следующие состояния
получаются следующие состояния
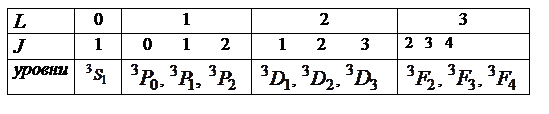 |
Во втором случае
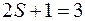 , т.е. все уровни триплетны, за исключением уровней S, которые всегда синглетны. Здесь возможны три случая:
, т.е. все уровни триплетны, за исключением уровней S, которые всегда синглетны. Здесь возможны три случая: 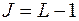 ,
,  ,
, 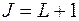 . В соответствии с этим получается таблица
. В соответствии с этим получается таблица
Энергия атома зависит от взаимной ориентации орбитальных моментов отдельных электронов (от квантового числа 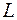 ), от взаимной ориентации спиновых моментов (от квантового числа S) и от взаимной ориентации
), от взаимной ориентации спиновых моментов (от квантового числа S) и от взаимной ориентации  и
и  (от квантового числа J).
(от квантового числа J).
Спин-орбитальное взаимодействие проявляет себя не только в атоме водорода, но и во всех атомах такое взаимодействие приводит к расщеплению уровней на мультиплеты. В качестве примера рассмотрим тонкую структуру энергетических уровней щелочных металлов на примере  .
.
Тонкая структура термов щелочных металлов и сходных с ними ионов обусловлена в основном спин-орбитальным взаимодействием, а не зависимостью массы от скорости.
Картина тонкого расщепления термов в щелочных металлах выглядит проще, чем у водорода. У водорода она осложнена вырождением по 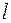 .
.
В щелочных металлах вырождение энергетических уровней снято из-за отличия электрического поля, создаваемого остовом, от кулоновского. Поэтому энергия термов с различными значениями орбитального числа не одинакова.
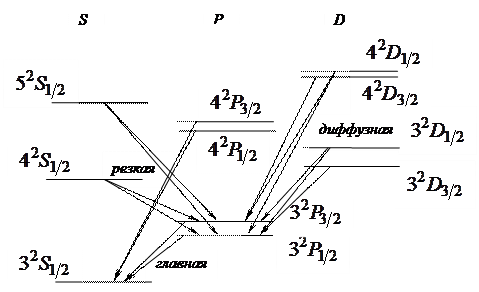
Тонкая структура термов обусловливает тонкую структуру спектральных линий. Правила отбора при излучении и поглощении света требуют, чтобы квантовое число полного углового момента либо не изменилось, либо изменилось на единицу
 .
.
Для орбитального числа
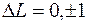 , за исключением ситуации, когда орбитальное число одного из состояний равно нулю. Значение
, за исключением ситуации, когда орбитальное число одного из состояний равно нулю. Значение  невозможно так же для атомов с одним валентным электроном (например, для водорода и щелочных металлов).
невозможно так же для атомов с одним валентным электроном (например, для водорода и щелочных металлов).
 |
Излучение фотона происходит либо в результате изменения движения заряда (изменение
 ), либо в результате поворота спинового момента, либо в результате обоих этих процессов сразу. Излучение, вызванное поворотом спина, конечно, - существенно релятивистский эффект. Поскольку в оптическом диапазоне взаимодействие фотона с зарядом электрона на несколько порядков сильнее его взаимодействия с магнитным моментом, то можно считать, что излучение фотона в этом диапазоне не связано с изменением
), либо в результате поворота спинового момента, либо в результате обоих этих процессов сразу. Излучение, вызванное поворотом спина, конечно, - существенно релятивистский эффект. Поскольку в оптическом диапазоне взаимодействие фотона с зарядом электрона на несколько порядков сильнее его взаимодействия с магнитным моментом, то можно считать, что излучение фотона в этом диапазоне не связано с изменением 
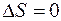 .
.
Главная серия спектральных линий возникает в результате переходов на наиболее глубокий уровень  со всех выше лежащих
со всех выше лежащих 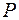 - уровней. уровень
- уровней. уровень  синглет, а
синглет, а 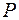 уровни – дублеты. Поэтому спектральные линии главной серии получаются двойными – дублетами. Разность частот в дублете уменьшается при увеличении частоты спектральных линий. Главная серия возникает и в спектрах поглощения, так как в нормальном состоянии атомы
уровни – дублеты. Поэтому спектральные линии главной серии получаются двойными – дублетами. Разность частот в дублете уменьшается при увеличении частоты спектральных линий. Главная серия возникает и в спектрах поглощения, так как в нормальном состоянии атомы  находятся на наиболее низком уровне, т.е. на уровне
находятся на наиболее низком уровне, т.е. на уровне  .
.
Линии резкой серии также являются дублетами.. они возникают при переходе с одиночных S-уровней на двойной 3p- уровень. Разность частот для всех переходов одинакова. Сами линии являются резкими линиями.
Диффузная серия возникает при переходах на двойной ( ) уровень с вышележащих также двойных D-уровней. Ее спектральные линии являются триплетами. Разность энергий D-уровней значительно меньше разности энергий P-уровней. По этой причине при недостаточной разрешающей силе спектральных приборов компоненты триплета не разрешаются, а сами линии получаются размытыми. Поэтому данная серия получила название диффузной.
) уровень с вышележащих также двойных D-уровней. Ее спектральные линии являются триплетами. Разность энергий D-уровней значительно меньше разности энергий P-уровней. По этой причине при недостаточной разрешающей силе спектральных приборов компоненты триплета не разрешаются, а сами линии получаются размытыми. Поэтому данная серия получила название диффузной.