СВОЙСТВА РАСТВОРОВ ПОЛИЭЛЕКТРОЛИТОВ.
К полиэлектролитам относятся важнейшие биополимеры – белки и нуклеиновые кислоты.
Полиэлектролиты - это высокомолекулярные соединения, макромолекулы которых содержат полярные ионогенные группы. Полиэлектролиты способны диссоциировать в растворах на ионы.
Изоэлектрическое состояние
 Наиболее полно изучены свойства растворов белков. Белки содержат группы как кислотного, так и основного характера, поэтому они относятся к полиамфолитам. Амфотерность связана с наличием в молекуле белка катионобразующих групп – аминогрупп (NH2) и анионобразующих групп – карбоксильных групп (COOH).
Наиболее полно изучены свойства растворов белков. Белки содержат группы как кислотного, так и основного характера, поэтому они относятся к полиамфолитам. Амфотерность связана с наличием в молекуле белка катионобразующих групп – аминогрупп (NH2) и анионобразующих групп – карбоксильных групп (COOH).
Знак заряда макромолекулы зависит от:
Ø Количества и природы свободных функциональных групп, например от соотношения карбоксильных и аминогрупп в молекуле белка.
Если в макромолекуле преобладают карбоксильные группы, то при рН = 7 заряд молекулы отрицательный (проявляются свойства слабой кислоты), если преобладают аминогруппы, то заряд белка положительный (характерны основные свойства)

В условиях жизнедеятельности организма белки обычно проявляют анионактивные свойства, вследствие чего поверхность эритроцитов и клеток имеет отрицательный заряд.
Ø рН среды
 В кислой среде макромолекула приобретает положительный заряд, в щелочной - отрицательный.
В кислой среде макромолекула приобретает положительный заряд, в щелочной - отрицательный.
 Состояние, при котором число разноименных зарядов в белковой молекуле одинаково, т.е. суммарный заряд полиамфолита равен нулю, называется изоэлектрическим. Значение рН раствора, соответствующее изоэлектрическому состоянию, называется изоэлектрической точкой (pI или И.Т.). В среде с бóльшей кислотностью, чем в изоэлектрической точке (pH < pI) ионизация карбоксильных групп подавлена и белок приобретает положительный заряд. В среде с меньшей кислотностью, чем в изоэлектрической точке (pH > pI) карбоксильные группы депротонированы и белок заряжается отрицательно.
Состояние, при котором число разноименных зарядов в белковой молекуле одинаково, т.е. суммарный заряд полиамфолита равен нулю, называется изоэлектрическим. Значение рН раствора, соответствующее изоэлектрическому состоянию, называется изоэлектрической точкой (pI или И.Т.). В среде с бóльшей кислотностью, чем в изоэлектрической точке (pH < pI) ионизация карбоксильных групп подавлена и белок приобретает положительный заряд. В среде с меньшей кислотностью, чем в изоэлектрической точке (pH > pI) карбоксильные группы депротонированы и белок заряжается отрицательно.
Таким образом, при рН раствора < рI, белок имеет положительный зарад; при рН раствора > рI, белок имеет отрицательный заряд. Например, определить заряд следующих белков в растворе с рН =8,5: пепсина желудочного крови, гистона клеточных ядер и лизоцима.
 рI (пепсина) = 2,0, т.к. pI меньше рН раствора, следовательно, белок имеет отрицательный заряд,
рI (пепсина) = 2,0, т.к. pI меньше рН раствора, следовательно, белок имеет отрицательный заряд,
рI (гистона) = 8,5 , т.к. pI равен рН раствора, то белок нейтрален,
рI (лизоцима) = 10,7, т.к. рI больше рН раствора, то белок имеет положительный заряд.
Свойства растворов белков
в изоэлектрическом состоянии.
Изоэлектрическое состояние оказывает влияние на структуру белков и их растворов. Для изоэлектрической точки характерно свертывание макромолекул белка в клубки; в заряженном состоянии цепи белков имеют вытянутую форму.
Схематичное изображение структур белков:
 а) глобулярная структура (pH = pI);
а) глобулярная структура (pH = pI);
б) фибриллярная структура с отрицательным зарядом (pH > pI);
в) фибриллярная структура с положительным зарядом (pH < pI).
Кроме того, в изоэлектрическом состоянии уменьшается сольватная оболочка белка т.к отсутствует мощная электростатическая сольватация. Поэтому вблизи изоэлектрической точки могут происходить коренные изменения в свойствах белков и их растворов.
Так в изоэлектрической точке минимальны электропроводность, устойчивость и набухание белков, а так же вязкость и осмотическое давление растворов белков и максимальны процессы коагуляции и желатинирования.
Электрофорез.
Электрофорез (от электро… и греческого рhoresis – перенесение) – направленное перемещение заряженных частиц в дисперсионной среде под действием внешнего постоянного электрического поля к противоположно заряженному электроду.
Метод позволяет разделять макромолекулы, различающиеся по таким важнейшим параметрам, как
· размеры (или молярная масса),
· пространственная конформация,
· электрический заряд
причем эти параметры могут выступать как порознь, так и в совокупности.
Физический принцип метода заключается в следующем. Находящиеся в буферном растворе макромолекулы обладают электрическим зарядом, величина и знак которого зависят от рН среды. Если через этот раствор пропускать электрический ток, то под действием электрического поля макромолекулы в соответствии со своим зарядом мигрируют в направлении катода или анода. В зависимости от величины заряда и размеров молекулы приобретают разные скорости, и в этом — сущность процесса разделения смеси белков методом электрофореза. Постепенно исходный препарат, состоявший из различных молекул, разделяется на зоны или фракции, содержащие одинаковые молекулы.
Факторы, влияющие на электрофоретическую подвижность
Молекула белка в растворе при любом значении рН, отличающемся от изоэлектрической точки, имеет определенный заряд. Это приводит к тому, что белок движется в электрическом поле (макрокатион к катоду, макроанион к аноду). На электрофоретическую подвижность белковых молекул влияют следующие факторы:
Ø Размер и форма макромолекулы.
Ø Заряд макромолекулы
Чем больше величина заряда белковой молекулы, тем выше ее электрофоретическая подвижность из-за увеличения силы электростатического притяжения с противоположно заряженным электродом.
Ø Напряженность электрического поля (Н, В/м)
Ø Характер буферного раствора
Электрофорез сыворотки крови обычно проводят при нейтральных или слабощелочных рН = 8,6, когда большинство белков мигрирует к аноду.
Ø Природа носителя
Чаще всего в качестве носителей используют относительно инертные вещества, но их состав все же оказывает влияние на подвижность разделяемых веществ, и, выбор носителя зависит от природы образца.
Методы электрофореза
Существует множество разновидностей и модификаций метода электрофореза, которые используются в различных областях.
Выделяют три основных типа электрофоретических систем: электрофорез с подвижной границей, зональный электрофорез и стационарный (вытесняющий) электрофорез.

Электрофорез белков подразделяется также на одномерный и двумерный, препаративный и аналитический, а также электрофорез нативных белков. В случае использования иммунологических методов для выявления разделенных белков используется иммуноэлектрофорез.
Зональный электрофорез
В случае зонального электрофореза смешивание разделенных зон может быть предотвращено. При этом методе разделение производят в закрепленной среде. Наиболее распространены методы разделения на пористых носителях.
Электрофорез на бумаге. Электрофорез проводят с использованием боратных, фосфатных или веронал-мединаловых буферных растворов. Носителем служит специальная хроматографическая бумага, которую разрезают на полоски требуемого размера. Наносят сыворотку крови на катодный конец смоченной буферным раствором полоски. В зависимости от типа прибора и условий опыта электрофорез на бумаге длится от 4 до 16 часов. Скорость движения белков пропорциональна величине их электрического заряда. За определенное время белковые фракции пройдут различный путь и разделятся.
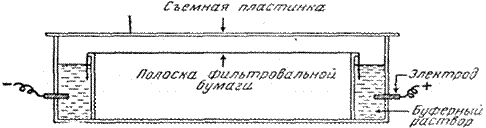
Схема прибора для электрофореза на бумаге.
 Затем белки фиксируют высушиванием и красят красителями. Окрашенные зоны белковых фракций вырезают и элюируют специальным растворителем (раствор NaOH) для фотометрического определения каждой фракции. При электрофорезе на бумаге белков сыворотки крови получается до 5 фракций: альбумины, a1-, a2-, b-, g-глобулины.
Затем белки фиксируют высушиванием и красят красителями. Окрашенные зоны белковых фракций вырезают и элюируют специальным растворителем (раствор NaOH) для фотометрического определения каждой фракции. При электрофорезе на бумаге белков сыворотки крови получается до 5 фракций: альбумины, a1-, a2-, b-, g-глобулины.
Электрофореграмма сыворотки крови на хроматографической бумаге:
1 – альбумин, 2 – a1-глобулин, 3 – a2-глобулин, 4 – b-глобулин, 5 – g-глобулин.
Электрофорез на ацетатцеллюлозной мембране. Мембрана ацетатцеллюлозы как носитель для электрофореза имеет ряд преимуществ по сравнению с бумагой: однородность, строго определенный размер пор, пониженная адсорбционная способность, что исключает образование размытых полос позади зон. Для окрашивания зон применяют методы аналогичные методам окрашивания зон на бумаге.
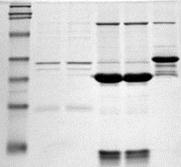 Электрофорез в гелях. В этом методе в качестве опорной среды используют крахмальный, агар-агаровый, полиакриламидный гели. Характерной особенностью этой разновидности зонального электрофореза является его высокая разрешающая способность, поскольку гели функционируют как молекулярные сита: крупные молекулы проходят сквозь него тем медленнее, чем меньше размер пор в геле. Методом электрофореза в агаровом геле в сыворотке крови выявляется до 7-8 фракций, а при электрофорезе в крахмальном или полиакриламидном геле – до 20 фракций. Агаровый гель ввиду большого количества воды в нем и вследствие этого большой скорости движения ионов используется в иммуноэлектрофорезе для обнаружения антигенов. Самым перспективным является полиакриламидный гель, так как он прозрачен, обладает значительной механической прочностью, однороден по составу, химически инертен, размер пор у этого геля можно варьировать в широких пределах и его можно использовать с самыми различными буферными растворами. Скорость движения белков пропорциональна их заряду и молекулярной массе.
Электрофорез в гелях. В этом методе в качестве опорной среды используют крахмальный, агар-агаровый, полиакриламидный гели. Характерной особенностью этой разновидности зонального электрофореза является его высокая разрешающая способность, поскольку гели функционируют как молекулярные сита: крупные молекулы проходят сквозь него тем медленнее, чем меньше размер пор в геле. Методом электрофореза в агаровом геле в сыворотке крови выявляется до 7-8 фракций, а при электрофорезе в крахмальном или полиакриламидном геле – до 20 фракций. Агаровый гель ввиду большого количества воды в нем и вследствие этого большой скорости движения ионов используется в иммуноэлектрофорезе для обнаружения антигенов. Самым перспективным является полиакриламидный гель, так как он прозрачен, обладает значительной механической прочностью, однороден по составу, химически инертен, размер пор у этого геля можно варьировать в широких пределах и его можно использовать с самыми различными буферными растворами. Скорость движения белков пропорциональна их заряду и молекулярной массе.
Фотография электрофореграмм смеси белков, разделенных в полиакриламидном геле, иллюстрирующая разделение белков по заряду и молекулярной массе.
 Вариантов проведения электрофореза в полиакриламидном геле много (вертикальный в трубках и горизонтальный на пластинах).
Вариантов проведения электрофореза в полиакриламидном геле много (вертикальный в трубках и горизонтальный на пластинах).

| Схема простейшего прибора для электрофореза в геле а - до фракционирования, б - после его окончания | Схема прибора для электрофореза в горизонтальных пластинах 1-антиконденсационная крышка; 2 – электродный резервуар; 3 - колодец для внесения препарата; 4 - гель; 5 - фитиль; 6-охлаждающий столик |
Вытеснительный электрофорез.
Этот метод характеризуется тем, что через некоторое время после разделения зон устанавливается состояние равновесия, при котором ширина зон в дальнейшем не изменяется. К электрофорезу такого типа относятся изоэлектрическое фокусирование.
Изоэлектрическое фокусирование. Это метод разделения белков, основанный на перемещении их молекул под действием постоянного электрического тока в область с величиной рН, соответствующей изоэлектрической точке данного белка. Между анодом и катодом создается градиент рН с помощью амфолитов. Каждый белок мигрирует к соответствующему электроду и прекращает движение, попадая в зону с pH = pJ (фокусируется). Таким образом, молекулы, имеющие одинаковую изоэлектрическую точку, сконцентрируются в узкой зоне.
Применение электрофореза
Электрофорез является одним из наиболее важных методов для разделения и анализа компонентов веществ в химии, биохимии и молекулярной биологии. Его применяют в физиотерапии, для окраски автомобилей, для осаждения дымов и туманов, для изучения состава растворов и др.
Электрофорез лекарственный – метод физиотерапии, заключающийся в одновременном воздействии на организм постоянного электрического тока и вводимых им (через кожу или слизистые оболочки) ионов лекарственных веществ. При лекарственном электрофорезе повышается чувствительность рецепторов к лекарственным веществам, которые полностью сохраняют свои фармакологические свойства. Основные особенности лекарственного электрофореза – выраженное и продолжительное терапевтическое действие малых доз лекарственных веществ за счет создания своеобразного кожного депо применяемых препаратов. Электрофорез лекарственный применяется при заболеваниях центральной и периферической нервной системы, опорно-двигательного аппарата, гинекологических заболеваниях и др.
Возможность упростить процесс обработки обширной и разносторонней информации, получаемой в результате электрофоретических и других исследований, дает использование лабораторной компьютерной системы. Получаемые денситограммы представляют собой графики зависимости оптической плотности от подвижности каждой фракции. Площадь пика пропорциональна количеству белков, находящихся в соответствующей фракции. Каждая фракция соответствует определенному белку. Процентное содержание отдельных белковых фракций меняется при многих заболеваниях. С помощью электрофореза можно провести первый этап оценки следующих патофизиологических процессов: иммунодефицит, воспалительный процесс, снижение синтеза белка, состояние потери белка, внутрисосудистый гемолиз, генетические варианты белков. Альбумины выполняют важную функцию по транспортировке многих биологически активных веществ. Они способны связываться с холестерином. Значительная часть кальция в сыворотке также связана с альбумином. Бóльшая часть антител, содержащихся в сыворотке, связана с фракцией g-глобулинов. Уменьшение содержания белков этой фракции резко снижает защитные силы организма.
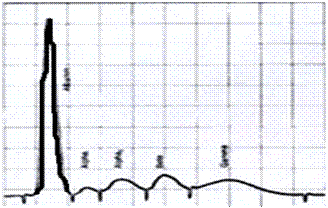
| |||||||
| альбумин | 56,3—68,8% | ||||||
| α1-глобулин | 3—5,8% | ||||||
| α2-глобулин | 6,9—10,5% | ||||||
| 7,3—12,5% | ||||||
| 12,7—19,2% |
| ||||||
|
| |||||



Рис. 13 Графики зависимости оптической плотности от процентного содержания каждой фракции белка в сыворотке крови: А – альбумин; Б – a1-глобулин; В – a2-глобулин; Г – b-глобулин; Д – g-глобулин.
а) нормальная электрофореграмма сывороточных протеинов;
б) электрофореграмма при хроническом воспалении;
в) электрофореграмма при тяжелой форме гепатита;
г) электрофореграмма при циррозе.