рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Биотехнологии
- /
- Биотехнологические основы культивирования микроорганизмов.
Реферат Курсовая Конспект
Биотехнологические основы культивирования микроорганизмов.
Биотехнологические основы культивирования микроорганизмов. - раздел Биотехнологии, ОСНОВЫ БИОТЕХНОЛОГИИ Обобщенная Схема Промышленного Выращивания Микроорганизмов С Целью Получения ...
Обобщенная схема промышленного выращивания микроорганизмов с целью получения конечных продуктов представлена на рис 9.
Исходная культура (5-10 мл)
↓
Встряхиваемая колба (200-1000 мл)
↓
Ферментер для посевного материала (10-100 л)
↓
Промышленный ферментер (>100 л)
↓
Сбор биомассы
↓
Клетки (Культуральная среда)
↓
Разрушение (экстракция)
↓
Очистка продукта
Рис. 9. Схема промышленного выращивания микроорганизмов.
Переход от лабораторного синтеза к промышленному – это не просто увеличение масштаба, т.е. условия, оптимальные для малых объемов не будут оптимальными для больших. Например, аэробные микроорганизмы хорошо растут в обычной колбе на 200 мл при аэрации ее содержимого с помощью мешалки мощностью 300 Вт. Если просто увеличить объем «колбы» до 10000 литров, то потребуется мешалка мощностью 15 МВт. Ее мотор будет размером с дом, а при перемешивании выделится столько тепла, что микроорганизмы погибнут. Поэтому для получения максимального выхода как в малых (от 1 до 10 л), так и в больших (>1000 л) биореакторах необходимо оптимизировать множество параметров: температуру, рН, способ и интенсивность перемешивания и (в случае аэробных организмов) – концентрацию кислорода. Считают, что оптимальные условия изменяются при каждом десятикратном увеличении объема биореактора. Промышленное выращивание микроорганизмов с целью получения очищенного продукта – ферментация– процесс многоступенчатый (рис. 9). Обычно процедура начинается с приготовления и стерилизации культуральной среды и оборудования. Сначала выращивают исходную культуру (5-10 мл), затем инкубируют ее во встряхиваемой колбе (200-1000 мл), после чего переносят в ферментер для посевного материала (10-100 л) и, наконец, в промышленный ферментер (1000-1000000 л). По завершении ферментации клетки выделяют из культуральной среды центрифугированием или фильтрацией. Если продукт локализован внутри клеток, последние разрушают, удаляют клеточные осколки и выделяют продукт из осветленной среды. Секретируемый продукт выделяют непосредственно из среды.
Рост и развитие микроорганизмов. В последние 15 лет для выращивания продуцентов ферментов чаще используют глубинный метод культивирования (рис. 10). В промышленных условиях для этих целей применяют ферментеры из нержавеющей стали, снабженные приспособлениями для перемешивания и подачи в жидкую питательную среду стерильного воздуха.
 Рис. 10. Методы ферментации (Голубев В.Н., Жиганов И.Н., 2001).
Рис. 10. Методы ферментации (Голубев В.Н., Жиганов И.Н., 2001).
Сначала ферментер заполняют питательной средой, автоклавируют, а затем засевают чистой культурой, подаваемой из специального генератора. Для предотвращения контаминации (инфекции) в ферментере поддерживают повышенное давление наряду с оптимальными значениями рН, температуры, редокс-потенциала и другими условиями культивирования (рис. 11). В настоящее время наиболее прогрессивным признан проточный метод культивирования микроорганизмов, который обеспечивает непрерывную подачу в ферментер как питательной среды, так и посевного материала.
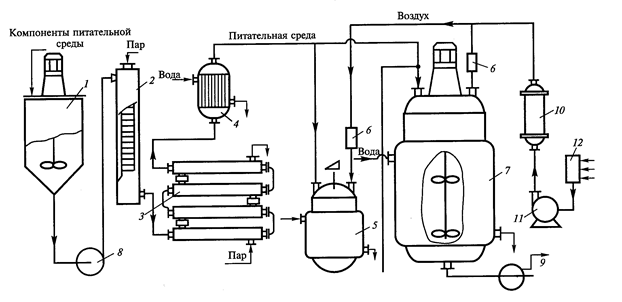
Рис.11. Принципиальная схема глубинного культивирования микроорганизмов (Т.А.Егорова и соавт., 2003): 1 – смеситель питательной среды; 2 – стерилизатор в непрерывном режиме потока питательной среды; 3,4 – теплообменники; 5 – посевные аппараты; 6, 10, 12 – фильтры для очистки воздуха; 7 – ферментер; 8,9 – насосы;
Микроорганизмы можно выращивать:
- в ферментере периодического действия (микроорганизмы выращивают без добавления свежей культуральной среды);
- в ферментере периодического действия с добавлением субстрата (периодически добавляют увеличивающиеся количества питательных веществ, но культуральную среду не удаляют до конца процесса);
- в непрерывной культуре (свежая культуральная среда поступает в ферментер непрерывно, и параллельно отводится такой же объем клеточной суспензии).
В ходе периодической ферментации различают шестьосновных фаз роста:
- лаг-фазу (наблюдается, когда посевной материал получен из культуры, рост которой прекратился в результате исчерпания субстрата или ингибирования продуктом);
- фазу ускорения (скорость роста клеток увеличивается до достижения постоянной величины);
- логарифмическую (экспоненциальную) фазу (клетки претерпевают несколько делений, а удельная скорость роста остается постоянной);
- фазу замедления (кратковременная при истощении субстрата);
- стационарную фазу (биомасса остается постоянной, но метаболизм резко меняется – синтез вторичных метаболитов, например, антибиотиков);
- фазу отмирания (исчерпание энергетических запасов клетки и прекращение метаболизма).
Кривую роста в логарифмической фазе описывают математически. Прирост клеточной массы во времени dX/dt равен произведению удельной скорости роста μ на биомассу Х:
dX/dt= μ Х
Аналогично, прирост числа клеток dN/dt равен произведению удельной скорости μ на число клеток N:
dN/dt= μ N
Удельная скорость μ зависит от концентрации лимитирующего субстрата (источника углерода или азота) S, максимальной удельной скорости роста μмах и субстратспецифичной константы Кs:
μ=μмахS/(Кs+S).
И S, и Кs имеют размерность г/л или моль.
Иногда вместо удельной скорости роста используют время удвоения, или время генерации td=ln2/μ. Это время, за которое в определенных условиях число клеток или биомасса удваиваются. Для одноклеточных микроорганизмов величина μмах обычно находится в диапазоне 2,1-0,086 ч-1, что соответствует времени удвоения примерно от 20 мин до 8 ч. Когда субстрат присутствует в избытке (т.е. при S>> Кs), μ= μмах и достигается максимальная скорость роста культуры в экспоненциальной фазе. Как правило, величина Кs настолько мала, что концентрация субстрата редко становится сравнимой с Кs во время экспоненциальной фазы. Например, в случае E. coli Кs для глюкозы равна примерно 1 мг/мл, а начальная концентрация глюкозы в среде обычно составляет около 10000 мг/л. Однако в конце экспоненциальной фазы субстрата остается мало, и S может стать ниже Кs (в этом случае быстро наступает фаза замедления).
Периодическая культура с добавлением субстрата – в ферментер периодически добавляют субстрат, а конечный продукт собирают только по завершении процесса. Добавление субстрата приводит к удлинению экспоненциальной и стационарной фаз и к увеличению биомассы и количества метаболитов, синтезируемых во время стационарной фазы (например, антибиотиков). Однако в стационарной фазе микроорганизмы часто синтезируют протеолитические ферменты, разрушающие все производимые ими белки. Поэтому в случае получения белка как целевого продукта, следует остановить процесс до его перехода в стационарную фазу. Периодическую ферментацию с добавлением субстрата можно использовать для культивирования не только микроорганизмов, но и клеток млекопитающих и насекомых.
При непрерывной ферментациистационарные условия обеспечиваются тем, что при постоянном объеме биореактора убыль числа клеток (удаление продукта) в точности уравновешивается их увеличением в результате деления. Чтобы получить непрерывную культуру с постоянными гидродинамическими характеристиками, нужно создать условия, при которых удельная скорость роста была бы ниже максимальной величины μмах. Для этого нужна тщательная регулировка насоса подачи, чтобы объем культуры в биореакторе поддерживался постоянным. Получение продукта в ферментере непрерывного типа дешевле, чем в периодических из-за уменьшения объема биореактора, отсутствия простоя и сохранения физиологического статуса культивируемых клеток на одинаковом уровне. Непрерывная ферментация может продолжаться 500-1000 ч, что создает проблему поддержания стерильности промышленной установки.
В таблице 5 приведены основные факторы среды, определяющие рост и биосинтетическую активность продуцентов.
Таблица 5 - Факторы среды, определяющие функционирование продуцентов (по В.Н.Голубеву и И.Н.Жиганову, 2001)
| Фактор | Роль при культивировании | Методы управления |
| Состав и кон-центрация пи-тательных ве-ществ | Обеспечивают метаболизм | Составление оптимальной композиции; подпитка во время ферментации; непре- рывность процесса; много-стадийность с учетом потреб-ностей продуцента по фазам развития и др. |
| Концентрация продукта и ингибиторов | Замедляет биохимические реакции | Осаждение продукта по мере накопления; ферментация с диализом; ферментация под разрежением с испарением летучего продукта и др. |
| рН | Оптимизирует скорости биохимических реакций (пределы рН 3,5-9,0) | Регулирование путем добавления кислоты или щелочи |
| Температура | Оптимизирует скорость биохимических реакций (20-70 ˚С) | Охлаждение или подогрев культуральной жидкости при помощи теплообменников или температуры подаваемых в биореактор субстратов |
| Осмотическое давление или активность воды | Определяет границы жизни (0,6-0,998) | Составление сред с оптимальной концентрацией питательных веществ или влажностью твердой среды; поддержание на постоянном уровне во время ферментации путем разбавления водой или добавления отдельных компонентов |
| Содержание растворенного кислорода | Для аэробов обеспечивает аэробный метаболизм; является акцептором Н+; ингибирует развитие анаэробов | Для аэробных процессов регулируют интенсивностью аэрации или добавлением к газовой смеси кислорода; при атмосферном давлении и 20 ˚С в 1 л среды растворяется 0,28 ммоль (0,008 г/л) О2. Анаэробные процессы реализуют в бескислородной среде, что достигается продуванием N2 и СО2 или добавками восстановителей (цистеина, аскорбиновой кислоты и др.) |
| Содержание диоксида углерода | Равномерное распределение питательных веществ и биомассы по всему пространству среды | Организуют макро- и микроперемешивание в биореакторах при помощи механических мешалок, барботажных, циркуляционных и других систем. Аэрация способствует перемешиванию, а пенообразование – флотации продуцента; флокуляция способствует осаждению биомассы |
| Вязкость среды | Определяет диффузию питательных веществ и перемешивание клеток продуцента | Регулирование компонентами питания, характером и концентрацией биомассы, а также наличием некоторых полимерных экстрацеллюлярных продуктов. Вязкость влияет на перемешивание и аэрацию, для чего требуются специальные технические средства |
Культуры с высокой плотностью.Считают, что при получении белков максимальный выход конечного продукта напрямую связан с плотностью культуры клеток. В ферментерах периодического действия с добавлением субстрата концентрация рекомбинантных клеток E.coli достигает 50 г сухого вещества на 1 л среды (в некоторых случаях >100 г/л). Заметим, что вес сухого вещества клеток E.coli составляет примерно 20-25% веса влажного вещества. Один из способов повышения плотности культуры состоит в регулировании культуральной среды. Известно, что избыточное введение питательных веществ, например источников углерода, тормозит рост клеток при концентрациях: глюкоза >50 г/л, аммиак >3 г/л, железо >1,15 г/л, магний >8,7 г/л, фосфор >10 г/л, цинк >0,38 г/л. В культурах с высокой плотностью может возникнуть недостаток кислорода (усилить подачу воздуха, заменить воздух на кислород или экспрессировать в клетках E.coli ген гемоглобина Vitreoscilla, обладающего большим сродством к кислороду. Высокой плотности чаще всего удается достичь при росте в периодическом режиме с добавлением субстрата. Режим подачи питательных веществ может быть непрерывным, ступенчатым или экспоненциальным.
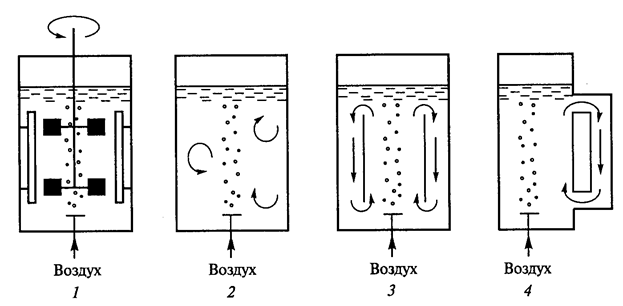
Рис. 12. Схема работы основных типов биореакторов (Т.А.Егорова и соавт., 2003): 1) биореактор с механическим перемешивающим устройством; 2) барботажный биореактор; 3) аэролифтный биореактор; 4) биореактор с вынесенной циркуляционной петлей
Биореакторыделят на три основных группы (рис.12):
- реакторы с механическим перемешиванием;
- барботажные колонны, через которые для перемешивания содержимого пропускается воздух или другой газ;
- аэролифтные (эрлифтные) реакторы с внутренней или внешней рециркуляцией; перемешивание и циркуляция культуральной среды в них обеспечивается потоком газа (обычно воздуха), за счет которого между верхним и нижним слоями культуральной среды возникает градиент плотности.
Чаще всего используются биореакторы с механическим перемешиванием, поскольку они имеют следующие преимущества:
- позволяют легко менять технологические условия;
- всегда есть в продаже;
- обеспечивают эффективную доставку газа к растущим клеткам (если говорить на инженерном языке, обладают высоким объемным коэффициента массобмена);
- имеется большой опыт их промышленного использования с соответствующей регламентационной литературой.
В реакторах с механическим перемешиванием газ (как правило, воздух) подают в культуральную среду под давлением через разбрызгиватель – кольцо с множеством маленьких отверстий либо трубку с одним отверстием. В первом случае образуются мелкие пузырьки воздуха и обеспечивается их более равномерное распределение, однако разбрызгиватели в виде трубок используются чаще, поскольку они реже закупориваются. Для равномерного распределения газа по всему объему биореактора используются мешалки – одна или несколько. Они разбивают крупные пузырьки воздуха, разносят их по всему реактору и увеличивают время пребывания в культуральной среде. Многие культуральные среды агрессивны, поэтому стенки биореакторов делают из нержавеющей стали. Стеклянные части используют только в лабораторных биореакторах емкостью менее 50 л. Размер биореактора лимитируется его способностью эффективно отдавать тепло, выделяемое микроорганизмами в ходе метаболизма и высвобождаемое в результате перемешивания. Известно, что, ассимилируя 1 кг сахара, микроорганизмы выделяют 4-6 тысяч кДж тепла.
Обеспечение стерильности, постоянства рН и температуры – ключевые требования при любом способе культивирования независимо от конструкции биореактора.
В молекулярной биотехнологии биореакторы с механическим перемешиванием используются в меньшей степени из-за грубого воздействия на клетки:
- клетки рекомбинантных микроорганизмов более хрупки, чем нетрансформированные клетки, поскольку часть их энергетических ресурсов расходуется на синтез чужеродных белков и в результате образуется менее прочная клеточная стенка;
- самый распространенный ответ клетки на внешнее воздействие – уменьшение количества синтезируемых белков, в том числе и рекомбинантных;
- под действием сдвиговых эффектов могут изменяться физические и химические свойства клеток, что затруднит дальнейшую работу с ними, например, может увеличиться количество полисахаридов на поверхности клеток (это приведет к ухудшению условий их выделения и лизиса, а также затруднит очистку рекомбинантного белка).
Рекомбинантные микроорганизмы широко используются для получения разнообразных белковых продуктов, применяющихся в медицине (например, инсулина), а также в качестве своего рода «фабрик» по производству имеющих коммерческую ценность метаболитов (например, антибиотиков). Белки синтезируются наиболее интенсивно от середины экспоненциальной фазы до ее завершения, а метаболиты – в период замедления роста и в стационарной фазе.
Выделение целевого продуктаследует за этапом ферментации.
1. Отделение клеток от культуральной жидкости после ферментации осуществляют методами скоростного центрифугирования или фильтрацией. Центрифугирование не всегда доступно из-за стоимости оборудования; метод фильтрации не всегда эффективен из-за снижения фильтрационной способности пористого материала, заполняемого клетками.
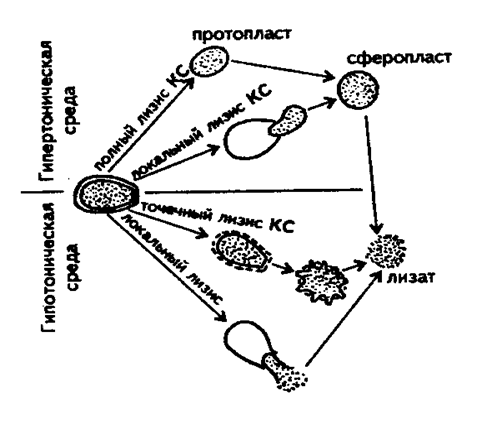
Рис. 13. Схема ферментативного лизиса дрожжевой клетки (Кислухина О.В., 2002).
2. Выделение продукта зависит от его локализации. Если продукт представляет собой белок, находящийся в культуральной среде, то среду концентрируют, а белок очищают хроматографическими или другими препаративными методами. Если продукт – это низкомолекулярное соединение, находящееся в культуральной среде, то используют соответствующие методы экстракции. Если продукт имеет внутриклеточную локализацию, то прежде чем очищать его, клетки разрушают.
3. Разрушение клеток осуществляют химическими, биологическими и физическими методами. В качестве примера приведена схема ферментативного лизиса дрожжевой клетки (рис.13). При проведении лизиса в гипертонической среде и высокой активности литических ферментов клеточная стенка может быть полностью лизирована, и из клетки образуется протопласт, принимающий затем сферическую форму. При перенесении в гипотоническую среду сферопласты мгновенно лизируются под действием осмотических сил.
Все процедуры должны быть достаточно жесткими, чтобы разрушить клеточную стенку, и в то же время достаточно мягкими, чтобы исключить денатурацию белка. В связи с разным строением клеточных стенок у разных микроорганизмов существуют разные подходы к их разрушению:
- У грамположительных бактерий клеточная стенка состоит из толстого пептидогликанового слоя N-ацетилмурамовой кислоты, соединенных пептидными мостиками.
- У грамотрицательных бактерий клеточная стенка тоньше и покрыта снаружи слоем липидов.
- Стенка дрожжевых клеток состоит из плотного слоя частично фосфорилированных маннанов и β-гликанов.
- Низшие грибы имеют многослойные клеточные стенки, состоящие из α- и β-гликанов, гликопротеинов и хитина.
Химические методы разрушения – обработка щелочью, органическими растворителями или детергентами. Все эти методы не должны отрицательно влиять на целевой белковый продукт. Основной биологический метод разрушения клеток микроорганизмов является лизис с помощью ферментов. Лизоцим яичного белка легко гидролизует клеточные стенки грамположительных бактерий, для лизиса грамотрицательных бактерий к яичному лизоциму добавляют этилендиаминотетрауксусную кислоту (ЭДТА, трилон Б). Клеточные стенки дрожжей гидролизуют с помощью одного или нескольких ферментов – β-1,3-глюканазы, β-1,6-глюканазы, манназы и хитиназы. Ферментативная обработка высокоспецифична, а лизис проходит в мягких условиях, но сдерживает их применение высокая стоимость. Дешевле клетки разрушать с помощью физических методов – осмотический шок, замораживание-оттаивание, ультразвуковая обработка. Для разрушения большого количества клеток используют шаровые мельницы. При гомогенизации под высоким давлением концентрированную клеточную суспензию продавливают через небольшое отверстие под высоким давлением, а затем давление резко сбрасывают, что вызывает лизис. В методе соударения клеточную суспензию большой вязкости направляют под давлением на неподвижную поверхность или навстречу потоку другой суспензии. В месте соприкосновения выделяется большое количество энергии, разрушающей клетки. Эффективно сочетание метода обработки лизоцимом с соударением (с уменьшением дозы и скорости струйного выброса) для сохранения нативности целевого продукта.
4. Затем следуют этапы очистки белка, а если получен нерастворимый продукт, то его солюбилизации обычными приемами препаративной биохимии.
Оценка процесса ферментацииосуществляется путем анализа ряда кинетических показателей. Практически в ферментационной среде контролируют содержание основных субстратов (обычно источник углеводов), биомассы и целевого продукта. По этим показателям вычисляют удельную скорость роста, продуктивность системы по биомассе и продукту, а также экономические коэффициенты (таблица 6).
Биотехнологические штаммы микроорганизмов.Микроорганизмы, способные синтезировать определенный продукт в количествах, превосходящих физиологические потребности (сверхсинтез), часто встречаются в природе. Некоторые из них при выделении в окружающую среду оказываются токсичными для других видов (органические кислоты, спирты, антибактериальные вещества) и служат средством защиты. Микроорганизмы с такими свойствами были первыми привлечены к хозяйственной деятельности человека. В настоящее время природные штаммы микроорганизмов используют для производства микробной биомассы (микробного белка), бактериальных азотистых удобрений, биопестицидов, пищевых продуктов. Однако большинство промышленных микроорганизмов представлено искусственно селектированными штаммами.
Таким образом, в промышленности применяют три вида штаммов: природные штаммы, улучшенные естественным или искусственным отбором; штаммы, измененные в результате индуцированных мутаций, и штаммы культур, полученные методами генной или клеточной инженерии. В таблице 7 представлены некоторые группы микроорганизмов, используемые для промышленного синтеза веществ.
Экологически чистая энергия. Биогаз.В настоящее время очевидно, что окружающая среда – воздух, земля вода – уже не могут эффективно «перерабатывать» бытовые, промышленные и сельскохозяйственные отходы. Поэтому создан ряд технологических, включая биотехнологические, подходов, с помощью которых планируется перерабатывать большие количества отходов (например, лигноцеллюлозы) и токсических веществ.
Таблица 6 – Количественные характеристики процесса ферментации

Заимствовано из монографии: В.Н.Голубев, И.Н.Жиганов Пищевая биотехнология, 2001.
Определим основные термины:
- биодеградация разрушение отходов, попавших в окружающую среду, с помощью живых микроорганизмов;
- биомасса – совокупность веществ и материалов – побочных продуктов пищевой и перерабатывающей промышленности, - которые раньше считались отходами, а теперь могут служить сырьем для производства многих важных для народного хозяйства продуктов.
Таблица 7 – Продуценты и продукты промышленного биосинтеза

(Таблица заимствована из монографии Голубева В.Н. и Жиганова И.Н., 2001).
Экологически чистую энергию можно получать путем преобразования солнечной энергии в электрическую с помощью солнечных коллекторов, использования энергии ветра, приливов, а также из биогаза и микробного этанола. По Т.А.Егоровой и соавт. (2003) биогаз – это смесь из 65% метана, 30% СО2 , 1% сероводорода и незначительных примесей азота, кислорода, водорода и угарного газа. Энергия, заключенная в 28 м3 биогаза, эквивалентна энергии: 16,8 м3 природного газа; 20,8 л нефти: 18,4 л дизельного топлива. В основе получения биогаза лежит процесс метанового «брожения». Биометаногенез – сложный микробиологический процесс, в котором органическое вещество разлагается до диоксида углерода и метана в анаэробных условиях. Микробиологическому анаэробному разложению поддаются практически все соединения природного происхождения, а также значительная часть ксенобиотиков органической природы. В анаэробном процессе биометаногенеза выделяют три последовательные стадии, в которых участвуют свыше 190 различных микроорганизмов. На первой стадии под влиянием экстрацеллюлярных ферментов ферментативному гидролизу подвергаются сложные многоуглеродные соединения – белки, липиды и полисахариды. Вместе с гидролитическими бактериями функционируют и микроорганизмы-бродильщики, которые ферментируют моносахариды, органические кислоты. На второй стадии (ацидогенез) в процессе ферментации участвуют две группы микроорганизмов: ацетогенные и гомоацетогенные. Ацетогенные Н2-продуцирующие микроорганизмы ферментируют моносахариды, спирты и органические кислоты с образованием Н2, СО2, низших жирных кислот, в основном ацетата, спиртов и некоторых других низкомолекулярных соединений. Деградация бутирата, пропионата, лактата с образованием ацетата происходит при совместном действии ацетогенных Н2-продуцирующих и Н2-утилизирующих бактерий. Гомоацетатные микроорганизмы усваивают Н2 и СО2, а также некоторые одноуглеродные соединения через стадию образования ацетил-КоА и превращения его в низкомолекулярные кислоты (в основном, в ацетат). На заключительной третьей стадии анаэробного разложения отходов образуется метан. Он может синтезироваться через стадию восстановления СО2 молекулярным водородом, а также из метильной группы ацетата. Некоторые метановые бактерии способны использовать в качестве субстрата формиат, СО2, метанол, метиламин и ароматические соединения:
4Н2 + СО2 → СН4 + 2Н2О
3Н2 +СО → СН4+ Н2О
2Н2О + 4СО → СН4 + 3СО2
4НСООН → СН4 + 3СО2 + 2Н2О
4СН3ОН → 3СН4 + СО2 + 2Н2О
СН3СООН → СН4 + СО2
Метанобразующие бактерии 90-95% углерода субстратов превращают в метан. На рисунке 14 представлена схема устройства реактора (метантенка) для обработки сельскохозяйственных отходов (навоз, остатки растениеводства).
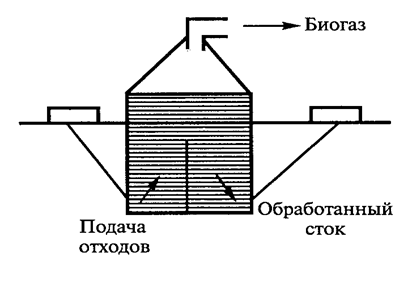
Рис. 14. Схема устройства реактора для обработки сельскохозяйственных отходов (Егорова Т.А. и соавт., 2003).
Процесс метанообразования ведется при 30-60 ºС и рН 6-8. В настоящее время для производства биогаза чаще используют вторичные отходы (отходы животноводства и сточные воды городов), чем первичные (отходы зерноводства, полеводства, пищевой, микробиологической, лесной промышленности). Использование термофильных метанобразующих бактерий позволяет вести процесс при 50-60 ºС, что обеззараживает субстрат метанообразования от патогенной микрофлоры и гельминтов. В целом анаэробная конверсия органических отходов в метан – наиболее конкурентноспособная область биоэнергетики. Основное преимущество биогаза состоит в том, что он является возобновляемым источником энергии, связанным с существованием жизни на земле.
Деградация ксенобиотиков с помощью микроорганизмов.На протяжении 20 века нарастало загрязнение окружающей среды ксенобиотиками (неприродные, синтетические химические вещества; от греч. Xenos, чужой) – гербицидами, пестицидами, хладоагентами, растворителями и т.д. Традиционные методы разрушения, сжигания или химической модификации ксенобиотиков приводили к дальнейшему загрязнению окружающей среды. Определенный позитивный сдвиг в технологиях борьбы с химическим загрязнением окружающей среды проявился в середине 60-х годов прошлого века, когда были обнаружены почвенные микроорганизмы, способные к деградации ксенобиотиков.
Основную группу почвенных микроорганизмов, разрушающих ксенобиотики, составляют бактерии рода Pseudomonas, разные штаммы которых способны расщеплять более 100 органических соединений. Нередко один штамм использует в качестве источника углерода несколько родственных соединений.
В биодеградации сложной органической молекулы обычно участвуют несколько ферментов. Кодирующие их гены входят в состав крупных (50-2000 т.п.н.) плазмид, а иногда обнаруживаются как в хромосомной, так и в плазмидной ДНК.
Бактерии, разрушающие негалогенированные ароматические соединения, как правило, превращают их в катехол или протокатехоат, а затем в ходе нескольких реакций окислительного расщепления, - в ацетил-КоА и сукцинат или в пируват и ацетальдегид. Полученные вещества легко метаболизируются всеми микроорганизмами. Галогенированные ароматические соединения (пестициды, гербициды) деградируются теми же ферментами, но скорость их превращений зависит от числа атомов галогена в исходном ксенобиотике. Дегалогенирование происходит с помощью неспецифической диоксигеназной системы микроорганизмов.
Некоторые микроорганизмы обладают природной способностью к деградации различных ксенобиотиков; следует иметь в виду, что:
- ни один из микроорганизмов не может разрушать все органические соединения;
- некоторые органические соединения в высокой концентрации подавляют рост деградирующих их микроорганизмов;
- обычное загрязнение окружающей среды многокомпонентное, когда один из компонентов может подавлять жизнедеятельность деградирующих другие соединения микроорганизмов.
Заманчиво создать штамм микроорганизмов, способный утилизировать несколько органических веществ-ксенобиотиков. Для этого используют два подхода.
1. Метод конъюгации обеспечивал перенос из клетки в клетку целых плазмид. А.М.Чакрабарти, проводивший эксперименты по переносу плазмид-разрушительниц, т.е. плазмид, кодирующих все ферменты пути биодеградации определенного соединения, сконструировал штамм, содержащий несколько таких плазмид. Кодируемые плазмидными генами ферменты каждого катаболического пути разрушали определенное органическое соединение. Взяв четыре разные бактерии, он создал один микроорганизм, содержащий плазмиды, которые обусловливали деградацию камфары, октана, салицилата, нафталина (супербацилла была запатентована спустя 11 лет в США). Большинство разрушающих ксенобиотики бактерий, модифицированных путем переноса плазмид, являются мезофильными микроорганизмами (хорошо растут при 20-40 ˚С), а температура воды в загрязненных реках, озерах и океанах лежит в диапазоне от 0 до 20 ˚С. Поэтому плазмиду TOL (детерминирует разрушение толуола) мезофильного штамма Pseudomonas putida перенесли с помощью конъюгации в психрофильный (с низким температурным оптимумом) штамм, утилизирующий салицилат при температуре, близкой к 0 ˚С. Трансформированный штамм оказался способным утилизировать салицилат и толуол в качестве источника углерода при 0 ˚С.
2. Метод модификации генов, кодирующих ферменты того или иного метаболического пути. Одним из наиболее распространенных веществ, загрязняющих почву и воду, является трихлорэтилен, широко использующийся в качестве растворителя и обезжиривающего средства. Он длительное время сохраняется в окружающей среде и относится к канцерогенам. Анаэробные почвенные бактерии способны его дегалогенировать, превращая в еще более токсичное соединение винилхлорид. Некоторые штаммы P. putida, разрушающие ароматические соединения (толуол), разрушают также и трихлорэтилен. Для разрушения трихлорэтилена из набора ферментов деградации толуола требуется лишь толуолдиоксигеназа. Гены толуолдиоксигеназы ввели в E. coli и получили штамм, способный превращать трихлорэтилен до безвредных продуктов.
Утилизация целлюлозыявляется важным биотехнологическим процессом, поскольку каркас почти всех наземных растений состоит из полимеров: лигнина, гемицеллюлозы и целлюлозы. Объединяясь в разных пропорциях, они образуют лигноцеллюлозный материал, на долю которого приходится основная часть биомассы, остающейся в огромном количестве в виде отходов сельского хозяйства, деревообрабатывающей промышленности и других отраслей народного хозяйства.
Лигнин – глобулярный нерегулярный нерастворимый полимер (мол. масса >10000), состоящий из остатков фенилпропана. Лигнин обусловливает ригидность растений, их устойчивость механическим и микробным повреждениям. Гемицеллюлозы – это короткоцепочечные гетерогенные полимеры, состоящие из гексозных и пентозных единиц. Все гемицеллюлозы делят на три типа: 1) ксиланы, остов которых состоит из молекул поли-β-1,4-ксилана с присоединенными к ним арабинозой, глюкуроновой и арабиноглюкуроновыми кислотами; 2) маннаны, состоящие из глюкоманнанов и галактоманнанов; 3) арабиногалактаны. Целлюлоза состоит из длинных цепей, состоящих из остатков D-глюкозы, соединенных β-1,4-гликозидными связями.
Лигноцеллюлозные материалы делят на три класса:
- сами растения, специально выращиваемые для получения целлюлозы, строительных материалов или корма для скота (хлопок, древесина, сено);
- растительные отходы, остающиеся после сбора и переработки урожая и после обработки древесины (солома, рисовая шелуха, древесная щепа и др.);
- бытовые отходы (использованные бумага, картон и др.).
Многие бактерии и грибы способны расщеплять целлюлозу благодаря совместному действию нескольких ферментов, называемых целлюлазами (эндоглюканаза, экзоглюканаза, целлобиогидролаза, целлобиаза). Расщепление целлюлозы с помощью целлюлолитических микроорганизмов происходит медленно и часто не до конца. Предприняты попытки создать с помощью генной инженерии микроорганизмы, обладающие более высокой целлюлазной активностью. Для этого выделяли про- и эукариотические гены, кодирующие отдельные ферменты целлюлазного комплекса. Так называемые целлюлазные гены экспрессируют в E. coli или других микроорганизмах для получения этанола из целлюлозы. Для этого бумажные отходы частично расщепляют целлюлазами и затем проводят ферментацию высвободившейся глюкозы с помощью S. cerevisiae. Этот подход позволит получить 400 л этанола из 1 т бумажных отходов. В США за год образуется 100 млн. т бумажных отходов и при такой переработке их можно получить топливный этанол, эквивалентный 16% расходуемого бензина. Введение целлюлазных генов в винные дрожжи позволяет усилить аромат вина.
Питание сельскохозяйственных животных. Получение силоса.Для хранения растительных кормов в течение многих месяцев используют молочнокислые бактерии (растительный материал служит субстратом при синтезе молочной и уксусной кислот). Эти кислоты подавляют рост других микроорганизмов, способствуя сохранению кормовой растительной массы (силоса). Если молочнокислые бактерии присутствуют на свежем растительном материале в небольшом количестве, нужно добавить бактериальный посевной материал (обычно Lactobacillus plantarum). Оптимально растительное сырье, содержащее достаточное количество водорастворимых углеводов.
Для создания бактерии, способной осуществлять эффективную ферментацию растительного материала, встроили ген α-амилазы «не силосного» штамма L. аmylovorus в хромосомный ген конъюгированной гидролазы желчных кислот одного из штаммов L. рlantarum. Этот ген кодирует фермент, который активируется при попадании бактерии в кишечник животного и, следовательно, не нужен при образовании силоса. Предполагается создание штаммов L. рlantarum, способствующих более эффективному образованию силоса из сельскохозяйственных культур, содержащих много крахмала (люцерна).
Некоторые виды биомассы (например, сыворотка, целлюлозные отходы) и продукты переработки нефти могут служить субстратом при культивировании микроорганизмов. Предполагалось, что эти чистые культуры, а также их продукты (белок одноклеточных организмов, БОО) можно будет использовать в качестве пищевых добавок или корма для скота. К сожалению, вследствие дороговизны получаемых продуктов, их невысоких вкусовых качеств, а иногда и токсичности производство БОО оказалось экономически нецелесообразным. Технологичность этого процесса может быть оптимизирована путем введения генетически модифицированных микроорганизмов применительно к виду перерабатываемых отходов.
Разработан новый подход, с помощью которого можно будет обеспечивать крупный рогатый скот белком, обогащенным незаменимыми аминокислотами. Простое добавление белков в корм – дорогостоящий и не эффективный способ, поскольку белки и аминокислоты разрушаются бактериями рубца еще до того, как животное успеет их использовать. Кроме того, основное количество белка они получают не с кормом; его поставляют присутствующие в рубце микроорганизмы. Рацион животных можно обогатить, если направленно модифицировать эти бактерии. Для этого был синтезирован белок из 100 аминокислот, 57 из которых незаменимые. По программе белка синтезировали ген и экспрессировали его в E. coli. Если бактерии окажутся способными продуцировать такой белок в рубце животных, будет создан способ непрерывного обеспечения их незаменимыми аминокислотами.
Получение ферментативных препаратов.Технология ферментных препаратов микробного происхождения более сложная, так как дополнительно включает этапы культивирования микроорганизмов-продуцентов ферментов. Выделение и очистка фермента как из культуры микроорганизма (выращенного любым способом), так из других природных источников трудоемкая и многоэтапная процедура. Поэтому, если фермент может использоваться в виде неочищенного препарата, его не очищают. В промышленности широко применяют коммерческие препараты ферментов, чистота которых составляет всего 0,1% (99,9% - примеси). К таким отраслям относятся спиртовая, кожевенная, текстильная промышленность, а также сельское хозяйство. В большинстве отраслей пищевой промышленности, в медицине, фармации требуются высокоочищенные ферменты. На рисунке 15 представлена схема получения ферментных препаратов из культур микроорганизмов. В производственных условиях активность получаемого ферментного препарата оценивают количеством субстрата, преобразованного 1 мг (1 кг) препарата при оптимальных условиях за 1 мин, и измеряют в Е/мг, моль/мг или катал/кг белка.
Схема очистки включает отделение клеток микроорганизма по выходе их из ферментера от культуральной жидкости посредством центрифугирования и последующее разрушение клеток в гомогенизаторе высокого давления. Для освобождения белков от нуклеиновых кислот полученный гомогенат обрабатывают сульфатом марганца до конечной концентрации этой соли в смеси, равной 0,05 М. Осадок нуклеиновых кислот отделяется с помощью ротационной вакуум-фильтрации, а в образовавшийся фильтрат добавляют сульфат аммония до 45% от его насыщения. Возникший осадок белков, содержащий бета-галактозидазу, собирают с помощью центрифугирования или вакуум-фильтрации. Вся процедура очистки фермента от начала подачи бактерий в систему до момента получения осадка бета-галактозидазы занимает всего 60 мин.
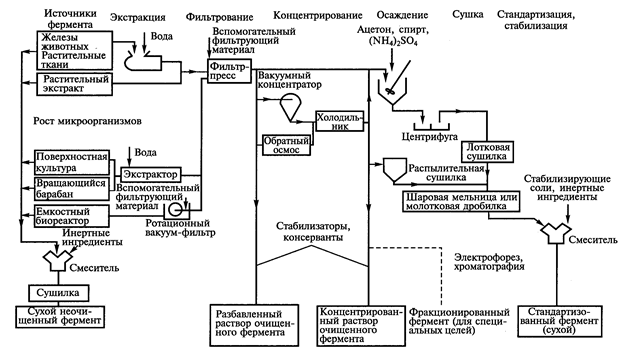
Рис. 15. Схема получения ферментных препаратов из культур микроорганизмов (Егорова Т.А. и соавт., 2003).
На рисунке 16 представлено получение частично очищенного препарата бета-галактозидазы из мутанта E.coli.
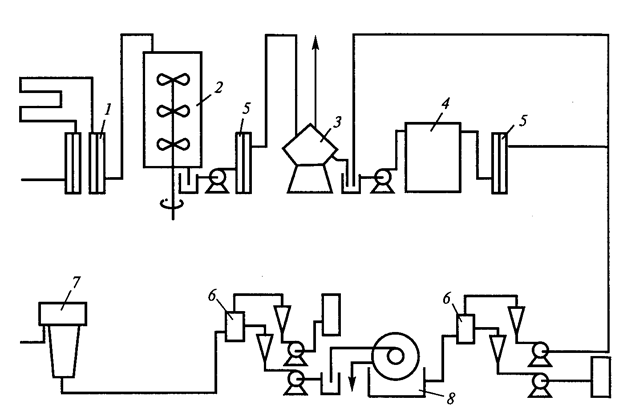
Рис. 16. Технологическая схема непрерывного получения бета-галактозидазы (Егорова Т.А. и соавт., 2003): 1 – стерилизатор среды; 2 – ферментер; 3,7 – центрифуги; 4 – гомогенизатор; 5 – теплообменник; 6 – смесительные камеры; 8 – ротационный вакуум-фильтр.
Технологии рекомбинантных ДНК наиболее успешно используются для направленной модификации микробиологических систем, используемых для получения «коммерческих» продуктов». Такие микробиологические системы производят белковые препараты, различные низкомолекулярные биорегуляторы и биополимеры.
Ранее были созданы рекомбинантные микроорганизмы, способные синтезировать L-аскорбиновую кислоту (одно из первых исследований 1985 года), краситель индиго, аминокислоты, антибиотики, мономерные единицы различных биополимеров. Этот подход может превратить бактерии не только в «фабрики» по производству белков с заданными свойствами, но и низкомолекулярных веществ с необычными (не токсичными для данного микроорганизма-производителя) свойствами. Например, весьма востребован каучук, получаемый из особых растений. Его биосинтез начинается с превращения простых сахаров и включает 17 ферментативных реакций. В ходе последней из них происходит полимеризация аллилпирофосфатных остатков с образованием цис-1,4-полиизопрена. Для получения рекомбинантных микроорганизмов, производящих каучук было проведено:
1) с помощью мРНК из растения Hevea brasiliensis, синтезирующего каучук, была создана библиотека кДНК;
2) произведена гибридизация ДНК-зондом, соответствующим по нуклеотидной последовательности гену полимеразы каучука;
3) полученный клон кДНК (или несколько клонов, кодирующих несколько ферментов пути синтеза каучука) можно ввести в бактериальные клетки;
4) продуктом экспрессии таких рекомбинантных клеток будет биополимер - каучук.
Вариантом использования кДНК, кодирующей ферменты синтеза каучука, может быть ферментативная биосинтетическая технология in vitro.
Молекулярная биотехнология и питание.Человечество на протяжении тысячелетий применяет микробиологические процессы при изготовлении продуктов питания:
- за 1000 лет до н.э. технологии пивоварения, виноделия, хлебопечения приобрели черты, которые сохранились по сегодняшний день;
- за несколько столетий до н.э. среди жителей Европы и Азии распространились технологии сыроварения;
- микроорганизмы использовали народы Древнего Востока, подвергая крахмалосодержащие продукты воздействию микроскопических грибов;
- аборигены Мексики издавна заворачивают мясо перед варкой или жарением в листья дынного дерева (под воздействием протеолитического фермента папаина мясо становится более мягким).
Получение пищевого белка.При умеренной физической нагрузке взрослому человеку необходимо с пищей ежедневно получать по 3000 кал (12,5 кДж). Кроме энергетической ценности пищи важное значение имеет ее биологическая ценность, которая определяется:
- наличием незаменимых аминокислот в пищевых белках (в растительных белках отсутствует триптофан), в сутки из 100 г потребленного белка 50 г должно приходиться на белки животного происхождения;
- наличием полиненасыщенных жирных кислот в пищевых маслах (в организме человека синтезируются только жирные кислоты с одной двойной связью, в связи с этим линолевая и линоленовая жирные кислоты являются незаменимыми компонентами пищи); в сутки из 100 г масел, 25 г должно приходиться на растительные жидкие масла;
- наличием клетчатки (из 400 г углеводов 30 г должно приходиться на клетчатку, которая необходима для перистальтики кишечника);
- наличием витаминов и макро- и микроэлементов.
К настоящему времени по самым скромным подсчетам на нашей планете существует дефицит пищевого белка примерно 15 млн. т в год. По данным А.С.Рогова и И.А.Дубровина (Московский государственный университет прикладных биотехнологий) в начале 21 века производство мяса и мясопродуктов в России на душу населения снизилось до 27 кг, а потребление на душу население уже в 1,9 раза ниже научно обоснованных норм (78 кг). Одним из источников пищевого белка может стать биотехнологическая переработка вегетативных тел высших грибов, а также биомассы микромицетов и водорослей.
Схема биоконверсии растительного сырья в кормовые и пищевые продукты(по Кислухиной О.В., 2002). Процессы биоконверсии осуществляются по различным биотехнологическим схемам (рис. 17).
В процессах биоконверсии используют необработанное растительное сырье («прямая» биоконверсия), или сырье, подвергнутое предварительной обработке механическими, химическими, электрохимическими, радиационными методами, а также с помощью ферментных препаратов. Прямая биоконверсия целесообразна при переработке жидких субстратов с достаточно высоким содержанием легкоусвояемых соединений углерода и азота. При переработке твердых субстратов прямую биоконверсию применяют при наличии микроорганизмов с мощными ферментативными системами, способными воздействовать на биополимеры сырья, прежде всего, на структурные биополимеры.
Микробиологическую биоконверсию растительного сырья осуществляют путем глубинной, твердофазной или ферментации смешанного типа. Выбор способа культивирования зависит от вида сырья и физиологических особенностей микроорганизма, используемого при биоконверсии. Двухступенчатую ферментацию смешанного типа применяют при необходимости двухстадийной биоконверсии сырья различными штаммами микроорганизмов. Такая ферментация проводится, например, при биологической детоксикации кормов с высоким содержанием афлатоксинов.
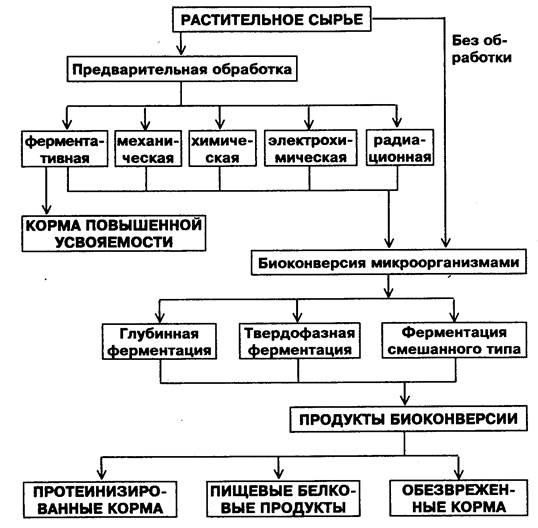
Рис. 17. Схема биоконверсии растительного сырья.
Среди продуктов биоконверсии растительного сырья можно выделить следующие группы: корма с повышенным содержанием легкоусвояемых веществ, протеинизированные корма (корма с повышенным содержанием белка), белковые пищевые продукты и обезвреженные корма.
Высшие грибы.Одним из направлений современной биотехнологии является искусственное выращивание грибов: шампиньон двуспоровый (Agaricus bisporum), вешенка (Pleurotus ostreatus), шиитаке (Lentinus edodes).
Вегетативное тело высших грибов (мицелий, грибница) по своим вкусовым и питательным свойствам аналогично плодовым телам гриба. К сожалению, выращивание мицелия высших грибов оказалось весьма трудным делом: необходима питательная среда сложного состава, включающая пектины, пептиды, аминокислоты (аргинин, глутамат, аспарагин, метионин и др.), витамины (биотин, фолиевую кислоту, рибофлавин и др.), сахара, комплекс минеральных элементов. Кроме того, чтобы мицелий имел пищевую ценность и свойства грибного деликатеса, он должен иметь вкус и аромат грибов.
Съедобные грибы являются строго сапрофитными организмами. В ходе эволюции грибы сформировали сложные симбиотические взаимоотношения с другими обитателями почвы – микроорганизмами и растениями. С середины 50-х годов 20 века были начаты эксперименты по выращиванию мицелия высших грибов в биореакторе подобно тому, как удалось в индустриальных условиях выращивать мицелий микромицетов.
Установлено, что аромат и вкус каждого вида обусловлен особым комплексом ароматических веществ, которые грибы в естественных условиях получают либо в чистом виде, либо в виде предшественников из окружающей среды (гумуса почвы), или при помощи симбионтов. Ароматизация мицелия и придание ему высоких вкусовых свойств оказалось трудной задачей. Еще не установлены все вещества, определяющие органолептические свойства грибов, поэтому ароматизацию мицелия грибов осуществляют эмпирически, путем добавления в питательный субстрат экстрактов корней деревьев, молока, ферментативных лизатов дрожжей, отвара тыквы, экстрактов пшеничных ростков, сафлорового масла, высших спиртов и др.
Питательную ценность имеет только мицелий истинных съедобных грибов – макромицетов (белый гриб, лисички и др.), в составе которых отсутствуют токсичные вещества. Мицелий условно съедобных грибов (сморчки, строчки, рыжики и др.), плодовые тела которых перед употреблением следует тщательно варить, для пищевых или кормовых целей непригоден.
Несмотря на существенные трудности, эксперименты по выращиванию макромицетов в биореакторе продолжаются. Так, например, удалось вырастить мицелий трутовика (Polyporus squamosus) на мелассной среде и за сутки культивирования получить в пересчете на сухой вес 18-20 г мицелия на 1 л среды. Предполагают, что выращивание мицелия макромицетов может решить проблему белка в масштабах всей планеты.
Микромицеты в питании человека.Мицелий микромицетов давно используется в питании человека. В пище жителей Азии и Дальнего Востока преобладает крахмал и не хватает белков. Для обогащения крахмалсодержащих продуктов белками и придания им вкуса мяса в этих странах с давних времен на растительных продуктах выращивают специально подобранные и естественным путем селекционированные виды плесневых грибов:
- продукт «темпе» индонезийской кухни – это арахисовые или соевые лепешки, обросшие плесневыми грибами рода Rhisopus (содержит 40% белка и по вкусу напоминает мясо);
- продукт «нате» японской кухни получают из соевых бобов, обросших плесневым грибом Aspergillus oryzae (характерен своеобразный острый вкус);
- продукт «суфу» (красный творог) китайской кухни получают из соевых бобов и некоторых видов плесневых грибов рода Mucor;
- соевый соус восточной кухни готовят с использованием особых штаммов плесневого гриба Aspergillus oryzae, бактерий Pedicoccus soyae, дрожжей Saccharomyces rouxii, и некоторых видов дрожжей рода Torulopsis.
Микромицеты могут использоваться в качестве источника пищевого белка в промышленности и в домашних условиях.
Съедобные водоросли.Водоросли являются продуктом питания народов побережий:
- жители Гавайских островов из 115 видов водорослей, обитающих в окружающем океане, используют в питании 60 видов;
- в Китае ценятся сине-зеленые водоросли Nostoc pruniforme, по внешнему виду напоминающие сливу;
- в кулинарных справочниках Японии водоросли упоминаются в 300 рецептурах.
Естественные запасы водорослей истощаются., в связи с чем в биотехнологии бурно развивается новая отрасль – выращивание аквакультур.
В последнее время специалистов, занимающихся вопросами питания, привлекает синезеленая водоросль спирулина (Spirulina plantensis и Spirulina maxima), растущая в Африке (озеро Чад) и в Мексике (озеро Тескоко). Для местных жителей спирулина является одним из основных продуктов питания, так как содержит много белка, витаминов (особенно группы В). Биомасса спирулины приравнивается к лучшим стандартам пищевого белка. Спирулину культивируют в открытых прудах (например, в Сочи) или в замкнутых системах из полиэтиленовых труб. В процессе культивирования удается собирать до 20 г биомассы в пересчете на сухое вещество с 1 м3 в сутки.
Дрожжи. Биомассу дрожжей, как источник пищевого белка, используют в экстремальных условиях (голод, сухие пайки путешественников), т.к. дрожжи обладают толстой клеточной оболочкой. В биотехнологии используют выращивание богатой белками биомассы хлебопекарных дрожжей S. cerevisiae на простых синтетических средах (например, на этиловом спирте, в качестве стимуляторов роста предложено использовать гуминовые кислоты торфа). Разработаны способы выделения из дрожжевой биомассы очищенных белковых концентратов. При выращивании хлебопекарных дрожжей на синтетической этанольной среде в лабораторном ферментере при непрерывном режиме с добавкой 0,5% дрожжевого экстракта достигнута концентрация биомассы в пересчете на сухой вес 8-9 г/л использованного субстрата. Вместо дрожжевого экстракта можно применять кукурузный экстракт или депротеинизированный сок картофеля. Разработаны технологии обогащения продуктов питания очищенными белковыми концентратами дрожжей.
Получение аминокислот. Посодержанию лизина наименее сбалансированы белки злаковых культур, у которых его дефицит составляет от 20 до 50%. В странах СНГ недостаток лизина в кормах не может быть восполнен за счет сои, поэтому производство этой аминокислоты было организовано первым. В клетках микроорганизмов лизин синтезируется из аспарагиновой кислоты и служит конечным продуктом разветвленного метаболического пути биосинтеза, общего для трех аминокислот – лизина, метионина и треонина. Образование лизина в клетке бактерии находится под строгим метаболическим контролем. У типичных продуцентов L-лизина – Brevibacterium flavum, и Corynebacterium glutamicum – фермент аспартаткиназа, открывающий метаболический путь, является аллостерическим белком, способным ингибироваться треонином и метионином. Чтобыдобиться образования лизина в больших количествах, получают мутанты, которые способны синтезировать лизин в присутствии ингибирующих концентраций треонина и метионина.
Для выхода синтезированного лизина из микробных клеток используют изменение проницаемости клеточных мембран. Для этого применяют специальные мутантные штаммы микробов. Но чаще проницаемость мембраны увеличивают путем изменения состава питательной среды: в культуральной среде создают дефицит биотина (1-5 мкг/л), добавляют пенициллин (2-4 мкг/л), детергенты (твин-40 и твин-60) или производные высших жирных кислот (пальмитаты, стеараты). Биотин контролирует содержание в клеточной мембране ряда фосфолипидов, пенициллин нарушает биосинтез биополимеров клеточных стенок бактерий, что повышает выделение аминокислот в среду. Технологическая схема получения препаратов лизина из свекловичной мелассы представлена на рисунке 18.
Производство лимитирующих аминокислот представляет собой крупнотоннажную специализированную отрасль. Ежегодно в мире производится более 800000 т аминокислот стоимостью более 5 млрд. долларов. Более 98% производства приходится на глютаминовую кислоту, метионин, лизин и триптофан. Основными способами получения аминокислот являются методы микробиологического (лизин, треонин, валин) и химического (метионин, триптофан, фенилаланин) синтеза. Часть дефицитных аминокислот получают с помощью ферментативных методов (метионин), экстракцией (цистин, тирозин) и генной инженерии (лизин, треонин). В Московской государственной академии тонкой химической технологии им. М.В.Ломоносова предложена технология получения глутамата натрия из отходов пивоваренного производства, используемых в качестве субстрата для промышленных штаммов C. glutamicum и B. flavum (создана модель безотходного производства).

Рис. 18. Технологическая схема получения кормовых препаратов лизина (Егорова Т.А. и соавт., 2003): 1 – подача свекловичной мелассы; 2 – водная суспензия кукурузного экстракта и питательных солей; 3 – нагревательная колонка; 4, 5 – теплообменники; 6 – посевные аппараты; 7 – подача посевного материала; 8 – система фильтров для очистки и стерилизации воздуха; 9 – ферментер; 10 – фильтры для очистки отходящих газов; 11 – получение монохлоргидрата лизина; 12 – подача соляной кислоты; 13, 14 – выход и подогрев монохлоргидрата лизина; 15 – выпаривательная установка; 16 – сборник жидкого концентрата лизина; 17 – смешивание жидкого концентрата лизина с наполнителем; 18 – распылитель; 19 – подача горячего воздуха; 20 – очиститель воздуха; 21 – отделение сухого препарата лизина от воздуха; приемник кормового концентрата лизина.
Получены положительные результаты в увеличении выхода триптофана, синтезированного C. glutamicum. Для этого в клетки C. glutamicum дикого типа была введена вторая копия гена, кодирующего антранилатсинтазу, фермент, лимитирующий синтез триптофана.
Следует помнить, что применение аминокислот должно строго контролироваться, поскольку возможны негативные эффекты их применения с образованием токсичных продуктов дезаминирования триптофана, тирозина, гистидина.
БВК – микробиологический белок для кормления животных. В странах СНГ свыше 1 млн. т/год, т.е. 60% продукции, выпускалось на основе парафинов нефти, а 40% - на основе гидролизатов древесины. Организация производства белка осуществлялась и с использованием спирта и природного газа. Разработана технология с использованием в качестве сырья зерно-мукомольных отходов, их последующего гидролиза и выращивания на этой питательной среде кормового микробиологического белка с помощью специально подобранных высокоэффективных штаммов микроорганизмов. В результате получается биомасса, содержащая 45-55% протеина в готовом продукте (ФГУП ГосНИИсинтезбелок).
Разработана аналогичная технология с использованием шрота хлопчатника. Такие технологические процессы экономически выгодны при отсутствии соевого белка для кормления животных. По содержанию незаменимых аминокислот и витаминов дрожжевая масса не уступает, а иногда превосходит соевые белки. Добавка БВК в корма экономит фуражное зерно (5 т на 1 т БВК) и увеличивает привесы животных.
Новые формы белковой пищи –это продукты питания, полученные на основе различных белковых фракций продовольственного сырья с применением научно обоснованных способов переработки и имеющие определенный химический состав, структуру и свойства, включая биологическую ценность. Традиционными источниками для производства белковых продуктов являются соя и пшеница. Если вспомнить историю, то в России были времена так называемого «царя гороха», т.е. времена, когда на столе русских царствовал горох – представитель семейства бобовых, к которым относится и соя. В начале 21 века на Украине произведено около 55 тыс. т. сои. Показано, что потребление 25 г соевого белка в день на 30% снижает риск возникновения сердечно-сосудистых заболеваний. Соевые белки содержат меньше метионина, цистеина и лизина, чем животные, но они не обладают гиперлипидемическим действием. Продукты из соевых белков подразделяются на три группы, отличающиеся по содержанию белка: мука-крупа, концентраты и изоляты. Соевая мука и крупа производятся на мельничном оборудовании путем измельчения до определенного размера частиц обезжиренных или необезжиренных семян с последующим их просеиванием. В муке и крупе содержится 40-54% (N×6,25) белка от общей массы продукта. Соевые белковые концентраты изготавливаются из очищенных и обезжиренных соевых бобов (белых лепестков) путем удаления растворимых в воде небелковых компонентов (олигосахаридов, минеральных веществ, органических кислот). Концентраты содержат 65-70% белка на сухое вещество. Соевые белки изоляты являются наиболее очищенной формой белковых продуктов, т.к. содержат не менее 90% белка на сухое вещество.
Назначение текстурированных белковых продуктов заключается в придании пищевым изделиям волокнистой или многослойной (кускообразной) структуры. После гидратации такие белковые продукты по внешнему виду и структуре напоминают мясо, птицу или морские продукты, выступая при этом в роли аналогов традиционных пищевых продуктов. Многослойная мясоподобная структура соевых белковых продуктов может формироваться с помощью термопластической экструзии. Основные стадии процесса включают: дозирование сырья → кондиционирование (увлажнение, нагревание) → формирование волокон → разрезание продукта на куски → сушка. В основе экструзии лежит процесс реструктуризации белка, заключающийся в том, что под влиянием температуры, увлажнения и механического воздействия макромолекулы его формируют вязкопластическую массу, выстраивающуюся в направлении сдвига, с образованием новых поперечных связей. В результате образуется многослойная объемная жевательная структура, пригодная для использования в качестве наполнителей или аналогов.
Модифицированные белки (частично или полностью гидролизованные) получают из белковых продуктов с применением протеолитических ферментных препаратов или кислотного гидролиза. Такие белки используются как функциональные и вкусовые добавки к пище.
Ферментные препаратыв отличие от ферментов содержат помимо активного фермента множество балластных веществ, в том числе и других белков. В пищевой промышленности используются ферментные препараты из гепатопанкреаса гидробионотов (например, камчатского краба), содержащие коллагеназу. Обработка таким препаратом мяса за счет гидролиза коллагена уменьшает напряжение среза на 20% и работу резания на 50%. Кроме того, большинство ферментных препаратов являются комплексными, т.е. кроме основного фермента, содержащего наибольшую активность, в его состав входят другие сопутствующие ферменты. Однако существуют препараты и индивидуальных ферментов. Название ферментного препарата включает название основного фермента и название микроорганизма-продуцента, с окончанием «-ин». Например: амилоризин – основной фермент – амилаза, продуцент Aspergillus oryzae; протосубтилин – основной фермент – протеаза, продуцент Bacillus subtilis. Помимо этого, в названии обязательно отражается способ культивирования микроорганизма: Г – глубинное, П – поверхностное, а также степень очистки – Х (2Х, 3Х, 10Х, 15Х, 20Х).
Ферментные препараты должны проходить тщательный химический, микробиологический и токсикологический контроль для обеспечения их безопасного применения. Особое место занимают ферментные препараты, получаемые из генетически модифицированных микроорганизмов. Основными ферментными препаратами, полученными методами генетической инженерии и разрешенными к применению в пищевой промышленности, являются α-амилаза из B. stearothermophilys, экспрессированная в B. subtilis; α-амилаза из B. megaterium, экспрессированная в B. subtilis; химозин А, полученный из штамма E. coli К-12, содержащего ген телячьего прохимозина А.
Обогащение белков лимитирующими аминокислотами.
Зависимость функционирования организма от количества незаменимых аминокислот используется при определении биологической ценности белков химическими методами. Наиболее широко используется метод Х.Митчела и Р.Блока, в соответствии с которым рассчитывается показатель аминокислотного скора (а.с.).
Таблица 8 - Рекомендуемые составы и суточная потребность человека в незаменимых аминокислотах, мг/г белка (по А.П.Нечаеву, 2003)
| Наименование Аминокислоты | ФАО/ВОЗ, 1985 г. | ФАО/ВОЗ, 1973 г., взрослые | Мг/кг массы тела | ||
| Дети, 2-5 лет | Дети, 10-12 лет | Подростки | |||
| Изолейцин | |||||
| Лейцин | |||||
| Лизин | |||||
| Метионин+цистин | |||||
| Фенилаланин+тирозин | |||||
| Треонин | |||||
| Валин | |||||
| Триптофан | 3,5 |
Аминокислота, скор которой имеет самое низкое значение, называется первой лимитирующей аминокислотой. Значение скора этой аминокислоты определяет биологическую ценность и степень усвоения белков.
Скор выражают в процентах или безразмерной величиной, представляющей собой отношение содержания незаменимой аминокислоты (а.к.) в исследуемом белке к ее количеству в эталонном белке:
Аминокислотный скор = (мг а.к. в 1 г белка/мг а.к. в 1 г эталона)×100
Аминокислотный состав эталонного белка сбалансирован и идеально соответствует потребностям организма человека в каждой незаменимой аминокислоте, поэтому его называют «идеальным» (таблица 8).
Для учета всех незаменимых аминокислот определяют индекс незаменимых аминокислот(ИНАК), который представляет собой корень в степени, равной количеству анализируемых аминокислот (если все, то 8) из произведений отношений содержания каждой незаменимой аминокислоты в исследуемом белке к содержанию ее в эталонном белке.
Помимо химических методов используют также биологические методы (животные, микроорганизмы). Основными показателями оценки при этом являются привес (рост животных) за определенный период времени, расход белка и энергии на единицу привеса, коэффициенты перевариваемости и отложения азота в теле, доступность аминокислот. Показатель, определяемый отношением привеса животных (в г) к количеству потребляемого белка (в г) был разработан П.Осборном и носит название коэффициент эффективности белка(КЭБ). Для сравнения при определении
– Конец работы –
Эта тема принадлежит разделу:
ОСНОВЫ БИОТЕХНОЛОГИИ
ОСНОВЫ БИОТЕХНОЛОГИИ... Витебск Министерство образования Республики Беларусь...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Биотехнологические основы культивирования микроорганизмов.
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов