рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Промышленность
- /
- Современное состояние энергопотребления в производствах аммиака и метанола
Реферат Курсовая Конспект
Современное состояние энергопотребления в производствах аммиака и метанола
Современное состояние энергопотребления в производствах аммиака и метанола - раздел Промышленность, Содержание Список Основных Условных Обозначений……………...
СОДЕРЖАНИЕ
Список основных условных обозначений……………………………………..5
Введение…………………………………………………………………………8
Глава 1. АНАЛИТИЧЕСКИЙ ОБЗОР И ЗАДАЧИ ИССЛЕДОВАНИЯ……12
1.1. Современное состояние энергопотребления в производствах аммиака
и метанола ………………………………………………………………...12
1.2. Пути снижения энергопотребления производств аммиака.…………….19
1.3. Анализ вариантов реализации комплексного производства аммиака,
метанола и энергоносителей.……………………..……………………....22
1.4. Основы математического моделирования теплоэнерготехнологических
комплексов…………………………....……………………………………28
1.5. Опыт моделирования энерготехнологических производств аммиака
и метанола……………………………………………………………..….32
Выводы по главе………………………………………………………………..34
Глава 2. МЕТОДИЧЕСКИЕ НАУЧНЫЕ ОСНОВЫ ПОСТРОЕНИЯ МАТЕМАТИЧЕСКОЙ МОДЕЛИ ТЕПЛОЭНЕРГОТЕХНОЛОГИЧЕСКОГО КОМПЛЕКСА…………………………………………………..………………….….36
2.1. Определение цели моделирования. Разработка концептуальной
модели …………………………………………………………………….36
2.2. Декомпозиция и детализация объекта исследования.……………..…....38
2.3. Математическое описание свойств веществ и их смесей.……………...42
2.4. Моделирование тепловых и физико-химических процессов ……...…...45
2.4.1. Моделирование химических реакций, протекающих в
теплоэнерготехнологическом комплексе ………….………………….45
2.4.2. Моделирование процессов конденсации……………………...……….49
2.4.3. Моделирование процессов теплообмена……………...……………….53
2.4.4. Моделирование процессов теплообмена, протекающих при синтезе
метанола ………………………………..………..……...……………….59
2.5. Моделирование тепловых и материальных балансов.…………….……64
2.5.1. Тепловые и материальные балансы стадии переработки
природного газа…………………………………………..…….……….64
2.5.2. Баланс производства и потребления пара высокого
давления……………………………………………………………...….66
2.5.3. Тепловые и материальные балансы производства основных
продуктов………………………………………………………...………67
2.6. Моделирование схем с рециркулирующими потоками…………………69
2.7. Описание экономической модели теплоэнерготехнологического
комплекса……………………………………………………………….…72
Выводы по главе………………………………………………………………..74
Глава 3. АЛГОРИТМ МОДЕЛИРОВАНИЯ ТЕПЛОЭНЕРГОТЕХНОЛОГИЧЕСКОГО КОМПЛЕКСА И ЕГО РЕАЛИЗАЦИЯ НА ЭВМ…………..…….76
3.1. Алгоритмы моделирования блока переработки природного
газа..…………………….………………………………………………....76
3.2. Алгоритмы моделирования блока выработки пара высокого
давления …………………..………….…………………………………...83
3.3. Алгоритмы моделирования блока синтеза аммиака.…………… ……..86
3.4. Алгоритмы моделирования блока производства метанола …………...89
3.5. Алгоритм расчета теплообменного оборудования………………....…...98
3.6. Реализация алгоритмов моделирования на ЭВМ.……………..…...….100
Выводы по главе………………………………………………………………101
Глава 4. ТЕХНИЧЕСКИЕ РЕШЕНИЯ ПО СНИЖЕНИЮ ЭНЕРГОПОТРЕБЛЕНИЯ КОМПЛЕКСНОГО ПРОИЗВОДСТВА. МОДЕЛИРОВАНИЕ ТЕПЛОЭНЕРГОТЕХНОЛОГИЧЕСКОГО КОМПЛЕКСА И АНАЛИЗ РЕЗУЛЬТАТОВ.……………………………….…………………………………………103
4.1. Технические решения по снижению энергопотребления комплексного
производства ……………………………………………………......…..103
4.1.1. Организация выработки и потребления пара среднего давления.…..103
4.1.2. Организация выработки и потребления пара низкого давления …...105
4.1.3. Дозирование кислорода в комплексное производство……………....107
4.2. Основные результаты моделирования теплоэнерготехнологического
комплекса.……………………………………………………...….……...109
4.3. Оценка корректности разработанной математической модели………112
4.4. Моделирование режимов работы теплоэнерготехнологического
комплекса………………………………………………………..……….113
4.4.1. Режимы нагрузки теплоэнерготехнологического комплекса ………114
4.4.2. Баланс комплексного производства по пару……………………...….118
4.4.3. Снижение расхода энергоресурсов при подаче кислорода ………....121
Выводы по главе………………………………………………………………126
Заключение…………………………………………………………………….128
Список использованной литературы………………………………………...131
Приложение I. Перечень исходных данных для модели теплоэнерготехнологического комплекса совместного производства аммиака, метанола и энергоносителей. Перечень основных расчетных результатов моделирования……………………………………………………………………………….139
Приложение II. Схемы тепловых и материальных балансов комплексного производства……………………………………………………………………143
Приложение III. Математический аппарат для описания свойств веществ и некоторых физико-химических процессов ……………………………..……147
СПИСОК ОСНОВНЫХ УСЛОВНЫХ ОБОЗНАЧЕНИЙ
a - коэффициент теплоотдачи;
g - коэффициент активности компонента в жидкой фазе;
e - порозность;
l – теплопроводность;
m - вязкость;
r - плотность;
d – толщина;
q - безразмерная температура;
Ф, G, Q – параметры взаимодействия, используемые при вычислении вязкости и теплопроводности газовых смесей.
w - фактор ацентричности Питцера;
a - удельная поверхность;
Bi - критерий Био;
cp - удельная изобарная теплоемкость;
d - диаметр;
F - поверхность;
G - массовый расход;
Gr - критерий Грасгофа;
h - высота;
Н - энтальпия;
k - константа скорости реакции;
К - коэффициент теплопередачи;
Кр - константа равновесия;
l - длина;
М - молярная масса;
n - количество вещества.
N - мольная доля;
Nu – критерий Нуссельта;
Р - давление;
р - парциальное давление;
Ре - критерий Пекле;
Pr - критерий Прандтля;
Q – тепловой эффект;
q – удельная тепловая нагрузка;
R - радиус;
r - скорость реакции;
Re - критерий Рейнольдса;
S – постоянная взаимодействия Сюзерленда;
Т - температура;
V - объем;
w – скорость;
x – мольная доля компонента в жидкой фазе;
y – мольная доля компонента в газовой смеси;
Z - коэффициент сжимаемости;
П – поправка Пойнтинга.
Индексы:
а - аммиак;
в - вода;
вн - внутренний;
вх - вход;
вых - выход;
г - газ;
ж - жидкость;
з - зерно;
конд. - конденсат;
м - метанол;
н - наружный;
н.п. - насыщенный пар;
нас - насыщенный;
об - общий;
п.п. - перегретый пар;
с - критический параметр;
см - смесь;
сопр - сопротивление;
ср - средний;
ст - стенка;
ф - фактический;
э – эквивалентный.
ВВЕДЕНИЕ
Основной целью перестройки и кардинальных рыночных реформ в России было существенное повышение эффективности экономики с тем, чтобы наша страна в исторически короткий срок смогла на равных правах интегрироваться в мировую рыночную экономику.
Сегодня экономика России еще в меньшей мере готова к интеграции в мировую рыночную экономику, чем тогда, т.к. не решена основная задача переходного периода – техническое перевооружение, в результате которого российская промышленность смогла бы когда-то в будущем почувствовать себя равноправной на рынке.
Важным обобщающим показателем эффективности экономики страны является энергоемкость ее продукции. Если в 1985 году в России расходовали на единицу валового национального продукта в 2-3 раза больше энергии, чем на Западе, то сегодня в 3 –3,5 раза. Велик физический и моральный износ действующих мощностей, срок службы которых составляет 25-30 лет при 18 годах по нормативам [69]. Таким образом, можно констатировать, что в части эффективности экономики Россия прогрессирующе отстает от рыночного мира.
Экономия топливно-энергетических ресурсов относится к важнейшим задачам в современной российской промышленности. Развитие так называемых энергосберегающих технологий является сегодня главным направлением и в химической технологии. Как известно, в этой области техники расходуется около 15 % всех энергоресурсов [40]. Во многих химических производствах расход энергии определяет основную часть затрат.
Что касается химической промышленности, то ситуация здесь несколько лучше, чем в российской экономике в целом. Тем не менее, и для предприятий химической промышленности вопрос о низкой конкурентоспособности на международных рынках является весьма актуальным, т.к. относительно высокая рентабельность экспорта в этой области обусловлена двумя факторами: высокой конъюнктурой на международных рынках и очень низкой внутренней ценой природного газа.
По прогнозам, выполненным фирмой ''Азотэкон'', такая ситуация на рынке сохранится недолго. Поэтому единственный выход состоит в опережающей модернизации предприятий, что должно заметно повысить конкурентоспособность российского экспорта [69].
Модернизация и реструктуризация должны основываться на продуманной инновационной политике в отрасли. В условиях острой конкуренции эффективная инновация является главной предпосылкой достижения положительного результата, в первую очередь в производственной сфере.
На современном этапе развития общественного производства прогрессивные нововведения реализуются в сложных, наукоемких продуктах, энергосберегающих и высоких технологиях. При всем разнообразии рынка инноваций сегодня определяющим условием для успешной реализации нововведений является обеспечение снижения энергопотребления. Корректная оценка проектов занимает центральное место в процессе обоснования и выбора возможных вариантов инноваций.
Целью работы является разработка теплоэнерготехнологического комплекса производства аммиака, метанола и энергоносителей и оценка схем его реализации путем теплоэнергетического и технико-экономического обоснования на основе методов математического моделирования.
Методы исследования, использованные в работе, основываются на системном подходе, который предполагает использование методологии анализа, пригодной для сложных теплоэнерготехнологических комплексов. Она складывается из предварительного концептуального моделирования процесса и его формализации, которые позволяют свести количественное и качественное изучение реальных и проектируемых теплоэнерготехнологических комплексов к исследованию их математических моделей, реализованных на ЭВМ с помощью современных программных вычислительных комплексов.
Научная новизна работы:
1. На основе системного подхода разработана концептуальная модель теплоэнерготехнологического комплекса, отличающегося сложной многостадийной организацией процесса и наличием рециклов, а также комбинированным производством теплоносителей разного уровня.
2. Разработана математическая модель теплоэнерготехнологического комплекса производства аммиака, метанола и энергоносителей, описывающая процессы теплообмена, выработки и потребления теплоносителей, а также протекающие физико-химические процессы.
3. Создана новая математическая модель процессов тепло- и массопереноса, протекающих в реакторе синтеза метанола, ориентированная на совместное рассмотрение вопросов генерации теплоносителей и получения целевого продукта.
4. Разработаны алгоритмы реализации математической модели, позволяющие, в частности, быстро и эффективно осуществлять многочисленные итерационные процедуры, необходимые для расчета комплексного производства.
Практическая ценность работы:
1. Математическая модель реализована на ЭВМ с помощью современных вычислительных комплексов, что позволяет достаточно просто и быстро проводить расчет балансов комплексного производства по тепловым и материальным потокам, выработке и потреблению энергоносителей, экономических показателей, а также выполнять поверочные расчеты теплообменного оборудования.
2. С помощью разработанной математической модели проведены эксперименты по моделированию теплоэнерготехнологических схем комплексного производства аммиака, метанола и энергоносителей. Полученные данные являются основой для теплоэнергетического и технико-экономического обоснования инновационного проекта комплексного производства с подбором оптимальных условий его реализации.
3. Предложены оригинальные технические решения, такие как замена привода компрессора с электродвигателя на паровую турбину, организация выработки энергоносителей при производстве метанола, дозирование кислорода в производство, направленные на снижение потребления природного газа и электроэнергии. Эффективность решений подтверждена их теплоэнергетической и экономической оценкой путем расчета по разработанной математической модели.
Апробация работы. Основные положения диссертационной работы были доложены и обсуждены на Второй областной межвузовской научной конференции ''Молодые исследователи – региону'' (Вологда, 2000), на Международной научно-технической конференции ''ИНФОТЕХ – 2001'' (Череповец, 2001), на III-й Международной научно-технической конференции ''Повышение эффективности теплообменных процессов и систем'' (Вологда, 2002), на IV-й Межвузовской конференции молодых ученых (Череповец, 2003), на XVI-й Всероссийской конференции по химическим реакторам ХИМРЕАКТОР-16 (Казань, 2003).
Публикации. Материалы диссертации изложены в 5 публикациях.
Объем работы. Диссертационная работа состоит из введения, четырех глав, заключения, списка использованной литературы (88 наименований), 3-х приложений и содержит 149 страниц машинописного текста, включая 54 рисунка и 2 таблицы.
Глава 1. АНАЛИТИЧЕСКИЙ ОБЗОР И ЗАДАЧИ
ИССЛЕДОВАНИЯ.
1.1. Современное состояние энергопотребления в
производствах аммиака и метанола.
Сегодня в российской промышленности аммиак и метанол производятся на независимых агрегатах, построенных в 1970-1980 г.г. и отличающихся очень большой энергоемкостью - 9,5-11,5 Гкал на одну тонну произведенной продукции [73]. Поэтому весь процесс развития этих производств представляет собой борьбу за снижение энергопотребления за счет оптимизации технологической схемы производства, усовершенствования конструкции реакторов, применения новых типов катализаторов и материалов [18].
Основными источниками энергии для получения аммиака и метанола являются природный газ и электроэнергия, потребление которых весьма велико как в абсолютном, так и в удельном выражении. Поэтому эти производства называют самыми энергоемкими в химической промышленности [40].
Затраты на природный газ и электроэнергию составляют большую часть в себестоимости продукции. Например, на ОАО ''Череповецкий ''Азот'' затраты на природный газ в себестоимости тонны аммиака возрастали следующим образом: на агрегате ТЕС - с 43,6 % в 1979 г. до 55,1 % в 2003 г., на агрегате АМ-76 – с 25,9 % в 1985 г. до 51 % в 2003 г. Затраты на электроэнергию также значительно возросли: агрегат ТЕС – с 4,8 % в 1979 г. до 10,4 % в 2001 г., агрегат АМ-76 – с 4,8 % в 1985 г. до 17,1 % в 2001 г [28]. В связи с этим в производствах аммиака под экономией энергии понимают прежде всего экономию природного газа и электроэнергии.
Повышенная энергоемкость производств аммиака и метанола определяется причинами как экономического характера (сезонный спрос на продукцию, неполная загрузка мощностей), так и технологического (неполная переработка природного газа, неиспользованное низкопотенциальное тепло и др.).

Основной экономической причиной высоких удельных затрат энергии на получение продукции является неполная загрузка производственных мощностей, представленная на графике (рис. 1) на примере производства аммиака [17].
Рис. 1. Использование мощностей по производству аммиака в России.
Неполная загрузка мощностей является, в свою очередь, следствием цикличности спроса на произведенную продукцию. Несмотря на то, что в последние годы (2000 – 2002) наблюдается некоторое оживление аммиачного производства в российской промышленности, определяемого в значительной степени конъюнктурой внешних рынков аммиака и азотных удобрений, внутренний рынок аммиака и продуктов его переработки продолжает находится в стадии затяжной стагнации [15,16]. Как видно из диаграммы на рис. 2, цикличность производства аммиака стала стабильным явлением российской азотной промышленности.
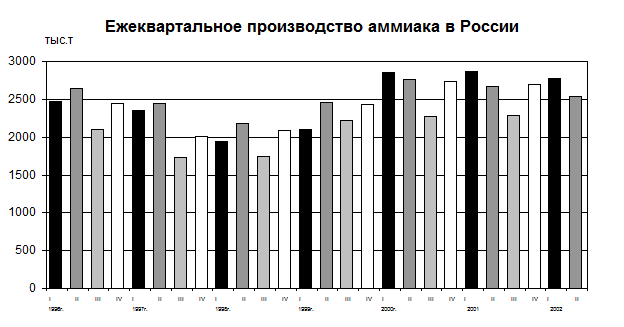
Рис. 2. Производство аммиака в России в 1996-2002 гг.
Из диаграммы на рис. 3 следует, что производство метанола в России также подвержено квартальным колебаниям [17].

Рис. 3. Производство метанола в России в 1999-2002 гг.
В соответствии с колебаниями спроса на продукцию цены на нее на мировых и внутренних рынках также подвержены значительным изменениям, как это показано на рис. 4,5 [16,17].

 Рис. 4. Мировые цены на аммиак в 1993-2001 гг.
Рис. 4. Мировые цены на аммиак в 1993-2001 гг.
Рис. 5. Цены на метанол в России в 2000-2002 гг.
Несмотря на относительно низкую загрузку мощностей (см. рис. 1) удельные расходные коэффициенты по природному газу в производствах аммиака в 2002 г. снизились до минимальных за несколько последних лет. Тем не менее, ни отечественные, ни импортные агрегаты не достигли проектных показателей (рис. 6).
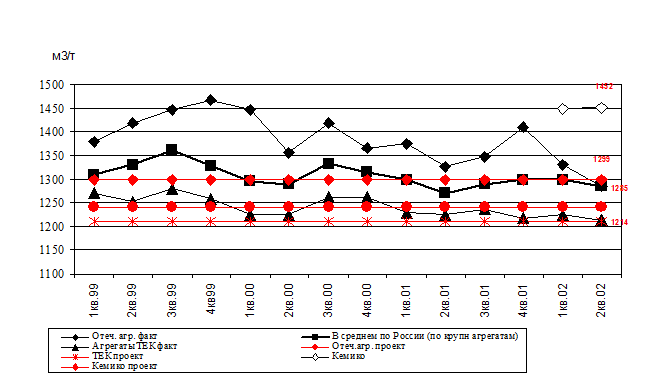
Рис. 6. Расход природного газа в производствах аммиака.
Для сравнения, усредненный расход природного газа на тонну аммиака в 2000 г. в США составил 1050 м3 [73].
Причины отставания российских предприятий заключаются в технологической идеологии, по которой они были спроектированы и построены. Хотя в основу проектирования агрегатов в 1970-1980 г.г. был заложен энерготехнологический принцип, их расчетная энергоемкость была все равно велика и составляла 9,6 Гкал на одну тонну аммиака. Для, сравнения, современные энергосберегающие агрегаты аммиака потребляют 6,5-7,5 Гкал на тонну аммиака, но таких агрегатов в мире пока немного [73].
Чтобы лучше понять основные причины повышенного энергопотребления в агрегате аммиака, обратимся к его структурной схеме на рис. 7. Все современные агрегаты аммиака состоят примерно из одинакового ряда последовательных стадий, объединенных в отдельные блоки [74]:
1) переработка природного газа (риформинг метана, конверсия СО, очистка газа);

2) синтез аммиака (компрессия синтез-газа, первичная, вторичная конденсации и непосредственно синтез);
3) система выработки и потребления пара высокого давления (котлы-утилизаторы, вспомогательный котел, турбина компрессора синтез-газа);
4) система выработки и потребления пара различного давления (40, 8 и 4,5 ата).
Все перечисленные стадии жестко связаны между собой тепловыми и материальными потоками и отличаются большой энергоемкостью.
Основным потребителем энергии в агрегате аммиака является компрессор синтез-газа (см. рис. 7), имеющий мощность 32 МВт [53] при производительности агрегата, соответствующей проектной (1360 т/сут аммиака). В качестве привода применяется турбина, работающая на паре давлением 105 ата. Согласно теплоэнергетическому принципу построения агрегата аммиака [53] пар вырабатывается частично за счет утилизации тепла реакций в котлах-утилизаторах (примерно 70 %), частично за счет сжигания природного газа во вспомогательном котле (см. рис. 7).
Как видно из структурной схемы, природный газ используется в агрегатах аммиака в двух направлениях: как сырье – для получения водорода (риформинг метана и его гомологов в трубчатых печах) и как топливо – для подвода тепла при проведении эндотермический реакций риформинга и для получения пара. Причем в обоих направлениях использование природного газа далеко от оптимального.
Что касается сырьевой составляющей, то в производстве аммиака используется лишь 25 массовых процентов природного газа (молекула метана СН4 – 16 атомных единиц массы, из них 4 а.е.м. приходятся на атомы водорода, из которого синтезируется аммиак). Углерод выделяется из технологической нитки агрегата аммиака в виде диоксида углерода СО2 (см. рис. 7), который используется для производства карбамида или выбрасывается в атмосферу, загрязняя окружающую среду. Например, на ОАО ''Череповецкий ''Азот'' два агрегата аммиака вырабатывают по 35000-36000 нм3/ч СО2 каждый, а имеющийся агрегат карбамида потребляет лишь 25000-26000 нм3/ч СО2 [81].
Не лучшим образом обстоит дело и с использованием природного газа в качестве топлива. Основной потребитель здесь – трубчатая печь первичного риформинга метана, теплоэнергетический к.п.д. которой находится в пределах 40-45 % [53].
Производство пара в агрегатах аммиака АМ-76 за счет сжигания природного газа также далеко от совершенства, т.к. существует дисбаланс между производством и потреблением низкопотенциального пара. Например, на ОАО ''Череповецкий ''Азот'' на агрегате АМ-76 в атмосферу выбрасывается 10-15 т/ч пара с давлением 8 ата и температурой 255 °С (см. рис. 7), причем за 15 лет работы агрегата эта проблема так и не решена.
Для решения указанных проблем в последнее время усиленно разрабатываются технологии, обеспечивающие комплексное использование природного газа для производства вещества и энергии [18,73].
1.2. Пути снижения энергопотребления производств аммиака.
Основные энергетические потери в агрегатах аммиака связаны непосредственно с технологическим процессом (хотя, конечно, зависят и от совершенства энергетического оборудования) [40]. Поэтому резервы снижения энергетических затрат кроются в усовершенствовании технологии, в ее оптимизации с учетом необходимости комплексного использования и производства химических продуктов и теплоносителей.
Научную основу для решения задачи экономии энергии дает термодинамика и, в частности, основанный на втором законе термодинамики эксергетический анализ. Данный метод дает наиболее ясное и полное представление о причинах потерь энергии и способах их снижения. Теория эксергетического анализа подробно изложена в [40]. Однако, как указывают авторы [40], практическое применение данного метода для анализа таких крупных объектов, как производства аммиака и метанола, вызывает значительные трудности и необходимость введения большого количества допущений. Поэтому в диссертационной работе не ставилась задача проведения эксергетического анализа рассматриваемого теплоэнерготехнологического комплекса, но некоторые положения этого несомненно эффективного метода автор использовал в работе.
В частности, авторы [40] выделяют три группы методов уменьшения энергетических затрат для процессов с заданными физико-химическими свойствами веществ:
1) методы, связанные с увеличением поверхностей аппаратов, времени протекания реакций, применением более активных катализаторов. Все эти методы позволяют приблизиться к равновесию на выходе из аппаратов;
2) методы, основанные на изменении технологического режима и не связанные с изменением технологической схемы;
3) методы, требующие изменения технологической схемы.
Методы 1-й и 2-й групп реализуются на различных предприятиях следующими основными способами [18,28,73]:
1) применение качественных высокопроизводительных катализаторов;
2) замена аксиальных реакторов на радиальные;
3) модернизация стадии очистки от СО2;
4) применение мембранной установки разделения продувочных газов;
5) расширение водооборотных циклов.
При проведении указанных мероприятий энергопотребление производств аммиака может быть снижено примерно на 0,8-1,0 Гкат/т. Ориентировочные затраты на реконструкцию такого типа составляют до 15 млн. долл. США. Дальнейшее снижение энергопотребления до уровня 8-8,5 Гкал/т возможно лишь в случае ''радикальной'' модернизации технологии и оборудования, при этом затраты на модернизацию многократно возрастают [18].
Существенно другим методом снижения затрат энергии на получение единицы продукции является создание теплоэнерготехнологических комплексов производства нескольких продуктов (например, аммиака и метанола, аммиака и карбамида) на базе существующих крупнотоннажных агрегатов синтеза аммиака. Т.к. в результате подобной модернизации изменяется технологическая схема производства, то данный метод относится к 3-й группе (см. выше).
В диссертационной работе рассматривается проект теплоэнерготехнологического комплекса совместного производства аммиака, метанола и энергоносителей. Создание такого комплексного производства имеет следующие очевидные преимущества:
1) в комплексном производстве открываются широкие возможности взаимного использование тепловых потоков и использования тепла физико-химических процессов для выработки теплоносителей;
2) увеличение суммарной выработки приведет к снижению удельных расходов энергоносителей (природного газа, пара и электроэнергии);
3) технология внедрения производства метанола в действующее производство аммиака позволит использовать существующую установку подготовки газа, компрессоры, заводские сооружения и тем самым увеличить коэффициент использования мощностей в агрегате аммиака;
4) совмещение производства аммиака и метанола позволит регулировать выработку продуктов и компенсировать сезонные циклы в спросе на удобрения;
5) предприятие сможет в короткие сроки выйти на новые рынки сбыта, связанные с высокой перспективностью метанола, т.к. он является сырьем для синтезе многих важных продуктов и применяется при получении высокооктановых компонентов моторных топлив;
6) защита окружающей среды за счет частичной утилизации оксидов углерода.
Как видно, создание теплоэнерготехнологического комплекса будет способствовать устранению как технологических, так и экономических причин повышенной энергоемкости производств аммиака и метанола.
Несмотря на очевидные преимущества, данная концепция пока не нашла применения в российской промышленности, тогда как в западных странах этому вопросу уделяют все большее внимание. Вместе с тем, на Новгородском АО ''Акрон'' реализован проект полного перевода агрегата аммиака на выпуск метанола-ректификата марки, близкой к АА. При капитальных затратах в пределах 1-1,5 млн. долл. США получены мощности 60-70 тыс. тонн метанола в год [69].
При этом удельное потребление энергии на производство метанола с использованием старого аммиачного оборудования составило 10,9 Гкал в сравнении с лучшим действующим отечественным аналогом 11,4 Гкал. Удельный расход природного газа на тонну метанола-ректификата составляет 790 нм3 и 1300 нм3 соответственно [73].
1.3. Анализ вариантов реализации комплексного производства
аммиака, метанола и энергоносителей.
Концепция производства аммиака и метанола на базе одной и той же установки имеет достаточно долгую историю. В начале 1980-х годов компания ''ICI'' разработала полноценный рабочий проект особо крупной установки по производству 2200 тонн метанола и 1100 тонн аммиака в сутки (METHAMM) [4]. Были четко продемонстрированы энергетические и технико-экономические преимущества как самой концепции, так и конкретного проекта по сравнению с двумя независимыми производствами с такой же мощностью. Однако проект не был реализован из-за высоких в то время цен на природный газ, расход которого на предложенную технологическую схему был довольно велик.
В 90-е годы ряд зарубежных компаний (''Haldor Topsoe'' (Дания), ''ICI'' (Великобритания), ''UHDE'' (Германия) и ''ТЕС'' (Япония)) вернулись к идее комплексного производства аммиака, метанола энергоносителей и разработали несколько схем его реализации [1-4,11,13,18].
Первый проект комплексного производства реализовала компания ''Haldor Topsoe'' в г. Вудвард (США) на агрегате аммиака мощностью 1270 т/сут. Новая установка была пущена в эксплуатацию в апреле-мае 1994 г. и производила 910 т/сут аммиака и 360 т/сут метанола [1,3].
Далее компания ''ICI'' предложила сатурационно-десатурационную схему, которая имела хорошие эксплуатационные характеристики, но требовала очень больших капитальных затрат вследствие громоздкости применяемого оборудования [4]. Поэтому компания быстро отказалась от такого варианта и разработала более современную мембранно-компрессорную схему [2].
Немецкая фирма ''UHDE GmbH'' разработала три технологические схемы комплексного производства аммиака и метанола [18]. Базовая производительность по аммиаку во всех трех проектах составляет 1200 т/сутки. При работе по схеме с производством метанола производительность по аммиаку составляет 1100 т /сутки и 200 т/сутки по метанолу. Все три схемы фирмы ''UHDE'' различаются лишь способом организации теплообмена. Японская инжиниринговая фирма ''ТЕС'' также предложила схему комплексного производства, практически идентичную схемам ''UHDE'' [13].
В настоящее время варианты фирм ''UHDE'' и ''ТЕС'' считаются наиболее совершенными [18]. Структурная схема комплексного производства аммиака, метанола и энергоносителей, соответствующая этим вариантам, приведена на рис. 8, где пунктирными линиями указаны новые (проектируемые) стадии производства.

Как видно из схемы, в комплексном производстве тесно взаимосвязаны процессы выработки и потребления энергоносителей (водяной пар различного давления и электроэнергия) и получения целевых продуктов. Энергоносители вырабатываются как за счет утилизации тепла реакций, так и из природного газа, который является и основным сырьем для получения продукции. Водяной пар используется для привода турбин, обеспечивая возможность протекания физико-химических процессов и сам в свою очередь является реагентом.
Любая современная технология обязана быть энергосберегающей [73]. Поэтому при организации комплексного производства необходимо соблюдение следующих требований:
1) минимальное количество дополнительных хладо- и теплоагентов;
2) максимально полная утилизация тепла протекающих физико-химических процессов;
3) минимальное дополнительное количество природного газа и электроэнергии;
4) организация взаимного использования теплоносителей при производстве аммиака и метанола.
Как уже указывалось выше, рассматриваемые схемы комплексного производства фирм ''UHDE'' и ''ТЕС'' различаются лишь способами организации теплообмена. Исходя из вышеизложенных требований, применительно к этим схемам, необходимо оптимальным образом решить следующие задачи:
1) охладить газовую смесь, отбираемую из агрегата аммиака, с целью конденсации из нее водяного пара;
2) нагреть газовую смесь перед подачей ее в реактор синтеза метанола;
3) утилизировать тепло экзотермической реакции синтеза метанола;
4) сконденсировать метанол-сырец (смесь метанола и воды) из прореагировавшей газовой смеси;
5) нагреть газовую смесь, возвращаемую в агрегат аммиака.
Задачи 2 и 4 решаются в схемах компаний ''ТЕС'' и ''UDHE'' взаимосвязано: газовая смесь перед реактором нагревается за счет тепла прореагировавшей смеси, окончательное охлаждение последней осуществляется в водяном холодильнике. В этих же схемах газовая смесь, возвращаемая в агрегат аммиака, подогревается (задача 5) за счет тепла отбираемой смеси, чем частично решается также задача 1. Также в схемах ''UHDE'' [18] за счет охлаждения парогазовой смеси, поступающей из агрегата аммиака в контур метанола, осуществляется выработка пара давлением 4,5 ата, который используется для ректификации. Изложенные решения вполне обоснованны и приняты в разрабатываемой нами схеме комплексного производства без изменений. Однако они должны быть подтверждены расчетом, особенно баланс по выработке пара низкого давления и его потреблению для ректификации.
Для достижения цели снижения энергопотребления особое внимание в диссертации уделено задаче 3. При синтезе метанола используют 2 типа реакторов [7,10,12,50,67]: шахтные и трубчатые.
В схемах компаний ''Haldor Topsoe'', ''ICI'' и ''UHDE'' при синтезе метанола применяется шахтный реактор. Охлаждение газовой смеси в реакторе происходит путем ввода холодного газа, что весьма неэффективно с позиций эксергетической теории [40]. Более эффективна в этой части схема ''ТЕС'', где синтез проводится в трубчатом реакторе, а тепло реакций отводится испарением воды в межтрубном пространстве. Основным недостатком трубчатых реакторов до недавнего времени считалось то, что в них трудно было осуществить равномерную загрузку катализатора, к тому же при этом использовался ручной труд. Но сейчас разработаны методы полуавтоматической загрузки [5,9], в которых эти сложности легко преодолеваются.
Однако и в схеме ''ТЕС'' присутствуют недостатки. В реакторе синтеза метанола вырабатывается насыщенный пар давлением 33-35 ата. Очевидно, необходимо уже на стадии проектирования решить вопрос об использовании этого пара. На агрегате аммиака применяется пар давлением 105, 40, 8 и 4,5 ата. Присоединение пара 33-35 ата к системам пара 105 и 40 ата невозможно, а снижение давления с 33-35 ата до 8 или 4,5 ата с целью использования при ректификации метанола крайне невыгодно [40], т.к. при этом значительно снижается эксергетический потенциал. Поэтому проблема утилизации пара давлением 33-35 ата не решена.
Кроме того, в рассмотренных схемах совместного производства не решен вопрос подогрева питательной воды, подаваемой в реактор синтеза.
При решении указанных проблем автор диссертации использовал приемы увеличения использования тепла реакций, основанные на теории эксергетического анализа и рекомендованные авторами [40]:
1) повышение температуры экзотермических реакций для более рационального использования их тепла;
2) отвод тепла непосредственно из зоны реакции при максимальной температуре;
3) отвод тепла реакции теплоносителями типа насыщенного водяного пара, имеющими преимущество перед теплоносителями типа горячей воды;
4) ведение процесса в аппаратах полного вытеснения.
На основе данных рекомендаций автор диссертации предложил ряд решений, которые обсуждаются в Главе 4.
Обоснование решений по организации теплообмена должно быть подтверждено результатами расчетов тепловых и материальных потоков, выполненных уже на уровне проектирования, а это возможно сделать только методами математического моделирования.
Однако в литературе практически нет работ, посвященных разработке или реализации научных основ моделирования энергосберегающих технологий этого специфического комплексного процесса. Чаще всего рассматриваются лишь общие вопросы моделирования отдельных производств аммиака и метанола [19,74] или вообще химических производств [20,32-34].
Между тем комплексные производства различных химических продуктов позволяют разработать уникальные методы сбережения и утилизации тепла и топлива, оптимизируя как структуру технологической схемы, так и используя более широкие, чем при индивидуальных производствах, возможности организации теплообмена.
Применение системных методов моделирования позволяет перейти от расчетов отдельных аппаратов и узлов к рассмотрению всей системы в целом. Такой подход, вместе с использованием проверенных на практике методик и приемов повышения эффективности теплоэнергетических процессов, дает возможность оптимальным образом сбалансировать тепловые потоки различного потенциала.
1.4. Основы математического моделирования
теплоэнерготехнологических комплексов.
Разработка комплексного производства аммиака, метанола и энергоносителей и его оптимизация по различным критериям возможны только при наличии модели, корректно описывающей как технологические процессы, так и процессы выработки и потребления теплоносителей. На современном уровне развития это должна быть численная математическая модель, реализованная на ЭВМ с помощью современных программных средств.
При моделировании химических производств в литературе часто используется понятие химико-технологической системы (ХТС) - целенаправленной совокупности процессов, аппаратов и машин химической технологии, обеспечивающей проведение требуемых технологических операций химической и физической переработки сырья в продукты потребления и в промежуточные продукты [33,34]. Однако при таком понимании теряется другая важнейшая составляющая химических производств – теплоэнергетическая. Как было показано выше, в таких масштабных производствах, как производства аммиака и метанола, эта составляющая в наибольшей степени определяет их экономическую эффективность.
Долгое время в химической промышленности главной целью было получение целевого продукта в нужном количестве и требуемого качества, а задачу рационального использования энергии считали второстепенной. Однако по мере развития технологии возросло внимание, уделяемое использованию тепла химических реакций. Примером может служить использование тепла, выделяющегося в результате химических реакций в производствах аммиака и метанола [40]. В связи с этим термин ''химическая энерготехнология'' в последние годы получает все большее распространение. Под ним следует понимать совокупность знаний о совместном производстве продуктов и энергии в химической технологии, а также об экономном расходовании энергетических ресурсов.
В диссертационной работе употребляется термин теплоэнерготехнологический комплекс, который объединяет теплоэнергетическую и технологическую составляющие, присутствующие в различной степени в любом химическом производстве.
Математическое моделирование теплоэнерготехнологических комплексов - это метод изучения их реальных свойств путем проведения вычислительных экспериментов с математическими моделями этих комплексов на ЭВМ с использованием различных вычислительно-логических алгоритмов [32]. Методологией математического моделирования является системный подход. Системный подход основан на одном из важнейших законов диалектики - законе всеобщей взаимосвязи, взаимодействия и взаимообусловленности явлений и объектов в мире и обществе. Применительно к данной работе системный подход предполагает учет наиболее существенных связей между различными стадиями комплексного производства, т.е. математическая модель должна быть построена таким образом, чтобы в процессе вычислений учитывалось влияние того или иного параметра на все стадии производства.
Любой теплоэнерготехнологический комплекс как объект исследования имеет определенную технологическую структуру и заданные параметры [34]. Структура рассматриваемого комплексного производства приведена выше на рис. 8. Параметрами являются различные величины, которые характеризуют особенности протекания процессов теплообмена и физико-химических явлений, условия их проведения и особенности инженерно-аппаратурного оформления системы. Различают параметры состояния - температура, давление, расход, и т. д. и параметры свойств потока - теплоемкость, вязкость, плотность и др. Основываясь на системном подходе, необходимо построить модель так, чтобы при расчетах учитывать влияние параметров состояния на параметры свойств потока или хотя бы оценить его. В тех случаях, когда это влияние несущественно, им можно пренебречь.
Как было показано выше, комплексное производство аммиака и метанола является весьма сложным теплоэнерготехнологическим комплексом со множеством взаимосвязанных тепловых и материальных потоков. Поэтому технология моделирования такого объекта должна включать в себя [33,34] следующие этапы:
1. Определение цели моделирования.
2. Разработка концептуальной модели.
3. Формализация модели.
4. Программная реализация модели.
5. Проведение модельных экспериментов.
6. Анализ и интерпретация результатов моделирования.
Этапы 1-3 рассматриваются в Главе 2, этап 4 описан в Главе 3, этапам 5 и 6 посвящена Глава 4.
Как известно, содержание первых двух этапов не зависит от математического метода, положенного в основу моделирования и даже наоборот - их результат определяет выбор метода. А вот реализация остальных четырех этапов существенно зависит от основных подходов к построению модели. В диссертации планируется использовать так называемое ''аналитическое'' моделирование по терминологии [22] .
Аналитическое моделирование предполагает использование математической модели реального объекта в форме алгебраических, дифференциальных, интегральных и других уравнений, связывающих выходные переменные с входными, дополненных системой ограничений. При этом предполагается создание вычислительной процедуры получения точного решения уравнений.
Математические системы уравнений, описывающие теплоэнерготехнологический комплекс, - это совокупность независимых уравнений, входящих в три группы систем уравнений [34]:
1) система уравнений материального баланса;
2) система уравнений теплового баланса;
3) система уравнений физико-химических связей.
Важно отметить, что сходимость балансов определяется законами сохранения: материальный баланс - законом сохранения массы, тепловой - законом сохранения энергии [30]. В наиболее общем виде они выражаются как равенство масс и энергий потоков, входящих в теплоэнерготехнологический комплекс и выходящих из него. Математически это изображается в виде равенства сумм:

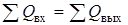
Уравнения физико-химических связей - это обобщенное упрощенное описание сущности физико-химических явлений, происходящих внутри элементов теплоэнерготехнологического комплекса и влияющих на величину тепловых нагрузок элементов. Эти уравнения при расчете тепловых и материальных нагрузок элементов комплексного производства дополняют системы уравнений балансов.
Изложенные основные положения математического моделирования теплоэнерготехнологических комплексов в полной мере использованы автором диссертации при разработке концептуальной модели объекта, ее формализации и реализации с применением современных компьютерных программных средств.
1.5. Опыт моделирования энерготехнологических производств
аммиака и метанола.
Математическому моделированию производств аммиака и метанола уделяется большое внимание и в литературе описано немало работ, посвященных исследованиям в данной области. Тем не менее, этот вопрос нельзя считать достаточно проработанным в силу следующих причин:
- производства аммиака и метанола являются объектами с весьма сложной структурой;
- до последнего времени в предлагаемых моделях слабо учитывалась теплоэнергетическая сторона указанных производств;
- все разрабатываемые модели ориентированы на независимые производства.
Так, например, зарубежные фирмы интенсивно занимаются разработкой и продажей программ для расчетов производства аммиака, например, компания ''ICI Synetix'' ( программа ''CATPER'') и ''Haldor Topsoe'' (программа ''FRONTEND'') [23]. Но эти программы работают только в режиме ввода исходных данных и вывода результатов расчета, поэтому их применение весьма ограничено.
Математическому моделированию процесса синтеза метанола посвящен целый ряд работ [27,35,65], в том числе направленных и на энергосбережение [36,39,50,83]. В некоторых работах особое внимание уделено схемам с рециркулирующими потоками [85], а также оптимальным энерготехнологическим циклам в совместных схемах производства метанола и высших спиртов [68]. Однако во всех этих работах рассматривается независимое производство метанола.
Математическая модель, описывающая производство метанола как химико-энерготехнологическую систему, представлена в [65]. Но эта модель имеет следующие недостатки: она ориентирована на независимое производство метанола, реализована модель на ЭВМ на языке АЛГОЛ и в ней в недостаточном объеме моделируются тепловые процессы.
По-видимому, гораздо более совершенная программа разработана в Институте катализа им. Г.К. Борескова. Как указывается в [27], она рассчитывает материальные, тепловые и энергетические потоки с адаптацией расчетных данных к экспериментальным. Кроме того, учитывается неидеальность газовой и жидкой фаз. Примерно такая же программа представлена и в [35]. Но и эти программы ориентированы на независимое производство и полочную колонну синтеза метанола. В связи с этим адаптация таких программ к комплексному производству и трубчатому реактору синтеза метанола потребует очень существенных их программных доработок с привлечением их разработчиков.
Математическое моделирование тепловых и материальных схем и балансов возможно с помощью компьютерных программ типа ChemCAD, но использование таких программ усложняется тем, что создатели стремятся сохранить конфиденциальность информации, чтобы избежать пиратского использования. Кроме того, существует еще ряд проблем:
- в подобных программах нельзя явно представить физико-химическую сущность моделируемых процессов;
- комплексная схема производства аммиака и метанола, как и другие схемы совместных производств, достаточно сложны для расчета и моделирования даже при использовании подобных специализированных программных комплексов;
- нет опыта применения специализированных программных комплексов типа ChemCAD для проектирования и оптимизации тепловых и материальных балансов комплексных производств.
Таким образом, применение известных математических моделей для описания комплексного производства аммиака, метанола и энергоносителей весьма затруднено.
Исходя из вышеизложенного, были поставлены следующие задачи исследования:
1) разработка концептуальной модели теплоэнерготехнологического комплекса производства аммиака, метанола и энергоносителей;
2) формализация концептуальной модели;
3) алгоритмизация расчетов по формализованной математической модели;
4) реализация алгоритмов на ЭВМ с использованием современных вычислительных комплексов;
5) проведение на основе разработанной модели численных экспериментов с получением некоторого массива данных и их анализ;
6) подтверждение с помощью расчетов по модели предложенных технических решений, обеспечивающих снижение энергопотребления в комплексном производстве.
Объектом исследования является теплоэнерготехнологический комплекс совместного производства аммиака, метанола и энергоносителей, проектируемый на базе существующего агрегата АМ-76 (ОАО ''Череповецкий ''Азот'').
Выводы по главе:
1. Рассмотрено состояние энергопотребления производств аммиака и метанола в России. Проанализированы причины их повышенной энергоемкости, которые носят как энерготехнологический, так и экономический характер. Показано, что основной проблемой является повышенный расход природного газа на единицу произведенной продукции.
2. Рассмотрены возможные пути снижения энергопотребления производств аммиака. Одним из них является создание комплексного производства аммиака, метанола и энергоносителей. Основными преимуществами такого производства являются снижение удельных энергозатрат на производство продукции и возможность предприятия реагировать на рыночные изменения.
3. Проанализированы способы комплексного производства аммиака, метанола и энергоносителей и организации теплообмена при его реализации. На основе проведенного анализа за базовые приняты схемы комплексного производства, предлагаемые компаниями ''UHDE'' и ''ТЕС''. Указаны недостатки этих схем. Исходя из принципа построения энергосберегающих технологий при переходе от производства аммиака к комплексному производству должен выполняться ряд требований. Выполнение этих требований необходимо решать на уровне проектирования, а это возможно сделать только методами математического моделирования с применением современных вычислительных программных пакетов.
4. Изложены основные положения математического моделирования энерготехнологических производств аммиака и метанола. Критически оценен имеющийся опыт моделирования независимых производств: созданные модели слабо учитывают теплоэнергетические аспекты и не могут быть переориентированы на комплексное производство.
Для решения имеющихся проблем поставлены задачи исследования.
Глава 2. МЕТОДИЧЕСКИЕ НАУЧНЫЕ ОСНОВЫ ПОСТРОЕНИЯ МАТЕМАТИЧЕСКОЙ МОДЕЛИ ТЕПЛОЭНЕРГОТЕХНОЛОГИЧЕСКОГО КОМПЛЕКСА.
2.1. Определение цели моделирования. Разработка
концептуальной модели.
Конкретной целью моделирования исследуемого объекта является определение (расчет) значений выбранных показателей энергетической и экономической эффективности для различных технологических и теплотехнических вариантов реализации рассматриваемого комплексного производства. Для реализации этой цели достаточно разработать балансовую модель [19], отображающую сходимость балансов по тепловым и материальным потокам, выработке и потреблению теплоносителей на каждой стадии исследуемого объекта.
Концептуальная модель - это абстрактная модель, определяющая структуру моделируемой системы, свойства ее элементов и причинно-следственные связи [34]. Структура модели зависит от декомпозиции объекта исследования и выделения существенных связей между его частями.
Разрабатываемая модель должна удовлетворять принципу информационной достаточности [22]. Для этого был проведен сбор данных с физического объекта (агрегат аммиака на ОАО ''Череповецкий ''Азот''), из литературных источников (техническая документация, патентная, экспертная и нормативная информация), а также выдвижение гипотез относительно значений параметров и переменных, для которых отсутствует возможность получения фактических либо литературных данных. Полученные результаты соответствуют принципам информационной достаточности и осуществимости, т.е. они могут служить основой для построения модели.
По условиям перехода из одного состояния в другое различают детерминированные модели и стохастические [22]. Если имеются условия, определяющие переход системы в новое состояние, то для детерминированной системы можно однозначно указать, в какое именно состояние она перейдет. Для стохастической системы можно указать лишь множество возможных состояний перехода.
Любая реальная система может быть подвержена воздействию случайных факторов и, соответственно, модель этой системы будет относиться к классу стохастических. Однако для рассматриваемой системы можно пренебречь влиянием этих факторов и создаваемую модель представить как детерминированную.
По учету фактора времени разрабатываемая модель является статической, т.к. в ней все зависимости отнесены к одному моменту времени.
Таким образом, разрабатываемая модель исследуемого объекта является балансовой, детерминированной, статической и удовлетворяет принципу информационной достаточности. Модель должна обеспечивать:
1) ввод исходных данных;
2) расчет процессов теплообмена и других физико-химических процессов на различных стадиях производства;
3) расчет баланса выработки и потребления энергоносителей разного уровня;
4) расчет тепловых и материальных балансов выбранных стадий производства;
5) поверочный расчет нового теплообменного оборудования;
6) вывод выбранных показателей процесса;
7) расчет экономических показателей.
В дальнейшем балансовая модель может быть доработана до оптимизационной. При этом необходимо выбрать критерии оптимизации (показатели эффективности) и управляющие параметры, изменение которых дает экстремальные значения критериев оптимизации. Однако для достижения поставленной цели моделирования балансовая модель является достаточной.
2.2. Декомпозиция и детализация объекта исследования.
В диссертационной работе структура исследуемого объекта рассматривается как система функционально относительно независимых подсистем. Соответствующая схема приведена на рис. 9, где приняты следующие условные обозначения: V – объемный расход, G – массовый расход, Ni – состав потока, t – температура, Р – давление, N – мощность. В штриховых прямоугольниках указаны параметры, которые должны быть заданы, остальные параметры являются расчетными.
Данная структурная схема является ''ядром'' модели, на ней указаны лишь основные расчетные блоки и связи между ними. Далее будет показано, что необходимо провести еще ряд поверочных расчетов с целью определения существенности влияния того или иного физико-химического процесса (например, растворение газов), расчеты аппаратов на прочность и др.
На схеме также указаны точки ''разрыва'' замкнутых рециркулирующих потоков. Это сделано для того, чтобы система стала разомкнутой. Более подробно данный вопрос обсуждается в разделе 2.6.
Каждую стадию удобно рассматривать как отдельную подсистему, которой физически соответствует реальный аппарат (или несколько аппаратов), а математически – отдельный расчетный блок. Поэтому приведенная на рис.9 декомпозиционная структура практически соответствует схеме, приведенной на рис. 8, где показаны основные стадии производства.
В работе не рассматриваются блок выработки и распределения пара давлением 8 и 4,5 ата (см. рис. 7), т.к. они очень сложны ввиду наличия большого количества тепловых потоков и аппаратов. Количество избыточного низкопотенциального пара известно из практической работы агрегата.
Блок ректификации метанола-сырца в работе также не рассматривается, т.к. этот процесс достаточно хорошо разработан и описан в литературе [82]. Важнейшим показателем энергоемкости процесса ректификации является потребление пара. Эта величина известна из практических данных [8,18].
Детализация каждой подсистемы производилась до такого уровня, чтобы для каждого элемента были известны или могли быть получены зависимости его выходных характеристик от входных воздействий, существенные с точки зрения выбранного показателя эффективности. Поэтому при выборе уровня описания каждой подсистемы руководствовались следующим правилом: в модель подсистемы были включены параметры, обеспечивающие определение интересующих характеристик подсистемы; остальные параметры по возможности были исключены из модели.
Объективно уровень детализации определяется следующим. Одна часть модели описывает реально существующий объект – агрегат аммиака (см. рис. 7), для подсистем которого достаточным является детализация на уровне аппаратов, т.к. результаты расчетов по модели легко сравнить с фактическими данными и при необходимости скорректировать модель.
Вторая часть описывает контур метанола (см. рис. 8), который не существует физически. Важнейшей его частью является реактор синтеза метанола, в котором протекают сложные тепловые и физико-химические процессы. Как указывалось в разделе 1.3, от способа утилизации тепла, выделяющегося при этих процессах, в значительной степени зависит энергетическая эффективность производства. Поэтому стадию синтеза метанола рассматривали на уровне области аппарата (конкретно, микрослоя катализатора).
Стадии конденсации воды и метанола-сырца (см. рис. 8), в свою очередь, также разбиты на подсистемы, каждая из которых включает в себя балансовый и поверочный расчет отдельного теплообменного аппарата. Это необходимо потому, что в контуре метанола применяется новое оборудование. На данных стадиях аппаратный уровень детализации также является достаточным.
Таким образом, при детализации каждой подсистемы и всей системы в целом возникла многоуровневая структура математической модели теплоэнерготехнологического комплекса, приведенная на рис. 10.

Рис. 10. Уровни построения математической модели.
Каждый следующий уровень описания теплоэнерготехнологического комплекса наследует существенные свойства предыдущего уровня.
Следующие разделы данной Главы посвящены формализации объекта исследования. В них приведен математический аппарат, описывающий каждую подсистему согласно принятой структуре. Кроме того, критически оцениваются все принятые допущения и на каждом уровне описания определяются существенные свойства теплоэнерготехнологического комплекса.
2.3. Математическое описание свойств веществ и их смесей.
Для моделирования физико-химических процессов необходимо задать свойства веществ, их зависимость от температуры и давления, а также определить правила и уравнения для вычисления свойств смесей.
Зависимости свойств веществ и их смесей (газов, жидкостей, твердых тел) от различных параметров представлены в виде уравнений:
y = f(x1, x2, x3, …)
где y - какое-либо свойство (вязкость, теплопроводность и т.д.), xi - параметры состояния (давление, температура и т.д.).
Приступим к описанию свойств веществ:
1) характеристики индивидуального вещества: критические параметры (температура Тс, давление Рс, объем Vc, коэффициент сжимаемости Zc), температура кипения Тb (при давлении 1 атм), молярная масса М, фактор ацентричности Питцера w - все данные взяты из [59].
2) теплоемкость и энтальпия
Зависимость удельной изобарной теплоемкости газа cp (Дж/(моль×К)) от температуры T (К) описали полиномом 3-й степени с коэффициентами из [59] (начальная точка – 1 атм, 298 К):
cp = a + bT + cT2 + dT3 (2.1)
Зависимость знтальпии газа от температуры можно найти, проинтегрировав уравнение Кирхгофа [30]:

Выражение (2.1) интегрировали в пределах от 298 до t+273:
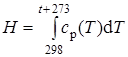 (2.2)
(2.2)
Таким образом получали зависимость удельной энтальпии (Дж/моль) от температуры (°С) в виде полинома четвертой степени для каждого компонента газовой смеси:
Н = f(t) (2.3)
Тот факт, что энтальпия (теплоемкость) газа зависит от давления, можно математически выразить следующим образом:
Н = f(t) + Н'(P,t)
где Н'(P,t) – поправка на давление, зависящая как собственно от давления, так и от температуры. Причем при Р = const Н' слабо зависит от температуры. Например, при расчете по методу Ли-Кеслера [59] для метанола при Р = 10 атм и t = 240…300 °С Н' = -828…-615 Дж/моль, что составляет не более 3% от величины Н. На всех рассматриваемых нами стадиях теплоэнерготехнологического комплекса давление изменяется незначительно (не более 2 атм), т.е. можно полагать Р » const и Н ' » const. Тогда все поправки на давление, входящие в левую и правую части уравнения теплового баланса, взаимно сократятся. Таким образом, можно не учитывать влияние давления на энтальпию (теплоемкость) газов, что не приведет к большим погрешностям.
Зависимость удельной энтальпии Н (кДж/кг) перегретого водяного пара от температуры t (°С) и давления Р (атм), удельной энтальпии насыщенного водяного пара и водяного конденсата от температуры получили аппроксимацией табличных данных из [57]:
Нп.п. = f(Р,t) (2.4)
Нн.п. = f(t) (2.5)
Нв.к. = f(t) (2.6)
Также аппроксимацией табличных данных из [82] получили зависимость теплоты конденсации метанола от температуры:
Нконд.м. = f(t) (2.7)
Уравнения (2.4-2.6) являются полиномами различных степеней.
Теплоемкость и энтальпию газовой смеси определяли по правилу аддитивности (y– мольная доля компонента) [30]:
 (2.8)
(2.8)
 (2.9)
(2.9)
3) вязкость и теплопроводность газов
Вязкость m (Па×с) и теплопроводность l (Вт/(м×К)) газов при повышенном давлении удобно определять следующим образом [59]:
m = m0 + mр (2.10)
l = l0 + lр (2.11)
где m0 и l0 – вязкость и теплопроводность при данной температуре, mр и lр – поправки на давление. Зависимость m0 и l0 от температуры получали аппроксимацией полиномами 2-й степени данных из [74,82]:
m0 = f(t) l0 = f(t)
Поправку mр вычисляли по методу Джосси-Стила-Тодоса, lр – по методу Стила-Тодоса [59]. В этих методах mр и lр являются функциями приведенной плотности (последняя зависит от Р и t процесса). Для расчета необходимо знать критические параметры веществ. Математический аппарат можно смотреть в [59]. Сравнение расчетных значений с практическими данными из [56,59,74,82] показывает, что погрешность составляет 1-4 %.
Вязкость mсм газовой смеси определяли по правилу Вильке [59] (формулы (1,2) Приложения III), теплопроводность смеси lсм – по методу Линдсея-Бромли (формулы (3-6) Приложения III):
4) плотность
Плотность газовой смеси rсм при повышенном давлении рассчитывали по правилу аддитивности:
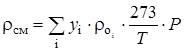 (2.12) Зависимость плотностей жидких воды и метанола получали аппроксимацией полиномами 2-й степени практических данных из [51]:
(2.12) Зависимость плотностей жидких воды и метанола получали аппроксимацией полиномами 2-й степени практических данных из [51]:
rв = f(t) rм = f(t)
5) давление насыщенных паров
Зависимость давления насыщенных паров воды от температуры получали аппроксимацией полиномом 2-й степени данных из [56]:
Рнп,в = f(t)
Таким образом, зависимости свойств веществ и их смесей от температуры и давления выражены в виде полиномов различных степеней, что очень удобно при реализации математической модели с помощью компьютерных программных средств.
2.4. Моделирование тепловых и физико-химических
процессов.
В основе рассматриваемого теплоэнерготехнологического комплекса лежат тепловые и физико-химические процессы. Причем процессы теплообмена часто протекают совместно с химическими реакциями и процессами конденсации. Поэтому формальное описание последних является неотъемлемой частью модели.
2.4.1. Моделирование химических реакций, протекающих в
теплоэнерготехнологическом комплексе.
В комплексном производстве аммиака и метанола протекают следующие реакции:
1) первичный риформинг метана
СН4 + Н2О « 3Н2 + СО, DН = 206,4 кДж (2.13)
СО + Н2О « Н2 + СО2, DН = - 41,2 кДж (2.14)
СnHm + nН2О « nCO + (2n + m)/2 H2, DН > 0 (2.15)
Гомологи метана реагируют по реакциям (2.15) до конца [74].
2) вторичный риформинг метана
О2 + 2Н2 « 2Н2О, DН = - 241,7 (2.16)
СН4 + Н2О « 3Н2 + СО, DН = 206,4 кДж
СО + Н2О « Н2 + СО2, DН = - 41,2 кДж
В соответствии с рекомендациями из [74] приняли, что сначала протекает реакция (2.16), причем кислород сгорает только с водородом, т.к. константа скорости реакции горения Н2 значительно больше, чем СО и СН4.
3) конверсия СО
СО + Н2О « Н2 + СО2, DН = - 41,2 кДж
Процесс осуществляется в две стадии, отличающиеся температурой проведения реакции [77].
4) очистка газа
Эта стадия включает в себя очистку от СО2 раствором моноэтаноламина согласно реакций (2.17,2.18) и тонкую очистку от СО и СО2 методом метанирования по реакциям (2.19,2.20).
CO2 + 2RNH2 + H2O « (RNH3)2CO3 (2.17)
CO2 + (RNH3)2CO3 + H2O « 2RNH3HCO3 (2.18)
СО + 3Н2 « СН4 + Н2О, DН < 0 (2.19) СО2 + 4Н2 « СН4 + 2Н2О, DН < 0 (2.20)
В балансовых расчетах количество СО2, поглощенного раствором МЭА, вычисляли по равновесному давлению СО2 над раствором МЭА на выходе газовой смеси из абсорбера, используя практические данные, приведенные в [74]. Растворимостью газов в МЭА-растворе пренебрегли по рекомендациям [19]. Согласно [74] реакции (2.19,2.20) считали необратимыми.
5) синтез аммиака
N2 + 3Н2 « 2NH3, DН < 0 (2.21)
6) синтез метанола описывается двумя независимыми реакциями. В [39,82,87] рассматривают реакции:
СО + 2Н2 « СН3ОН, DН = - 90,73 кДж (2.22)
СО2 + Н2 « СО + Н2О, DН = 41,2 кДж (2.23)
Розовский А.Я. и др. показывают [21,29,45,61-64,89], что более правильно рассматривать реакции:
СО2 + 3Н2 « СН3ОН + Н2О (2.24)
СО + Н2О « СО2 + Н2 (2.25)
Предлагаемые кинетические уравнения для этих реакций довольно сложны. В программе, описанной в [35], кинетика синтеза метанола может быть рассчитана на основе реакций (2.22,2.23) или реакций (2.24,2.25), а также и по третьему варианту на основе так называемого механизма смешанного типа. В [87] предлагается довольно простое кинетическое уравнение реакции (2.37) на медьсодержащем катализаторе, поэтому в математической модели рассматриваются реакции (2.22,2.23). При наличии достаточных данных разработанная модель легко адаптируется к реакциям (2.24,2.25).
7) реакции горения природного газа (т.е. метана и его гомологов):
CnH2n+2 + (3n+1)/2O2 = nCO2 + (n+1)H2O, DН < 0 (2.26)
При расчете реакций горения приняты следующие допущения:
- реакции горения протекают до конца;
- реакции окисления азота отсутствуют.
Материальный баланс реакций горения вычисляется покомпонентным сложением и вычитанием согласно стехиометрии реакций (2.26) с учетом принятого коэффициента избытка воздуха.
Тепловые эффекты реакций (2.26) известны из литературы [74].
Равновесие реакций (2.13, 2.14, 2.21) выражается через константу равновесия:
 , (2.27)
, (2.27)
где рi – парциальные давления продуктов реакции; pj – парциальные давления исходных веществ; m, n - стехиометрические коэффициенты. Зависимости констант равновесия от температуры известны [53,66,74]. Парциальное давление компонента газовой смеси определяли по закону Дальтона:
pi = Ni×Р (2.28)
где Ni – мольная доля компонента в равновесной газовой смеси; Р – общее давление в системе.
Закон Дальтона справедлив, если в области температур и давлений, при которых протекает процесс, ни один из компонентов газовой смеси не находится вблизи своей критической точки или линии конденсации. Из всех стадий производства аммиака параметры вторичной конверсии СО наиболее близки к линии конденсации воды. Анализ системы с помощью пакета ChemCAD показал, что область конденсации воды достаточно далека от области температур и давлений вторичной конверсии СО, поэтому для описания равновесия используются формулы (2.27,2.28). Кроме того, на основе этих же рассуждений приняли, что мольная доля компонента в газовой смеси выражается как:
 (2.29)
(2.29)
где Vi – объем компонента в газовой смеси; V - общий объем смеси. Все объемы выражены в нм3.
В случае, если в системе протекает несколько химических реакций, то, записав уравнение (2.27) для каждой реакции, получали систему уравнений. Методика, подобная предлагаемой нами, описана в [19].
Для корректности расчета по формуле (2.27) необходимо применить способ учета недостижения равновесия реакций Чтобы излишне не усложнять модель, был использован метод приближения к равновесию по температуре [23]:
DT = Тр - Тф (2.30)
где Тф – фактическая температура на выходе; Тр – равновесная температура (равновесное содержание целевого продукта реакции после реактора равнялось бы фактическому). Для экзотермических реакций DТ > 0, для эндотермических DТ < 0.
Метод позволяет формально оценить такие параметры, как неравномерное распределение газа по сечению катализатора, уменьшение каталитической активности катализатора и т.д. Конечно, метод имеет принципиальный недостаток: при изменении режима работы реактора меняется само значение DТ. Тем не менее, данный метод вполне применим для балансовых расчетов.
Уравнения для расчета констант равновесия реакций (2.13, 2.14, 2.21, 2.22, 2.23) и скоростей реакций (2.22,2.23) взяты из [66,74,82,87] и приведены в Приложении III.
2.4.2. Моделирование процессов конденсации.
В синтезе аммиака (см. рис. 7) присутствуют стадии аммиака, для их математического описания наиболее пригодны уравнения Михельса [66,74], приведенные в Приложении III (формулы 15-18).
В контуре метанола (см. рис. 8) присутствует стадия конденсации из газовой смеси метанола и воды. Для балансовых расчетов было принято [19], что при конденсации жидкая и газовая фаза находятся в равновесии. Тогда для каждого конденсирующегося компонента смеси справедливо следующее уравнение [59]:
yi×Fi×P = gi×xi×Pнас,i×Fs,i×Пi (2.31)
где y - мольная доля компонента в газовой фазе, рассчитанная для нормальных условий; F - коэффициент фугитивности компонента в газовой смеси; Р – общее давление в системе; g - коэффициент активности компонента в жидкой фазе; x – мольная доля компонента в жидкой фазе; Рнас – давление насыщенных паров компонента при заданной температуре без учета влияния давления; Fs - коэффициент фугитивности жидкости; П – поправка Пойнтинга, учитывающая влияние давления на объем сконденсировавшейся жидкости.
Уравнение (2.31) является общим и справедливо для любых давлений, температур и составов фаз.
Давление насыщенных паров Рнас определяли по уравнению Антуана [59]:
 (2.32)
(2.32)
где А,В,С – коэффициенты для данного компонента; Т – температура, К; Рнас – в мм рт. ст.
Поправка Пойнтинга была рассчитана по уравнению:

где VL(Т,Р) – функциональная зависимость мольного объема жидкости VL от температуры T и давления Р.
Подробнее математический аппарат можно смотреть в [59].
В программе MathCAD 2000 были рассчитаны поправки Пойнтинга для метанола и воды. Результаты расчета показали, что в диапазоне давлений 1 – 100 атм и температур 0 – 250 °С поправка Пойнтинга для метанола и воды равна единице с точностью до шестого знака после запятой.
Математический аппарат для вычисления коэффициентов фугитивности Ф громоздок и сложен, и поэтому здесь не приводится. Подробнее его можно смотреть в [59].
Для заданного состава газовой фазы в программе MathCAD 2000 были рассчитаны коэффициенты фугитивности метанола и воды. Результаты показали, что Ф для метанола и воды при 40-80 °С и 60-80 атм отличаются от единицы на 2-5 %. Однако включение блока расчета коэффициентов фугитивности в общую математическую модель требует очень сложных итерационных процедур, т.к. Ф зависит от равновесного состава газа, а последний сам зависит от Ф. Поэтому без больших погрешностей можно считать Ф равными единице как для метанола, так и для воды.
Коэффициент фугитивности жидкости Фs в [59] рекомендуют считать его равным 1 при температурах жидкостей, значительно ниже критической. В нашем случае температура процесса 40 – 50 °С, критическая температура метанола – 239,6 °С, воды – 374,3 °С. В соответствии с этим можно принять рекомендации и не рассчитывать Фs.
Коэффициенты активности компонентов в жидкой фазе рассчитывали по уравнению Ван-Лаара [59] для бинарной жидкой смеси:
 (2.33)
(2.33)
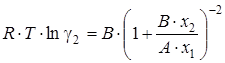 (2.34)
(2.34)
где xi – мольные доли компонентов; A и B - так называемые настраиваемые параметры, определяемые следующим образом. При бесконечном разбавлении x1 ® 0 или x2 ® 0, тогда уравнения (2.33,2.34) принимают вид:
 (2.35)
(2.35)
 (2.36)
(2.36)
где g¥ - коэффициент активности при бесконечном разбавлении, рассчитываемый по уравнению [59]:
 (2.37)
(2.37)
где a, e, z, q - коэффициенты для первичных спиртов, если растворитель – вода, или для воды, если растворитель – первичный спирт; N1, N2 – общее число углеродных атомов в молекулах 1 и 2 соответственно.
Коэффициенты a, e, z, q зависят от температуры, соответствующие табличные данные из [59] аппроксимированы полиномами 2-й степени: a = f(t), e = f(t), z = f(t), q = f(t).
С помощью пакета MathCAD 2000 рассчитали коэффициенты активности метанола и воды в их бинарном растворе. Результаты расчета приведены в таблице 1.
Таблица 1.
Результаты расчета коэффициентов активности
| Температура, °С | Коэффициент активности метанола | Коэффициент активности воды | ||||||||||
| Мольная доля метанола в растворе | Мольная доля воды в растворе | |||||||||||
| 0,001 | 0,2 | 0,4 | 0,6 | 0,8 | 0,999 | 0,001 | 0,2 | 0,4 | 0,6 | 0,8 | 0,999 | |
| 4,036 | 2,172 | 1,464 | 1,161 | 1,034 | 1,000 | 2,767 | 2,074 | 1,587 | 1,262 | 1,069 | 1,000 | |
| 4,134 | 2,203 | 1,475 | 1,165 | 1,034 | 1,000 | 2,822 | 2,102 | 1,600 | 1,267 | 1,070 | 1,000 | |
| 4,367 | 2,253 | 1,487 | 1,167 | 1,035 | 1,000 | 2,878 | 2,142 | 1,624 | 1,279 | 1,073 | 1,000 | |
| 4,757 | 2,322 | 1,498 | 1,168 | 1,034 | 1,000 | 2,935 | 2,192 | 1,659 | 1,298 | 1,079 | 1,000 |
Как видно, коэффициенты активности могут очень сильно отличаться от единицы, поэтому их учет необходим для корректного расчета.
Итак, приняв П = 1, Ф = 1, Фs = 1 и рассчитав g, записывали уравнение (2.31) для метанола и воды. Полученную систему уравнений необходимо решать методом итераций.
В случае конденсации только одного компонента его объем в выходящей газовой смеси Vвых,в (нм3/ч) определяли по формуле [19]:
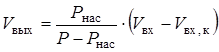 (2.38)
(2.38)
где Рнас - давление насыщенных паров конденсирующегося компонента при заданной температуре, ата; Vвх - общий объем входящего газа, нм3/ч; Vвх,к - объем конденсирующегося компонента на входе, нм3/ч.
Массовый расход жидкой фазы Gж (кг/ч) находили по формуле:
Gж = (Vвх,в - Vвых,в)×М/22,4 (2.39)
Таким образом, в разделах 2.4.1. и 2.4.2. приведен математический аппарат, формализующий химические превращения веществ и изменение их агрегатных состояний. Перейдем теперь к вопросу формализации процессов обмена тепловой энергией.
2.4.3. Моделирование процессов теплообмена.
а) Основные положения и принятые допущения.
При предварительной оценке стоимости проекта, планировке размещения оборудования и компоновке агрегата нет необходимости детально конструировать теплообменную аппаратуру, а вполне достаточно провести поверочные расчеты. Детальные расчеты проводят только после того, как по результатам предварительных исследований будет оценена экономическая эффективность проекта в целом и будут даны определенные рекомендации о размещении оборудования [76]. Поэтому в математическую модель процесса совместного производства были включены приближенные поверочные расчеты теплообменных аппаратов. В ходе этих расчетов для заранее выбранного стандартного теплообменника вычисляются следующие параметры:
- тепловая нагрузка Q (Вт);
- средняя разность температур Dtср (°С);
- коэффициент теплопередачи К (Вт/(м2×К));
- необходимая поверхность теплообмена F (м2).
Все указанные величины связаны общим уравнением теплопередачи, записанным в интегральной форме [75]:
Q = K×F×Dtср (2.40)
При приближенных расчетах теплообменной аппаратуры приняты следующие основные допущения [75,76]:
- любая часть потока, поступающего в теплообменник, в одинаковой степени участвует в теплообмене с поверхностью;
- теплообменник работает в стационарном режиме;
- коэффициент теплопередачи постоянен по всей поверхности;
- потери теплоты в окружающую среду или приток теплоты из среды пренебрежимо малы;
- продольным тепловым потоком можно пренебречь;
- схема движения потоков представляет собой либо чистый прямоток, либо чистый противоток.
Кроме того, на стадии проектирования считали, что термические сопротивления отложений, возникающих в ходе эксплуатации, равны нулю.
Не проводился также расчет гидравлического сопротивления теплообменных аппаратов и трубопроводов, т.к. это имеет смысл делать только после составления проекта размещения оборудования. Предварительно можно сказать, что кожухотрубчатые теплообменники создают сопротивления, ничтожно малые по сравнению с давлениями, применяемыми в рассматриваемой нами схеме.
При применении кожухотрубчатых теплообменников важно правильно выбрать, какая из двух сред будет двигаться через трубное пространство, а какая – через межтрубное. Жидкая смесь метанола и воды обладает сильными коррозионными свойствами [82], поэтому требуется применение специальных марок нержавеющей стали. Исходя из этого, газовую смесь, из которой конденсируются метанол и вода, выгоднее пропускать через трубное пространство, т.к. на изготовление трубного пучка требуется меньше стали, чем на изготовление кожуха. Кроме того, при выходе из строя трубок их можно просто отглушить и продолжать эксплуатацию теплообменника, что и применяется на практике.
Если ни одна из сред не обладает сильными коррозионными свойствами, то через межтрубное пространство направляют среду с меньшим давлением, т.к. в этом случае требуется меньше стали на изготовление теплообменника, как это рекомендуется в [75,76].
Также модель каждого теплообменника должна включать расчет на прочность. Данный расчет выполняется по методике, приведенной в [48], и в диссертации не приводится.
б) Тепловые нагрузки и коэффициенты теплоотдачи.
Величина тепловой нагрузки аппарата определяется из его теплового баланса. Этому вопросу посвящен раздел 2.5.
Как известно, наибольшие погрешности в расчетах возникают при определении коэффициентов теплопередачи К и теплоотдачи a, связанных соотношением [48]:
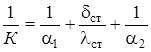 (2.41)
(2.41)
где a1 и a2 - коэффициенты теплоотдачи со стороны теплоносителей, Вт/(м2×К); dст - толщина стенки, м; lст - коэффициент теплопроводности материала стенки, Вт/(м×К).
Уравнение (2.41) справедливо для теплопередачи через цилиндрическую стенку, если Rн/Rвн < 2 (Rн/Rвн - соответственно наружный и внутренний радиусы трубы, м) [24], что справедливо для всех рассматриваемых нами теплообменников.
Широко распространены таблицы значений коэффициентов теплоотдачи для различных случаев [48,75,76,77]. Отрицательная сторона в использовании этих таблиц заключается в том, что в них включены далеко не все возможные интервалы значений давлений, температур и соответствующих им значений a. Поэтому в нашей работе возникает необходимость вычисления коэффициентов теплоотдачи.
При движении газа (жидкости) в трубках коэффициент теплоотдачи определяли по формулам [33,48,77]:
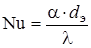 (2.42)
(2.42)
Re ³ 10000: 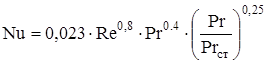 (2.43)
(2.43)
2300 < Re < 10000:  (2.44)
(2.44)
Re £ 2300, Gr×Pr > 500000:
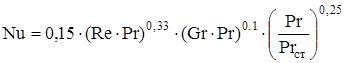 (2.45)
(2.45)
Re £ 2300, Gr×Pr £ 500000, 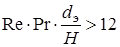 :
:
 (2.46)
(2.46)
Re £ 2300, Gr×Pr £ 500000,  :
:
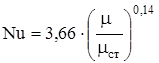 (2.47)
(2.47)
Re = w× dэ×r/m (2.48)
Pr = c×m /l (2.49)
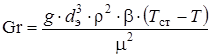 (2.50)
(2.50)
 (2.51)
(2.51)
где Nu, Re, Pr, Gr – критерии Нуссельта, Рейнольдса, Прандтля, Грасгофа; dэ – эквивалентный диаметр, м; l, m, r, с – теплопроводность (Вт/(м×К)), вязкость (Па×с), плотность (кг/м3) и теплоемкость (Дж/(кг×К)) среды; Н – длина трубы, м; w – скорость движения среды, м/с; b - коэффициент объемного расширения смеси; r0 – плотность газовой смеси при нормальных условиях, кг/м3; Prст, mсм,ст – величины, рассчитанные при температуре стенки.
Эквивалентный диаметр в указанных формулах равен внутреннему диаметру трубы.
При движении газа (жидкости) в межтрубном пространстве кожухотрубчатого теплообменника с сегментными перегородками критерий Нуссельта определяли следующим образом [48]:
при Re ³ 1000:  (2.52)
(2.52)
при Re < 1000: 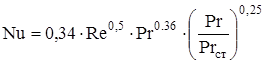 (2.53)
(2.53)
В [33] утверждается, что при развитом пузырьковом кипении интенсивность тепловыделения растет при увеличении плотности теплового потока и давления и практически не зависит от размеров и формы теплоотдающей поверхности. Эта зависимость характерна для любых жидкостей, смачивающих поверхность нагрева. Для чистой воды коэффициент теплоотдачи при кипении определяли по формуле [77]:
aв = 3,14×q0.7×Pнп0,15 (2.54)
где Рнп – давление насыщенных паров воды, ати; q – удельная тепловая нагрузка, Вт/м2.
В рассматриваемом нами процессе конденсация происходит в присутствии неконденсируемых компонентов, т.е. при неизотермических условиях. Согласно [76] при концентрации неконденсируемых компонентов снеконд > 80 % используется коэффициент теплоотдачи, рассчитанный для газовой смеси. Данное условие выполняется при конденсации метанола-сырца (снеконд » 95 %). При конденсации воды снеконд » 60-70 %, но в рассмотренной нами литературе нет надежных данных для определения a в таких случаях, поэтому и здесь a вычисляли как для газовой смеси.
По рекомендациям [76] в приближенных расчетах коэффициенты теплоотдачи определялись при средних температурах теплоносителей.
в) Определение средней разности температур и поверхности теплопередачи.
В аппаратах с противоточным движением теплоносителей Dtср при прочих равных условиях больше, чем в случае прямотока, поэтому все теплообменники будем рассчитывать как противоточные. В этом случае среднюю разность температур потоков вычисляли как среднелогарифмическую между большей и меньшей разностями температур теплоносителей на концах аппарата [48]:
 (2.55)
(2.55)
После определения Q, K и Dtср из уравнения (2.40) определяется необходимую поверхность теплообмена F. Поскольку рассматриваются поверочные расчеты, то выбранный заранее теплообменник обладает фактической поверхностью теплообмена Fф. Таким образом, возникает некоторый запас поверхности:
 (2.56)
(2.56)
Если DF < 0, то выбирали другой теплообменник и повторяли расчет. Нормальным считается запас поверхности 5-10 % [48].
Итак, выше был рассмотрен основной математический аппарат для расчета процессов теплообмена, проводимых в стандартном оборудовании.
2.4.4. Моделирование процессов теплообмена, протекающих
при синтезе метанола.
Как было показано в разделе 1.3, набольшее значение при организации теплообмена в производстве метанола имеет вопрос утилизации тепла реакций синтеза. В разделе 2.2 указывалось, что процесс синтеза метанола необходимо рассматривать на уровне области аппарата. В реакторе такой областью является микрослой катализатора в трубке.
В ходе моделирования предположили, что процесс в реакторе протекает в режиме идеального вытеснения. Практически это означает, что радиальными градиентами температур и концентраций в слое, а также продольной теплопроводностью и диффузией можно пренебречь [19]. Далее дана оценка корректности такого допущения.
Как известно [20], возникновение радиального градиента температуры зависит от условий теплоотвода, определяемых критерием Био Bi, и интенсивности тепловыделения, зависящей от разности температур между слоем катализатора и ''холодильником'' qср - qх (здесь q - безразмерные температуры). Согласно [20] профиль температуры по радиусу будет близок к плоскому, если:
Bi×( qср - qх) < 1
Там же [20] указывается, что для синтеза метанола комплекс Bi×( qср - qх) равен приблизительно 0,07. Плоский профиль температуры означает равенство скоростей реакций в радиальном направлении. Следовательно, радиальными градиентами концентраций также можно пренебречь.
Многочисленные расчеты, проведенные в широком интервале изменения всех параметров, показали, что если критерий Пекле Ре > 200, то продольный перенос можно не учитывать [20]. Расчет по модели идеального вытеснения в рассматриваемом нами процессе дает следующие значения: Ре = 1780-1940 (Ре изменяется по высоте трубы).
Таким образом, показано, что применение модели идеального вытеснения не приведет к существенным ошибкам.
При разработке математической модели реактора было принято, что процесс протекает во всех трубках реактора одинаково. Поэтому рассматривался процесс в одной трубке сечением S, через которое проходит газовая смесь. Координата по направлению потока – длина трубки l. По мере прохождения потока реакционной смеси вследствие химических превращений изменяются концентрации компонентов и температура потока. Одновременно происходит теплообмен через стенку с кипящей в межтрубном пространстве водой. Конвективный теплообмен описывали законом Ньютона-Рихмана [24,33]:
dQ = a×dF ×(Tг – Тст),
а теплообмен путем теплопроводности – законом Фурье [24,33]:

Исходя из вышеописанных положений, для элементарного объема – слоя высотой dl и объемом dv = S×dl - процесс описали следующей системой уравнений:
 dn1 = r1×dv (2.57)
dn1 = r1×dv (2.57)
dn2 = r2×dv (2.58)
N×cp×dT = (Q1× dn1 – Q2× dn2) - aг×dFст,вн×(Tг – Тст,вн) (2.59)
aг×dFст,вн×(Tг – Тст,вн) =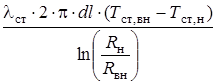 (2.60)
(2.60)
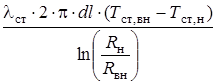 = aв×dFст,н×(Tст,н – Тв) (2.61)
= aв×dFст,н×(Tст,н – Тв) (2.61)
где dn1 – количество метанола, образовавшегося по реакции (2.22), моль;
dn2 – количество СО2, прореагировавшего по реакции (2.23), моль;
r1 и r2 – скорости реакций (2.22) и (2.23), моль/с;
N – количество моль газовой смеси на входе в слой, моль;
ср – теплоемкость газовой смеси, Дж/(моль×К);
dТ – изменение температуры в слое, К;
Q1 и Q2 – тепловые эффекты реакций (2.22) и (2.23), Дж/моль;
aг – коэффициент теплоотдачи от газовой смеси к стенке трубы, Вт/(м2×К);
aв – коэффициент теплоотдачи от кипящей воды к стенке трубы, Вт/(м2×К);
lст - коэффициент теплопроводности материала труб, Вт/(м×К);
dст – толщина стенки, м;
dFст,вн, dFст,н – внутренняя и наружная поверхности элемента трубы, соответствующего слою катализатора, м2;
dl – высота элемента трубы, м;
Rн и Rвн – наружный и внутренний радиусы трубы, м;
Тг – температура газовой смеси на входе в слой, К;
Тст,вн и Тст,н – температуры внутренней и наружной стенок трубы, К;
Тв – температура воды, кипящей в межтрубном пространстве, К.
Уравнения (2.57,2.58) описывают материальный баланс в слое катализатора, уравнение (2.59) – тепловой баланс в слое, уравнения (2.60,2.61) - перенос тепла от газовой смеси к кипящей в межтрубном пространстве воде.
Подобная система уравнений предложена в [65] для адиабатического процесса синтеза метанола в полочном реакторе. В этой работе авторы считают, что при синтезе метанола необходимо учитывать внутридиффузионное торможение, т.к. в зерне существуют градиенты температуры и концентраций. В математических моделях это отражается введением понятия степень использования внутренней поверхности h [19,20]. Основная сложность расчета процесса на зерне состоит в надежном определении коэффициентов диффузии реагентов (напомним, что в рассматриваемом процессе газовая смесь состоит из 8 компонентов) и порядка реакции. С другой стороны, в [29] доказывается, что влияние внешне- и внутридиффузионного торможений отсутствует, поэтому реакции протекают в кинетической области. Согласно [19] процесс в пористом зерне катализатора можно считать изотермическим, т.к. интенсивность переноса тепла примерно на два порядка превышает интенсивность переноса вещества. В связи с этим в нашей модели допустимо согласиться с авторами [19,29] и не рассчитывать процесс на зерне, т.е. принять h = 1. При обоснованной необходимости расчет h может быть включен в математическую модель в виде блока.
При расчете теплопередачи были приняты следующие допущения [75,76]:
- реактор работает в стационарном режиме;
- потери теплоты в окружающую среду пренебрежимо малы;
- вода в межтрубном пространстве кипит по всей высоте реактора при постоянной температуре.
Система уравнений (2.57-2.61) решается путем замены дифференциалов на конечные разности (метод Рунге-Кутта), т.е. рассматривается конечный объем слоя Dv.
При этом появляется еще несколько допущений:
- коэффициенты теплоотдачи постоянны на всей поверхности рассматриваемого слоя объемом Dv;
- в стенке элемента трубы, соответствующего рассматриваемому слою объемом Dv, градиент температуры существует только в направлении от внутренней поверхности к внешней, а по высоте температура стенки постоянна;
- свойства смеси рассчитываются при условиях входа в слой и по высоте слоя считаются постоянными.
Погрешности, связанные с указанными допущениями, тем меньше, чем меньше разность температур на входе и выходе из слоя, которая зависит, в свою очередь, от выбранного шага по высоте трубы Dl (и, соответственно, объема Dv). Таким образом, шаг по высоте должен быть не слишком большим, чтобы разность температуры по высоте была минимальна, но и не слишком маленьким, чтобы излишне не увеличивать объем расчетов. На основании этих рассуждений шаг по длине слоя был принят равным 0,1 м. Корректность такого предположения обсуждается в Главе 4.
Общий коэффициент теплоотдачи aоб от слоя к стенке учитывает пристенный коэффициент теплоотдачи aст и теплопроводность слоя. Причем согласно [20]:
aоб = aст /(1 + 0,25Bi)
По данным из [20] для синтеза метанола Bi = 0,09, тогда aоб = 0,978 aст. Таким образом, влияние теплопроводности слоя мало и под величиной коэффициента теплоотдачи понимался общий коэффициент теплоотдачи от слоя к стенке, величину его вычисляли по формулам (2.42-2.47).
При кипении воды коэффициент теплоотдачи определяли по формуле (2.54). Удельную тепловую нагрузку находили из выражения:
q = aг×(Тг - Тст,в) (2.62)
Для каждой жидкости существует критическая тепловая нагрузка, при которой пузырьковый режим кипения переходит в пленочный, и коэффициент теплоотдачи резко падает [76]. Для воды qкр = 1,16×106 Вт/м2 [48,77]. Расчет по приведенной модели показал, что в рассматриваемом процессе тепловая нагрузка не превышает 12500 Вт/м2. Таким образом, перехода к пленочному режиму не происходит.
Теплопроводность материала трубы определялась при температуре внутренней стенки. Это не вызывает погрешностей, т.к. по результатам расчета температуры внутренней и наружной стенок отличаются не более чем на 4 °С.
Для вычисления mm,ст, Prст, lст и q нужно до начала расчета слоя знать температуру внутренней стенки. В первом слое приняли Тст,вн = (Тг + Тв)/2. Далее определяется точное значение Тст,вн в первом слое, а для каждого последующего слоя для вычисления mm,ст, Prст, lст и q значение Тст,вн принимали из предыдущего слоя. При расчете по модели оказалось, что при переходе к каждому следующему слою изменение Тст,вн не превышает 1,5 °С, поэтому использованный нами прием не вызвал больших погрешностей.
2.5. Моделирование тепловых и материальных балансов.
При рассмотрении математического аппарата для описания балансов условно выделили 3 крупных блока: переработка природного газа, производство и потребление пара высокого давления, производство основных продуктов (аммиака и метанола).
2.5.1. Тепловые и материальные балансы стадии переработки
природного газа
Материальный баланс процессов с газовыми реакциями рассчитывают с помощью уравнений типа (2.27). Для стадии первичного риформинга указанное уравнение записали для каждой из реакций (2.13, 2.14). Решение полученной системы из двух уравнений методом итераций дает сводимость материального баланса [19]. Тепловой баланс на этой стадии не рассматривался, т.к. температура на выходе, определяющая степень превращения реагентов, является регулируемым параметром.
Вторичный риформинг – адиабатический процесс, т.е. температура на выходе и степень превращения взаимозависимы. Следовательно, к системе уравнений, записанной для реакций (2.13, 2.14) аналогично первичному риформингу, необходимо добавить уравнение теплового баланса [19]:
Q1 + Q2 + Q3 + Q4 = Q5 + Q6 +Q7 (2.63)
где Q1 - физическое тепло паро-газовой смеси на входе в реактор; Q2 - физическое тепло воздуха (точнее, паро-воздушной смеси) на входе в реактор; Q3 - тепловой эффект реакции (2.16); Q4 - тепловой эффект реакции (2.14); Q5 - физическое тепло газовой смеси на выходе из реактора; Q6 - тепловой эффект реакции (2.13); Q7 - потери тепла (приняли 3% от прихода согласно [53]). Все величины выражены в кДж.
Полученная система из 3-х уравнений решается итерационными методами. Результатом расчета является состав и температура газовой смеси на выходе из аппарата вторичного риформинга.
Конверсия СО – также адиабатический процесс, поэтому на каждой из двух стадий решали систему из двух уравнений: уравнение материального баланса типа (2.27) и уравнение теплового баланса
Q1 + Q2 = Q3 + Q4 (2.64)
где Q1 - физическое тепло газовой смеси на входе в реактор; Q2 - тепловой
эффект реакции (2.14); Q3 - физическое тепло газовой смеси на выходе из реактора; Q4 - потери тепла (приняли 2 % от прихода согласно [53]). Все величины выражены в кДж. Результатом расчета является состав и температура газовой смеси на выходе из аппаратов конверсии.
За равновесную температуру абсорбции приняли температуру глубокорегенерированного раствора МЭА, подаваемого на верх абсорбера. Равновесное давление СО2 над раствором определяли по практическим данным [74]. Материальный баланс вычисляли по уравнению (2.38). Реакции (2.19,2.20) протекают до конца, поэтому материальный баланс стадии метанирования рассчитывался покомпонентным сложением и вычитанием согласно стехиометрии реакций. Результатом расчета является состав газовой фазы после очистки. Так как оба процесса (абсорбция и метанирование) протекают практически при изотермических условиях, то тепловой баланс на этих стадиях не рассматривали.
2.5.2. Баланс производства и потребления пара высокого
давления.
Тепловой баланс каждого из котлов-утилизаторов (см. рис. 8) рассчитывали по уравнению:
Q1 + Q2 = Q3 + Q4 (2.64)
где Q1 - физическое тепло паро-газовой смеси на входе в котлы; Q2 - физическое тепло паро-газовой смеси на выходе из котлов; Q3 - тепло испарения воды; Q4 - потери тепла в окружающую среду. Из уравнения (2.64) вычисляется величина Q3. Все величины – в кДж. Количество образовавшегося пара находили по формуле:
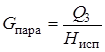 (2.65)
(2.65)
где Нисп - теплота испарения воды, кДж/кг.
Тепловой баланс вспомогательного котла описывали уравнением:
Q1 + Q2 + Q3 = Q4 + Q5 + Q6 (2.66)
где Q1 - физическое тепло топливного природного газа на входе в котел; Q2 - физическое тепло воздуха на горение; Q3 - тепло реакций (2.26); Q4 - физическое тепло уходящих ДГ; Q5 - тепло испарения воды; Q6 - потери тепла в окружающую среду.
Количество вырабатываемого во вспомогательном котле пара определяется балансом выработки и потребления пара давлением 105 ата (см. рис. 10), а из баланса котла необходимо определить расход природного газа. Для вычисления величин Q1, Q2, Q3 и Q4 в уравнении (2.66) необходимо заранее задать какой-либо расход природного газа, а затем проверить расчетом сходимость уравнения, поэтому и здесь необходимо применять итерационную процедуру.
Расход пара на турбину Gпара (кг/с) рассчитывали по формуле [86]:
 (2.67)
(2.67)
где Nт – необходимая мощность турбины, кВт; Нвх, Нвых – энтальпии пара на входе и выходе из турбины, кДж/кг.
Величину Nт определяли по формуле [86]:
 (2.68)
(2.68)
где Nк – необходимая мощность компрессора, кВт; hт – к.п.д. турбины; hк – к.п.д. компрессора.
2.5.3. Тепловые и материальные балансы производства
основных продуктов.
Тепловой баланс стадии синтеза аммиака не рассматривался, т.к. при моделировании этой стадии важно вычислить производительность по аммиаку. Материальный баланс процессов конденсации аммиака описывали с помощью уравнений Михельса (см. Приложение III), синтеза аммиака - с помощью уравнения типа (2.27).
Мощность компрессора Nк определяли по формулам [86]:
Nк = Gг×Lуд (2.69)
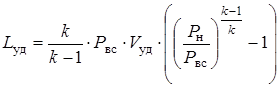 (2.70)
(2.70)
где Gг – массовый расход газа через компрессор, кг/с; Lуд – удельная работа, Дж/кг; k – показатель политропы; Vуд – удельный объем газа на всасе, м3/кг; Рвс, Рн – давления на всасе и нагнетании, Па.
Результатами расчета блока синтеза аммиака являются выработка аммиака и необходимая мощность компрессора.
Перейдем к рассмотрению блока синтеза метанола. Материальный баланс стадии конденсации воды (см. рис. 8) сводится решением уравнения (2.38), стадии конденсации метанола-сырца – решением методом итераций системы из двух уравнений типа (2.31), записанных для двух веществ – метанола и воды. Материальный баланс стадии синтеза метанола вытекает из расчета реактора по методике, изложенной в разделе 2.4.5.
Тепловой баланс реактора выразили уравнением:
Q1 + Q2 = Q3 + Q4 (2.71)
где Q1 - физическое тепло газовой смеси на входе в реактор; Q2 - тепловые эффекты реакций (2.22),(2.23); Q3 - физическое тепло газовой смеси на выходе из реактора; Q4 - тепло, подлежащее утилизации. Количество выработанного пара G (кг/ч), находили по формуле:
G = Q4/(Нп – Нв) (2.72)
где Нп и Нв – энтальпии пара на выходе из реактора и воды на входе в реактор, Дж/кг.
В Главе 4 будут рассмотрены вопросы организации теплообмена в контуре метанола. Независимо от способа организации схема теплообмена будет включать набор аппаратов, для которых характерны типичные уравнения теплового баланса. На рис. 11 условно изображен теплообменный аппарат.
| Рис. 11. Схема элемента с теплообменом 1,2,3,4 – потоки |
Пусть в результате охлаждения потока 1-2 из него конденсируется жидкая фаза. Тогда уравнение теплового баланса записывали следующим образом:
Q1 + Q2 = Q3 + Q4 (2.73)
где Q1 – теплота охлаждения сухого газа потока 1-2; Q2 – теплота охлаждения и фазового перехода конденсирующихся компонентов потока 1-2; Q3 – теплота нагрева потока 3-4, Q4 - потери тепла.
Во всех рассматриваемых случаях известны состав и температура потоков 1 и 3. Если неизвестная величина - температура потока 4, то ее находили из уравнения (2.73). Так как для вычисления энтальпии потока 4 нужно заранее знать температуру потока, то уравнение (2.73) решается итерационным методом.
Если неизвестны температура и состав потока 2, то уравнение (2.73) записывали совместно с уравнениями материального баланса (2.31) или (2.38). Полученную систему уравнений решали итерационными методами, т.к. температура, состав и энтальпия потока 2 взаимозависимы.
Если в аппарате не происходит никаких фазовых переходов, то тепловой баланс выражали простым уравнением:
Q1 + Q2 = Q3 + Q4 + Q5 (2.74)
где Q1,Q2,Q3,Q4 - энтальпии соответствующих потоков; Q5 – потери тепла.
В главе 4 будет рассматриваться возможность применения огневого подогревателя для перегрева пара, вырабатываемого в реакторе синтеза метанола. Тепловой баланс подогревателя записывали следующим образом:
Q1 + Q2 + Q3 + Q4 = Q5 + Q6 (2.75)
где Q1 - физическое тепло насыщенного пара на входе; Q2 - физическое тепло топливного природного газа на входе; Q3 - физическое тепло воздуха (для горения) на входе; Q4 - теплота реакций горения природного газа; Q5 - физическое тепло перегретого пара на выходе; Q6 - физическое тепло дымовых газов на выходе. Из уравнения (2.75) находили необходимый расход топливного природного газа.
2.6. Моделирование схем с рециркулирующими потоками.
Как было показано выше (см. рис. 8,9), блоки синтеза метанола и аммиака имеют рециркулирующие потоки. Моделирование структуры теплоэнерготехнологического комплекса, имеющего рециркулирующие потоки - весьма сложная задача, т.к. приходиться применять итерационные методы. Представленная здесь методика моделирования описана в [19].
| Рис. 12. Структура подсистемы с рециклом |
 Структура подсистемы теплоэнерготехнологического комплекса с рециклом условно представлена на рис. 12а. Состояние потока на входе в элемент I зависит от входного потока 0 и состояния потока 4 после ответвления его от потока 3 за элементом II. Чтобы рассчитать элемент I, нужно уже знать результат расчета элемента II, что невозможно. Поэтому разрывают связи рецикла, как показано на рис. 12б. Структура становится линейной с неизвестным состоянием Х01 входного потока 01. Задают какие-то параметры его состояния и рассчитывают полученную линейную структуру. По окончании расчета состояния потоков 01 и 4 должны совпадать, в противном случае задают новые значения Х01 и повторяют расчет до указанного совпадения. Конечно, добиться точного равенства Х01 = Y4 невозможно, поэтому стараются минимизировать разность между ними:
Структура подсистемы теплоэнерготехнологического комплекса с рециклом условно представлена на рис. 12а. Состояние потока на входе в элемент I зависит от входного потока 0 и состояния потока 4 после ответвления его от потока 3 за элементом II. Чтобы рассчитать элемент I, нужно уже знать результат расчета элемента II, что невозможно. Поэтому разрывают связи рецикла, как показано на рис. 12б. Структура становится линейной с неизвестным состоянием Х01 входного потока 01. Задают какие-то параметры его состояния и рассчитывают полученную линейную структуру. По окончании расчета состояния потоков 01 и 4 должны совпадать, в противном случае задают новые значения Х01 и повторяют расчет до указанного совпадения. Конечно, добиться точного равенства Х01 = Y4 невозможно, поэтому стараются минимизировать разность между ними:
D = ½Х01 – Y4½< e
где e - точность расчета.
Точность расчета удобнее оценивать не по разностям, как в описанной выше методике, а по соотношениям вида:
e = Х01/ Y4
Очевидно, что e должно быть равно 1,0 с какой-либо заданной точностью.
На рис. 13 показана структурная схема блока синтеза метанола. На схеме показана точка ''разрыва''.

Рис. 13. Структурная схема контура метанола-сырца.
В балансовых расчетах не учитывалась растворимость газов в жидкой фазе ввиду их малого количества – по проверочному расчету не более 0,1 % от общего количества циркулирующего газа.
Объем циркулирующего газа должен быть фиксирован:
Vцирк = K×Vисх (2.76)
где K – кратность циркуляции; Vисх – объем исходного (свежего) газа.
Модель не накладывает никаких ограничений на объем продувочных газов (конечно, он не может быть отрицательным), т.к. они возвращаются в агрегат аммиака.
Структурная блока синтеза аммиака представлена на рис. 14.

Рис. 14. Структурная схема стадии синтеза аммиака.
В производстве процессы смешения свежего и циркулирующего газа и вторичной конденсации аммиака протекают в одном и том же аппарате одновременно. Однако разделение этих процессов в математической модели не приведет к существенным ошибкам.
В действующем агрегате аммиака объем продувочных газов ограничен технологическим регламентом (6000 – 8000 нм3/ч) [77]. Поэтому в этой части модель контура аммиака противоположна модели контура метанола: объем продувочных газов изменяется в заданных пределах, а объем циркулирующего газа получается как результат моделирования.
Как и в модели контура метанола, здесь растворение газов в жидком аммиаке не учитывается по тем же причинам.
Математический аппарат расчета схем с рециклами рассматривается в Главе 3 совместно с алгоритмами его реализации.
2.7. Описание экономической модели
теплоэнерготехнологического комплекса.
Экономический анализ и обоснование инвестиционных проектов требует большого объема сложных и громоздких расчетов. Перед автором диссертации ставилась задача не разработки подробной экономической модели, а создания расчетного блока, связанного с общей моделью комплексного производства. В связи с этим некоторые экономические величины приняты ориентировочно (например, объем инвестиционных вложений), другие носят прогнозный характер (курс доллара, рост цены на природный газ и др.). Указанный расчетный блок должен автоматически вычислять некоторые экономические параметры при изменении исходных данных, определяющих состояние самого теплоэнерготехнологического комплекса.
Согласно схеме на рис. 10 после расчета сводимости балансов и рециркулирующих потоков модель делает выборку важнейших показателей процесса, на основе которых проводится экономический расчет. К таким показателям относятся:
1) потребление природного газа на производство;
2) потребление природного газа для выработки пара высокого давления во вспомогательном котле;
3) расход электроэнергии в контуре метанола;
4) выработка пара среднего давления в реакторе метанола;
5) выработка пара низкого давления в контуре метанола;
6) расход оборотной воды в контур метанола;
7) выработка аммиака;
8) выработка метанола.
Показатели 1,2 и 3 в наибольшей степени определяют себестоимость продукции. Показатели 4 и 5 определяют расход питательной воды на выработку пара и вместе с показателем 5 также существенно влияют на себестоимость. Показатели 3 и 5 взаимосвязаны, т.к. электроэнергия тратится на привод насосов и вентиляторов водооборотного цикла. Параметры 7 и 8 определяют выручку от продажи продукции.
Экономическая модель построена на основе методик, изложенных в [46,55], и рассчитывает следующие основные параметры:
1) себестоимость продукции;
2) суммарная выручка от реализации продукции;
3) текущие затраты;
4) валовая прибыль;
5) прибыль для распределения;
6) чистый денежный поток;
7) внутренняя норма прибыли;
8) чистый приведенный эффект (чистый дисконтированный доход);
9) срок окупаемости.
Показатели 2-7 рассчитываются по годам реализации проекта и по нарастающей величине.
При расчете себестоимости продукции применили следующий метод. Все дополнительные затраты на производство метанола отнесены на себестоимость аммиака, поэтому последняя увеличивается. С другой стороны, за счет реализации побочного продукта (метанола) себестоимость аммиака значительно снижается. Затраты на заработную плату общецеховые и общезаводские расходы были приняты по калькуляции себестоимости продукции базисного цеха ''Аммиак – 2'' ОАО «Череповецкий «Азот».
В диссертационной работе не ставилась задача расчета объема инвестиционных вложений, поэтому их величина ориентировочно принята согласно [1,3], причем она изменяется в зависимости от объема производства метанола путем введения соответствующего коэффициента. Модель предусматривает возможность финансирования инвестиционного проекта частично за счет кредита, частично за счет собственных средств, причем соотношение кредита и собственных средств можно изменять. Принято, что весь объем кредита получен в первый год реализации проекта.
Проект рассчитан на 10 лет, из них первый год отводится на сооружение и подключение блока синтеза метанола к существующему аммиачному агрегату, а последующие 9 лет производство продукции будет осуществляться в полном проектном объеме.
Модель предусматривает эскалацию (прогнозируемый рост) цен на природный газ, другие вспомогательные материалы, аммиак и метанол.
Выводы по главе:
1. В главе 2 определены цель моделирования и тип разработанной концептуальной модели: она является балансовой, детерминированной, статической и удовлетворяет принципу информационной достаточности.
2. Проведена декомпозиция объекта исследования с выделением относительно независимых подсистем и установлением существенных связей между ними. Для каждой подсистемы и всей системы в целом определены уровни построения математической модели от описания свойств веществ до расчета экономических показателей производства.
3. Разделы 2.3-2.7 главы посвящены формализации объекта исследования. Для этого использован математический аппарат, описывающий: свойства веществ и их смесей; теплообменные и физико-химические процессы; тепловые и материальные балансы отдельных стадий теплоэнерготехнологического комплекса, балансы по выработке и потреблению энергоносителей. Критически обсуждаются все допущения, принятые в процессе формализации. Указывается, что при необходимости математическая модель может быть расширена и дополнена включением блоков, описывающих те или иные процессы (например, процессы на зерне катализатора). Дана краткая характеристика используемой экономической модели.
4. Показано, что многие процессы и стадии теплоэнерготехнологического комплекса описываются уравнениями и системами уравнений, которые необходимо решать итерационными методами. В связи с этим должен быть составлен четкий алгоритм моделирования.
Глава 3. АЛГОРИТМ МОДЕЛИРОВАНИЯ ТЕПЛОЭНЕРГОТЕХНОЛОГИЧЕСКОГО КОМПЛЕКСА И ЕГО РЕАЛИЗАЦИЯ НА ЭВМ.
Приведенные ниже алгоритмы расчета позволяют реализовать на ЭВМ методику математического моделирования теплоэнерготехнологического комплекса, основные принципы которой описаны в Главе 2.
3.1. Алгоритмы моделирования блока переработки
природного газа.
В аппарат первичного риформинга входит два материальных потока: пар и природный газ (см. рис. 8). Расход и состав образующейся газовой смеси определяется покомпонентным сложением с учетом формулы (2.29). Температура на выходе – регулируемый параметр, поэтому ее значение задается до начала расчета.
Из [74] известно, что в первичном риформинге протекают две независимые равновесные реакции (2.13) и (2.14). Они описываются системой из двух уравнений типа (2.27), которая решается итерационным методом [19]. Пусть a – количество СН4, прореагировавшего по реакции (2.13), b – количество СО прореагировавшего по реакции (2.14) (в нм3/ч). Для первого шага итерации были заданы некоторые начальные значения a и b. Тогда, считая, что реакции (2.15) протекают до конца, операциями покомпонентного сложения и вычитания рассчитали состав равновесной газовой смеси. Затем, вычислив константы равновесия реакций (Кр1 и Кр2) при температуре Тр (формулы (7,8) Приложения III), записали систему уравнений в следующем виде (с учетом формул (2.28-2.29):

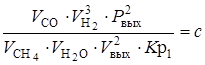 (3.1)
(3.1)
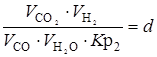 (3.2)
(3.2)
где Vi – объемы компонентов в равновесной газовой смеси, нм3; Vвых – общий объем равновесной газовой смеси, нм3.
Таким образом, a и b есть решения системы уравнений (3.2-3.3), если c = 1и d = 1. В противном случае необходимо задать новые значения a = a + Da и b = b + Db. Алгоритм моделирования представлен на рис. 15.
Здесь и далее на блок-схемах приняты следующие обозначения:
- прямоугольник – входные и выходные данные или рассчитываемые параметры;
- штриховой прямоугольник – принимаемые значения для итерационных вычислений;
- ромб – условие;
- двойная стрелка - выполнение математических операций в соответствии с формулами, отмеченными над стрелкой;
- простая стрелка – передача начальных или расчетных данных.
На схемах обозначена передача наиболее существенных (с точки зрения логики и последовательности расчета) данных, т.к. обозначение передачи всех данных слишком загромождает схемы.
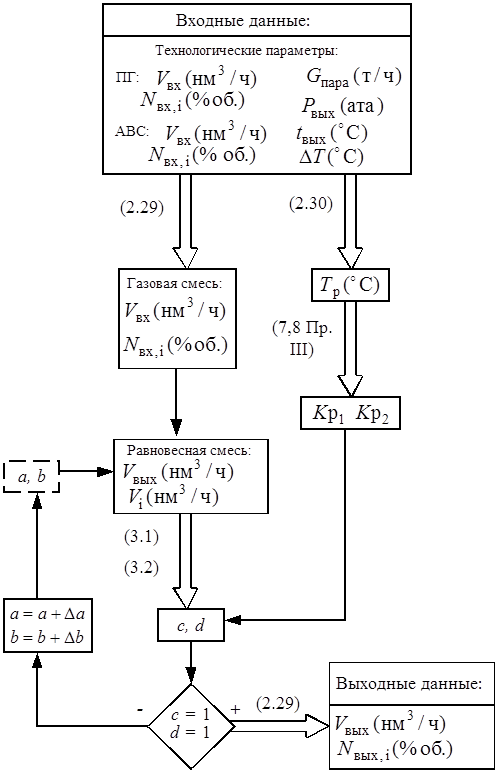
Рис. 15. Блок-схема моделирования стадии первичного риформинга.
В аппарат вторичного риформинга подаются паро-газовая смесь (ПГС) из первичного риформинга и паро-воздушная смесь (ПВС). В I зоне (над катализатором) происходит полное сгорание кислорода с водородом по реакции (2.16).
Расход и состав газовой смеси до и после 1-й зоны определялся покомпонентным сложением и вычитанием согласно стехиометрии реакции (2.16). Во 2-й зоне на катализаторе протекают реакции (2.13,2.14), описываемые системой уравнений (3.1,3.2). Так как реактор адиабатический, то температура на выходе до расчета неизвестна, поэтому необходимо добавить уравнение теплового баланса (2.63), записанное в виде:
Q1 + Q2 + Q3 + Q4 - (Q5 + Q6 +Q7) = f (3.3)
Тепловые эффекты реакций (2.13,2.14) известны [74]. При определении энтальпий газовых смесей по формуле (2.9) использовали зависимости H = f(t), полученные для каждого компонента по уравнению (2.2).
Пусть e – температура на выходе из реактора, °С. На первом шаге итерации были заданы некоторые значения a,b,e. Таким образом, для стадии вторичного риформинга a,b,e есть решения системы уравнений (3.1-3.3), если c = 1, d = 1 и f = 0. В противном случае необходимо задать новые значения a = a + Da, b = b + Db и e = e + De. Алгоритм моделирования представлен на рис. 16.

Рис. 16. Блок-схема моделирования стадии вторичного риформинга.
Конверсию СО по реакции (2.14) проводят в 2 стадии, отличающиеся температурой процесса [81]. На обеих стадиях применяют адиабатические реакторы [74]. Поэтому для определения состава и температуры газа на выходе необходимо решить систему из двух уравнений. Одно из них - уравнение (3.2), второе – уравнение теплового баланса:
Q1 + Q2 - (Q3 + Q4) = f (3.4)
Итерационные вычисления организованы аналогично стадиям первичного и вторичного риформингов.
Алгоритм моделирования одинаков для каждой стадии конверсии СО и приведен на рис. 17.

Рис. 17. Блок-схема моделирования стадии конверсии СО.
За равновесную температуру абсорбции приняли температуру глубокорегенерированного раствора МЭА, подаваемого на верх абсорбера. Равновесное давление СО2 над раствором определяем по практическим данным [74]. Реакции (2.19,2.20) протекают до конца, поэтому состав газа после метанирования рассчитывали покомпонентным сложением и вычитанием согласно стехиометрии реакций.
Алгоритм моделирования представлен на рис. 18.

Рис. 18. Блок-схема моделирования стадии очистки.
3.2. Алгоритмы моделирования блока выработки пара
высокого давления.
При расчете котла-утилизатора из уравнения теплового баланса (2.64) определяли количество теплоты, затраченное на испарение воды. Величины Q1 и Q2 вычисляли по формуле (2.9), зависимости энтальпий компонентов газовой смеси от температуры – по уравнению (2.2). Количество образовавшегося пара находили по формуле (2.65). Зависимость Нисп = f(t) в виде полинома получили аппроксимацией литературных данных из [58]. Так как заданной величиной является давление вырабатываемого пара, то температуру насыщения находили из уравнения tнас = f(Рнас), также полученного путем аппроксимации литературных данных из [58].
Алгоритм расчета котла-утилизатора не требует итерационных процедур и приведен на рис. 19.
Количество пара, вырабатываемого во вспомогательном котле, определяли из баланса выработки и потребления пара высокого давления. Из теплового баланса котла рассчитывали необходимый расход природного газа. Для этого уравнение (2.66) записали в виде:
Q1 + Q2 + Q3 - (Q4 + Q5 + Q6) = f (3.5)
Расчет по уравнению (3.5) вели методом итераций. Пусть е – расход природного газа во вспомкотел. Далее исходя из стехиометрии реакций (2.26) и принятого значения коэффициента избытка воздуха рассчитывали материальный баланс процесса горения: количество воздуха, необходимое для горения, и количество и состав дымовых газов. Затем определяли величины, входящие в уравнение (3.5) и проверяли сходимость теплового баланса. Если f = 0 с заданной точностью, то е есть решение уравнения (3.5). Алгоритм расчета показан на рис. 20.

Рис. 19. Блок-схема моделирования котла-утилизатора.
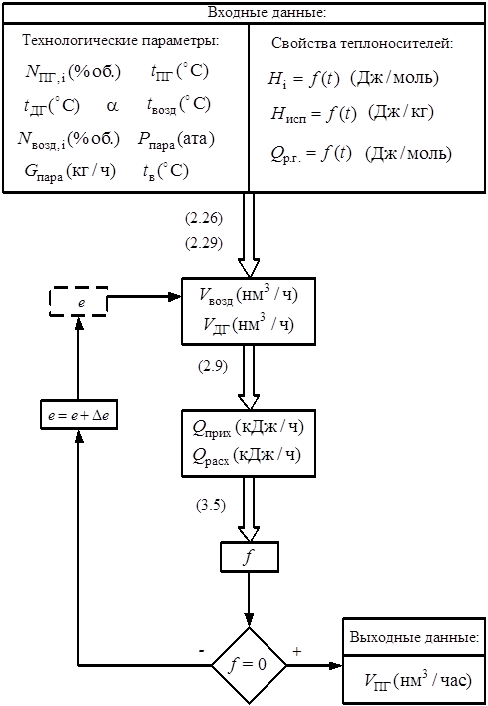
Рис. 20. Блок-схема моделирования вспомогательного котла.
3.3. Алгоритмы моделирования блока синтеза аммиака.
В соответствии с рекомендациями из [66,74] было принято, что после стадии очистки в газовой смеси присутствуют только H2, N2, CH4, Ar, т.к. концентрации СО, СО2 и Н2О пренебрежимо малы.
Объем и состав потока 0 (см. рис. 14) следуют из расчета стадии очистки. Состав потока 01 неизвестен, поэтому приняли начальные значения расходов каждого из компонентов  (i = 1,2..5) в нм3/ч. Состав потока 1 рассчитали покомпонентным сложением. Далее по уравнениям (15-18) Приложения III определили концентрацию аммиака в газовой смеси после вторичной конденсации и, тем самым, потоки 2,3 (см. рис. 14).
(i = 1,2..5) в нм3/ч. Состав потока 1 рассчитали покомпонентным сложением. Далее по уравнениям (15-18) Приложения III определили концентрацию аммиака в газовой смеси после вторичной конденсации и, тем самым, потоки 2,3 (см. рис. 14).
Пусть a – количество NН3, прореагировавшего по реакции (2.21). Для первого шага итерации задали некоторое значение a и вычислили константу равновесия Кр (уравнение (14) Приложения III) при температуре Тр (формула (2.30)), записали уравнение (2.27) в следующем виде (с учетом формул (2.28-2.29):
 (3.6)
(3.6)
где Vi – объемы компонентов в равновесной газовой смеси, нм3; Vвых – общий объем равновесной газовой смеси, нм3; Р – давление, МПа.
Если c = 1, то a есть решение уравнения (3.6) и определен поток 4.
Затем по уравнениям Михельса вычислили концентрацию аммиака в газовой смеси после первичной конденсации и потоки 5,6. После этого отвели поток 7, расход которого в модели может изменятся в заданных пределах. Потоки 9,10 рассчитали также по уравнениям Михельса и далее поток 11. Состав потока 8 сравнивали с потоком 01 :
ei = N01,i/N8,i (3.7)
где N – расход компонента в нм3/ч; i = 5 для рассматриваемой смеси.
Если ei ¹ 1, то необходимо задать новые значения 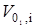 .
.
Массовый расход аммиака определяли по формуле (2.39). Потери аммиака и потребности аммиака на технологические нужды приняли равными 5 % от производительности.
Алгоритм моделирования стадии синтеза аммиака представлен на рис. 21.
Как видно из приведенной блок-схемы, при расчете блока синтеза аммиака используются две итерационные процедуры, причем одна из них вложена в другую.
Рис. 21. Блок-схема моделирования стадии синтеза аммиака.
3.4. Алгоритмы моделирования блока производства
метанола.
Основным аппаратом процесса синтеза метанола является реактор. Поэтому описание алгоритма моделирования начнем с этого аппарата.
При моделировании реактора синтеза метанола необходимо знать некоторые его конструкционные характеристики. Для этого приняли внутренний диаметр реакционный труб равным 120 мм, материал труб - 12Х18Н12Т в соответствии с рекомендациям [43]. Далее по формулам из [48] рассчитали: толщину труб из условия прочности, шаг между трубами, число труб, внутренний диаметр корпуса. После этого из стандартных рядов [48] выбрали диаметр корпуса и рассчитали его толщину из условия прочности. Описанный расчет выполнен в ''Microsoft Excel'' в виде блока и здесь не приводится. Основные конструкционные характеристики аппарата приведены ниже:
диаметр корпуса 4148 ´ 78 мм
диаметр труб 132 ´ 6 мм
число труб 397
Кроме того, необходимо задать размеры таблеток катализатора и его насыпную плотность. Согласно [8,14,82] в синтезе метанола применяют медьсодержащие катализаторы с размером таблеток (диаметр ´ высота): 3 ´ 3 мм и 5 ´ 5 мм, 4 ´ 6 мм. Для определенности приняли таблетки 4 ´ 6 мм. Из литературы [8, 82] известна насыпная плотность катализатора – 1300 кг/м3.
Прежде, чем начать расчет по слою, были выполнены некоторые предварительные расчеты.
Поверхность Fз (м2) и объем Vз (м3) зерна указанной формы определили по формулам:
Fз = p×dз×hз + 2×p×dз2/4 (3.8)
Vз = p×dз2 ×hз /4 (3.9)
Порозность слоя зерен чаще всего лежит в пределах 0,35-0,45 [31]. Приняли e = 0,4. Удельная поверхность слоя катализатора a (м2/м3) и эквивалентный диаметр dэ (м) каналов в слое [31]:
a = (1 - e)× Fз/ Vз (3.10)
dэ = 4×e/a (3.11)
Объемный расход Vвх (м3/ч) газовой смеси при условиях входа в реактор:
Vвх = Vвх,0 ×Твх / (273×Рвх) (3.12)
где Vвх,0 – объемный расход в нм3/ч; Рвх – давление в атм.
Фиктивная средняя линейная скорость w0 (м/с) потока:
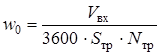 (3.13)
(3.13)
Действительная скорость w (м/с) потока в каналах слоя:
w = w0/e (3.14)
Далее вычислили расход Nвх (моль/с) и состав nвх,i (% мол.) газа на входе в одну трубу:
 (3.15)
(3.15)
nвх,i = Vвх,i
где nвх,i, Vвх,i – мольная и объемная доли компонентов в газовой смеси.
При моделировании реактора необходимо рассчитывать вязкость и теплопроводность газовой смеси, содержащей 8 компонентов, с учетом влияния давления. Выполнение такого расчета на каждом шаге значительно усложняет модель, поэтому воспользовались следующим приемом. Приняли температуру на выходе из реактора 265 °С и рассчитали равновесный состав газа на выходе, а затем покомпонентно усреднили состав газа между входом и выходом. Далее для полученного среднего состава газа в пакете MathCAD 2000 по формулам (1-6 Приложения III) рассчитали вязкость и теплопроводность смеси при давлении 70 атм в диапазоне температур 180 – 300 °С (с шагом 20 °С). Полученные расчетные данные аппроксимировали полиномами 1-й степени: mсм = f(t) и lсм = f(t).
Задав шаг по высоте Dl (м), определили геометрические параметры:
Fст,вн = p× dтр,в×Dl, м2 (3.16)
Fст,н = p× dтр,н×Dl, м2 (3.17)
 , м3 (3.18)
, м3 (3.18)
Материальный баланс в слое рассчитывали следующим образом. Для определения скоростей реакций вычисляли парциальные давления реагентов Рi (атм):
Рi = nвх,i×Рвх (3.19)
Далее:
Dn1 = ri×Dv×rнас (3.20)
Dn2 = r2×Dv×106 (3.21)
Далее рассчитывали мольные расходы реагентов (моль/с) на выходе из слоя:
 (3.22)
(3.22)
 (3.23)
(3.23)
 (3.24)
(3.24)
 (3.25)
(3.25)
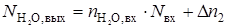 (3.26)
(3.26)
Состав газа (% мол.) на выходе из слоя:
 (3.27)
(3.27)
 (3.28)
(3.28)
Зависимость давления насыщенного водяного пара Рнп (атм) от температуры кипения получили аппроксимацией табличных данных из [57]:
Рнп = 94,2972 – 1,0908×tв + 3,4893×10-3×tв2 (3.29)
Зависимость коэффициента теплопроводности материала труб lст (Вт/(м×К)) от температуры получили аппроксимацией табличных данных из [43]:
lст = 15,00 + 0,011×t + 6.526×10-6×t2 (3.30)
Из уравнений (2.60,2.61) получили выражение для Тст,вн:
 (3.31)
(3.31)
где B - параметр, определяемый уравнением:
 (3.32)
(3.32)
Температуру на выходе из слоя рассчитывали по формуле:
 (3.33)
(3.33)
Слой катализатора оказывает гидравлическое сопротивление DР (атм), которое рассчитывали по формуле [48]:
 (3.34)
(3.34)
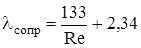 (3.35)
(3.35)
где lсопр - коэффициент сопротивления. Тогда давление на выходе из слоя:
Рвых = Рвх - DР (3.36)
Алгоритм моделирования реактора синтеза приведен на рис. 22.

Рис. 22. Блок-схема моделирования реактора синтеза метанола.
В контуре метанола (см. рис. 8) из газовой смеси за счет охлаждения конденсируется вода. Алгоритм математического описания этой стадии представлен на рис. 23.
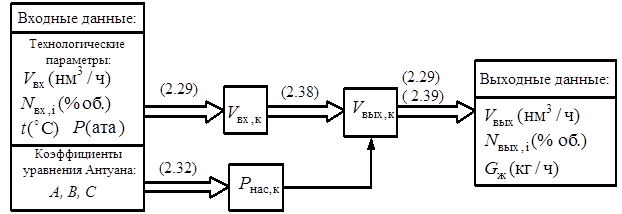
Рис. 23. Блок-схема моделирования стадии конденсации воды.
При конденсации метанола-сырца (см. рис. 8) конденсируется смесь из 2-х компонентов (метанол и вода), поэтому применили итерационный метод расчета. Пусть a и b – количества сконденсировавшихся метанола и воды соответственно (в нм3/ч газа). Для первого шага итерации задали некоторые значения a и b. Тогда (индексы 1 и 2 соответствуют метанолу и воде):
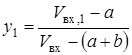 (3.37)
(3.37)
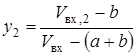 (3.38)
(3.38)
Учитывая, что количества сконденсировавшихся метанола и воды в кмолях равны a/22,4 и b/22,4, получили:
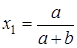 (3.39)
(3.39)
 (3.40)
(3.40)
Далее рассчитали коэффициенты активности и записали уравнение (2.31) для метанола и воды в виде:

 (3.41)
(3.41)
 (3.42)
(3.42)
Таким образом, a и b есть решения системы уравнений (3.41-3.42), если c = 1и d = 1. В противном случае необходимо задать новые значения a = a + Da и b = b + Db. Алгоритм моделирования представлен на рис. 24.

Рис. 24. Блок-схема моделирования конденсации метанола и воды.
Объем и состав потока 0 (см. рис. 13) были определены из расчета стадии конденсации воды. Приняв для определенности K = 3 в формуле (2.76), находили объем потока 01. Состав потока 01 неизвестен, поэтому приняли некоторые значения концентрации компонентов N01,i (в % об.) в потоке 01. Состав потока 1 вычисляли покомпонентным сложением. Далее по приведенным выше алгоритмам рассчитывали стадии синтеза и конденсации (потоки 2,3,4). Затем отводили точный объем циркулирующего газа согласно принятой кратности циркуляции, определяя тем самым потоки 5 и 6. В случае несовпадения концентрации компонентов в потоках 6 и 01 задавали новый состав потока 01 и повторяли расчет до достижения совпадения с заданной точностью e:
ei = N01,i/N6,i (3.43)
где N – объемная доля (в %) компонента в газовой смеси; i = 8 для рассматриваемой смеси.
Массовые расходы метанола и воды в составе метанола-сырца определяли по формуле (2.39). Алгоритм моделирования контура представлен на рис. 25.
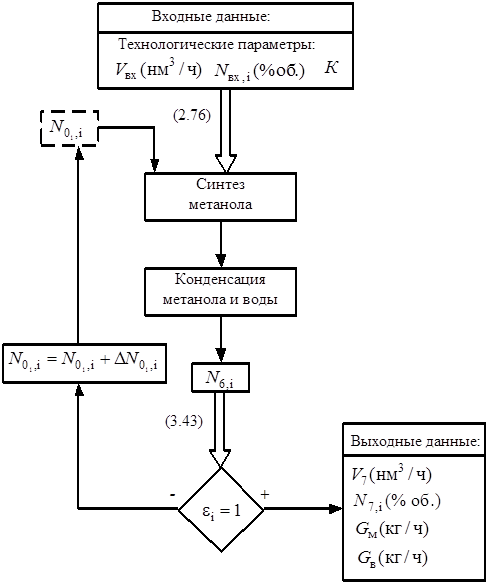
Рис. 25. Блок-схема моделирования контура метанола.
Как видно из приведенной блок-схемы, при расчете блока синтеза метанола используются две итерационные процедуры, причем одна из них (на стадии конденсации метанола и воды) вложена в другую.
3.5. Алгоритм расчета теплообменного оборудования.
Тепловой баланс контура определяется суммированием балансов входящих в него теплообменных аппаратов и потоков между ними.
На рис. 26 представлена общая блок-схема моделирования теплообменников. Зависимости свойств теплоносителей от температуры описали полиномами различных степеней по справочным данным [43,51,56,74,82] с помощью программы ''MathCAD''.
Зависимости вязкости и теплопроводности газовых смесей от температуры получены так же, как описано в алгоритме моделирования синтеза метанола (см. раздел 3.4.1). Для упрощения, в моделях теплообменников все свойства теплоносителей вычисляются при их средней рабочей температуре.
Неизвестный параметр е - это температура на выходе или расход одного из теплоносителей. Задав первое приближение для е, рассчитывали материальный баланс конденсации по алгоритмам, описанным ранее (см. рис. 23,24). Далее вычисляли приход и расход тепла и проверяли сходимость теплового баланса (f = 0). При выполнении условия определяли тепловую нагрузку и среднюю разность температур.
После этого из справочников и каталогов [37,54,78,84] выбирали стандартный теплообменник и проводили проверочный расчет на прочность по методике из [48]. Затем по описанным выше уравнениям (см. раздел 2.4.3) вычисляли коэффициенты теплоотдачи и теплопередачи, необходимую поверхность теплообмена и запас поверхности.
Рис. 26. Блок-схема моделирования теплообменника.
3.6. Реализация алгоритмов моделирования на ЭВМ.
Исходные данные для математической модели теплоэнерготехнологического комплекса (регулируемые параметры модели) приняты согласно [1,13,18,81,82]. Список исходных данных с их конкретными значениями приведен в Приложении I.
Результатами моделирования является набор расчетных данных (контролируемые параметры модели), перечень которых без конкретных значений также приведен в Приложении I. Полученные численные значения и зависимости между ними обсуждаются в Главе 4.
Математическая модель комплексного производства реализована на ЭВМ в программе ''Microsoft Excel'' в виде отдельной ''книги'' [79]. Каждый алгоритм выполнен на отдельном ''листе'' ''книги'', все ''листы'' взаимосвязаны между собой. Выделены ''листы'' исходных данных и результатов моделирования.
При построении общего алгоритма моделирования важно правильно организовать передачу данных между отдельными расчетными блоками, т.к. выходные данные одних блоков являются входными для других. Порядок передачи основных данных (расходы, давления, температуры) показан стрелками на структурной схеме декомпозиции объекта исследования (см. рис. 9).
Итерационные вычисления организованы в надстройке ''Поиск решения'', где поиск нужных значений переменных осуществляется методом Ньютона [79]. Относительная погрешность вычислений задается и определена нами величиной 0,001 %.
Отметим, что в контуре синтеза метанола (см. рис. 25) итерационный расчет проводится по 8 параметрам. На каждом шаге итерации выполняется довольно объемный расчет синтеза метанола по слою и расчет конденсации (в свою очередь тоже итерационный). Тем не менее, благодаря четко составленному алгоритму, надстройка ''Поиск решения'' справляется с поставленной задачей.
Выбор табличного процессора ''Microsoft Excel'' обусловлен следующим. ''Excel'' обладает мощным набором математических функций и готовых блоков для решения задач, требующих итерационных вычислений. Все это открывает широкий простор для моделирования сложных технологических процессов силами инженерного персонала, не владеющего методами стандартного программирования.
Дело в том, что многие пользователи, в том числе и автор диссертации, искренне желая применить компьютерное моделирование в своей практической деятельности, сталкиваются с серьезными трудностями при освоении и использовании современных программных средств [39]. Для работы с ними все еще требуются знания, не относящиеся непосредственно к моделированию, а проведение вычислительного эксперимента остается кропотливой и трудоемкой работой.
Опыт нашей работы показал, что намного проще и быстрее реализовать разработанные алгоритмы с помощью стандартных, совместимых систем типа ''Microsoft Excel'' и ''MathCAD'' , и на их основе создавать уникальные системы расчета и оптимизации теплоэнерготехнологических комплексов.
Выводы по главе:
1. В главе 3 описаны алгоритмы, которые применены при моделировании теплоэнерготехнологического комплекса совместного производства аммиака, метанола и энергоносителей. Эти алгоритмы могут быть использованы при математическом моделировании других теплоэнерготехнологических комплексов. Общий алгоритм складывается из алгоритмов более низкого уровня, описывающих отдельную стадию производства или отдельный аппарат. Предложенные алгоритмы моделирования позволяют реализовать сложные математические модели в помощью современных программных средств.
2. Показано, что модель достаточно просто реализуется в ''Microsoft Excel'' без необходимости разработки специальных программ. Особое внимание уделено организации итерационных вычислений, что позволяет рассчитывать тепловые и материальные балансы, балансы выработки и потребления энергоносителей в достаточно сложных теплоэнерготехнологических комплексах с многочисленными рециклами.
Глава 4. ТЕХНИЧЕСКИЕ РЕШЕНИЯ ПО СНИЖЕНИЮ ЭНЕРГОПОТРЕБЛЕНИЯ КОМПЛЕКСНОГО ПРОИЗВОДСТВА. МОДЕЛИРОВАНИЕ ТЕПЛОЭНЕРГОТЕХНОЛОГИЧЕСКОГО КОМПЛЕКСА И АНАЛИЗ РЕЗУЛЬТАТОВ.
Ниже рассмотрены технические предложения, выдвинутые автором диссертации и направленные на экономию природного газа и электроэнергии, увеличение степени использования тепла физико-химических процессов и в конечном счете на снижение энергопотребления комплексного производства. Эти предложения позволяют модернизировать вариант реализации проекта теплоэнерготехнологического комплекса, предложенный компанией ''ТЕС''.
4.1. Технические решения по снижению энергопотребления
комплексного производства.
4.1.1. Организация выработки и потребления пара
среднего давления.
В разделе 1.3 было показано, что схемы организации теплообмена, предлагаемые различными зарубежными компаниями, имеют следующие недостатки: применение электропривода компрессора, неясность с вопросами утилизации пара давлением 33-35 ата и подогрева питательной воды для выработки этого пара. Также в разделе 1.3 указывались способы увеличения степени использования тепла экзотермических реакций, основанные на теории эксергетического анализа. Исходя из этих рекомендаций, автор диссертации предлагает следующие решения по организации выработки и потребления пара среднего давления:
1) Поднять температуру газа, входящего в реактор синтеза метанола, до 260 °С. Это не приведет к снижению производительности по метанолу, зато позволит вырабатывать пар давлением 42-43 ата и присоединить его к системе пара среднего давления (39-40 ата) агрегата аммиака.
2) Подачу питательной воды в реактор осуществлять насосами, имеющимися в агрегате аммиака. Насосы имеют производительность 450 т/ч, при нормальном режиме агрегата перекачивают 340–360 т/ч воды, поэтому легко возьмут дополнительную нагрузку.
3) Подогрев питательной воды для реактора осуществлять парогазовой смесью, поступающей в контур метанола из агрегата аммиака.
4) Для перегрева пара использовать огневой подогреватель отделения синтеза аммиака, который эксплуатируется в производстве аммиака крайне редко.
5) В качестве привода компрессора применить паровую турбину.
6) Пар, выработанный в реакторе метанола, направить в паровую турбину. Возможный недостаток покрыть за счет агрегата аммиака путем выработки пара в пусковом котле.
7) Конденсат направить в систему сбора конденсата и далее на блок подготовки воды агрегата аммиака.
Указанные решения показаны на принципиальной схеме (рис. 26), где пунктирными линиями обозначено новое оборудование.
Для привода компрессора предлагается использовать имеющуюся паровую турбину, которая находится в законсервированном состоянии. Эта турбина была выведена из эксплуатации вместе с компрессором природного газа в 1999 году в результате подключения агрегата аммиака №2 к трубопроводу природного газа высокого давления. Турбина имеет мощность 4300 кВт, работает на паре давлением 40 ата и потребляет при рабочей нагрузке 21 т/ч пара [81].

Рис. 26. Принципиальная схема выработки и использования пара
среднего давления.
Расчет мощности компрессора и турбины в контуре метанола и расхода пара на турбину выполнен по [80,86] и включен в математическую модель теплоэнерготехнологического комплекса.
4.1.2. Организация выработки и потребления пара
низкого давления.
Для ректификации метанола-сырца (см. рис. 8) необходим пар низкого давления. В разделе 2.2 обосновано исключение из математической модели теплоэнерготехнологического комплекса блока ректификации. Из практических данных [8,18] известно, что необходимое для ректификации количество тепла составляет 1,2 Гкал на 1 тонну метанола, что соответствует 2,3 т низкопотенциального пара давлением 4,5 ата. В схемах компании ''Uhde'' (см. раздел 1.3) этот пар вырабатывается за счет охлаждения газовой смеси, отбираемой из агрегата аммиака. Это решение является вполне обоснованным. Однако неясно, достаточно ли будет вырабатываемого пара для проведения процесса ректификации. Кроме того, не решен вопрос подачи питательной воды для выработки пара. Для решения указанных проблем автор диссертации предлагает следующее:
1) осуществить подачу питательной воды насосами, имеющимися в агрегате аммиака;
2) конденсат направить в систему сбора конденсата и далее на блок подготовки воды агрегата аммиака;
3) связать систему пара 4,5 ата контура метанола с такой же системой агрегата аммиака, в результате чего открываются возможности для утилизации избыточного низкопотенциального пара агрегата аммиака.
Схема получения и использования низкопотенциального пара показана на рис. 27.

Рис. 27. Принципиальная схема выработки и потребления пара
низкого давления.
Реализация схем, предлагаемых на рис. 26,27, позволяет организовать замкнутые циклы ''питательная вода – пар – конденсат – питательная вода'' и увеличить степень использования оборудования агрегата аммиака.
Данные схемы могут быть использованы при создании комплексного производства на любом предприятии, т.к. не требуют дополнительных видов сырья или энергоресурсов.
4.1.3. Дозирование кислорода в комплексное производство.
Как указывалось в разделе 1.1, примерно 70 % пара высокого давления вырабатывается в котлах-утилизаторах (см. рис. 7) за счет использования тепла реакций. Количество вырабатываемого пара зависит от температуры и расхода газовой смеси после стадии вторичного риформинга. Организация комплексного производства аммиака, метанола и энергоносителей изменяет режим работы этой стадии и влияет таким образом на выработку пара высокого давления. Рассмотрим, как это происходит.
Из стехиометрии реакции (2.21) следует, что в блоке синтеза аммиака необходимо поддерживать соотношение H2/N2 = 3, т.к. в противном случае будет происходить накопление одного из реагентов в циркуляционном газе. В комплексном производстве часть водорода будет тратиться на выработку метанола по реакции (2.22), поэтому для поддержания соотношения H2/N2 = 3 необходимо будет снизить расход воздуха (который является источником азота) и, соответственно, кислорода в аппарат вторичного риформинга (см. рис. 7).
Вследствие этого в результате реакции горения (2.16) выделится меньше тепла и температура на выходе из реактора снизится. В связи с этим уменьшится степень превращения метана по эндотермической реакции (2.13). В итоге снизится глубина переработки природного газа. Непереработанный метан будет проходить через все дальнейшие стадии как инертный элемент, ухудшая условия синтеза основных продуктов.
Кроме того, снижение температуры на выходе из вторичного риформинга вызовет сокращение выработки пара в котлах-утилизаторах. Недостающий пар необходимо будет выработать во вспомогательном котле, затрачивая для этого природный газ, что крайне невыгодно экономически. Для устранения этой проблемы предлагается решение, смысл которого описан ниже.
На ОАО ''Череповецкий ''Азот'' в цехе разделения газа методом низкотемпературной ректификации из воздуха получают чистый азот. При этом в атмосферу выбрасывается 7000 – 7500 нм3/ч кислорода. Целесообразно подать кислород на всас компрессора воздуха агрегата аммиака, для чего достаточно установить простой центробежный нагнетатель малой мощности с электроприводом. В результате воздух станет более богат кислородом, во вторичном риформинге увеличится температура газа на выходе и степень переработки природного газа. Схема подачи кислорода показана на рис. 28.

Рис. 28. Принципиальная схема подачи кислорода в риформинг.
Как видно, схема требует минимального количества оборудования и весьма незначительных текущих затрат, а в результате снизятся расходный коэффициент по газу и себестоимость продукции.
Эта схема может быть реализована только на тех производственных площадках, где имеется избыточный кислород, и, в частности, на ОАО ''Череповецкий ''Азот''.
4.2. Основные результаты моделирования
теплоэнерготехнологического комплекса.
Результатами моделирования являются расчетные балансы теплоэнерготехнологического комплекса по тепловым и материальным потокам, балансы выработки и потребления пара различного давления, поверочные расчеты теплообменного оборудования для производства метанола и определение экономических параметров комплексного производства.
Схема материального баланса комплексного производства при одном из режимов работы приведена на рис. 1 (Приложение II), где показаны основные стадии производства, расходы газовой смеси и концентрации компонентов в % об.
Баланс выработки и потребления пара высокого давления приведен на рис. 2 (Приложение II), где указаны направления движения потоков, расходы, давления и температуры.
Тепловые балансы производства метанола показаны в виде схем на рис. 3,4 Приложения II. Эти схемы отражают также баланс по выработке и потреблению пара среднего и низкого давлений. Здесь указаны направления движения потоков, их температуры и давления, расходы тепло- и хладоносителей. Условно показаны теплообменные аппараты, все они кожухотрубчатого типа с одним ходом теплоносителей. Основные размеры выбранных теплообменников также указаны на схемах.
Из указанных схем видно, что запас поверхностей теплообмена чаще всего значительно превышает 10 %. Это связано с тем, что теплообменники с меньшими поверхностями рассчитаны на меньшие давления и потому не подходят для применяемых при производстве метанола давлений.
Важным результатом моделирования является расчетный профиль температуры в реакторе синтеза метанола, приведенный на рис. 29 при одном из режимов работы. На нем четко видно положение так называемой ''горячей точки'' – максимальной температуры газовой смеси в трубе реактора. Величина максимальной температуры имеет важнейшее значение, т.к. определяет выбор применяемых материалов и катализаторов. Известно, что не все низкотемпературные катализаторы синтеза метанола способны работать при температурах до 300 °С.

Рис. 29. Профиль температуры газовой смеси по длине трубы реактора.
На графике под температурой газовой смеси понимается температура, средняя по сечению трубки на выходе из слоя. Ход линии на графике объясняется следующим образом. Вначале скорость экзотермической реакции синтеза метанола больше, чем скорость отвода тепла, поэтому температура возрастает. По мере накопления метанола в газовой смеси скорость реакции падает и становится меньше скорости теплоотвода. Соответственно температура проходит через максимум и далее постепенно снижается. Данный температурный профиль является вполне характерным для экзотермических реакций с отводом тепла [19].
В разделе 2.4.4. говорилось о необходимости правильного выбора шага расчета по длине трубы. При слишком большом шаге расчетная температура будет изменятся большими скачками при переходе к каждому следующему слою, что приведет к погрешностям в расчетах. Результаты моделирования реактора при различных нагрузках показывают, что при выбранном нами шаге в 0,1 м изменение расчетной температуры при переходе от слоя к слою не превышает 4,5 °С и профиль температуры по высоте трубы вполне гладкий (см. рис. 29). Влияние такого изменения на расчет теплофизических свойств среды и коэффициентов теплоотдачи минимально. Поэтому выбор указанного шага можно считать обоснованным.
Как уже указывалось в разделе 1.1, процессы утилизации тепла в реакторе протекают совместно с процессами получения целевого продукта. О выработке метанола в реакторе можно судить по расчетному профилю концентрации метанола, приведенному на рис. 30.
Рис. 30. Профиль концентрации метанола в газовой смеси
по длине трубы реактора.
4.3. Оценка корректности разработанной математической
модели.
Точность расчетных данных, полученных при применении разработанной математической модели, определяется тремя факторами:
1) применение корректного математического аппарата и оценка всех допущений, принятых в процессе формализации;
2) сравнением расчетных данных, полученных по разработанной модели, с фактическими данными, в той части теплоэнерготехнологического комплекса, которая физически существует (производство аммиака);
3) сравнением расчетных данных, полученных по разработанной модели, с литературными данными, относящимися к проектируемой части теплоэнерготехнологического комплекса (производство метанола).
Корректность математического аппарата и оценка принятых допущений подробно рассмотрены в Главе 2.
Корректность той части модели, которая описывает существующее производство аммиака, проверена сравнением расчетных результатов, полученных при моделировании нескольких режимов его работы, с практическими данными. По всем рассчитываемым параметрам расхождения в расчетных и измеренных расходах и температурах не превышают 3 %, в составах потоков – 5 %.
Разница расчетных и практических данных может быть обусловлена погрешностями измерений. Поэтому было проведено сравнение расчетных данных по разработанной модели и имеющимся программам (''CATPER'' и ''FRONTEND''). Следует отметить, что разработанная программа рассчитывает больше параметров, чем имеющиеся. По совпадающим параметрам расхождения в расчетных данных не превышали 4 %.
На основании вышеизложенного можно считать, что разработанная модель корректно описывает процесс в части существующего агрегата. Поэтому экстраполяция ее основных принципов построения, формализации и алгоритмов реализации на весь теплоэнерготехнологический комплекс позволяет надеяться на корректность модели в полном объеме.
Результаты моделирования проектируемой части теплоэнерготехнологического комплекса не могут быть подтверждены сравнением с практическими данными, т.к. в отечественной промышленности не существует объекта, соответствующего нашей модели. Информация из зарубежных источников носит в основном описательный характер и не содержит конкретных цифр. Однако некоторые данные все же имеются, и их сравнение с результатами вычислений по модели приведено в таблице 2.
Таблица 2.
Сравнение литературных и расчетных данных.
| Параметр, единица измерения | Результат моделирования | Практические данные, источник литературы |
| Выработка пара в реакторе метанола, Гкал/тонну метанола | 0,62 | 0,5 [13] |
| Выработка пара в реакторе метанола, тонна пара/тонну метанола | 1,54 | 1–1,4 [18] |
| Концентрация метанола на выходе из реактора синтеза, % об. | 4,03 | 4,0 [13] |
| Удельный объем катализатора, м3 на т/сут метанола | 0,17 | 0,18–0,19 [4] |
Как видно из таблицы, совпадение расчетных и литературных данных достаточно хорошее, что еще раз подтверждает корректность разработанной математической модели.
4.4. Моделирование режимов работы
теплоэнерготехнологического комплекса.
Основными параметрами, определяющими работу теплоэнерготехнологического комплекса, являются расход природного газа в комплексное производство и расход газовой смеси на получение метанола. Кроме того, на режим существенно влияет дозирование кислорода во вторичный риформинг.
4.4.1. Режимы нагрузки теплоэнерготехнологического
комплекса.
Режимы работы комплексного производства, балансы производства по пару различного давления, количества выработанной продукции зависят главным образом от расхода природного газа на технологические цели и от величины отбора газовой смеси на производство метанола после стадии вторичного риформинга (см. рис. 8). Было смоделировано несколько режимов работы теплоэнерготехнологического комплекса при разных величинах отбора газовой смеси в контур метанола и различных нагрузках комплексного производства по природному газу. Чтобы отношение H2/N2 в синтезе аммиака оставалось равным 3, расход воздуха во вторичный риформинг пропорционально снижали.
Как видно на рис. 31, при увеличении отбора газа в контур метанола выработка аммиака пропорционально снижается, т.к. водород потребляется для получения метанола. Разгрузка отделения синтеза аммиака ведет к разгрузке компрессора синтез-газа (см. рис. 8), приближая его к границе устойчивой работы. Этот фактор ограничивает дальнейшее увеличение отбора газовой смеси на производство. При этом, чем больше расход природного газа в комплексное производство, тем больше газа можно направить в контур метанола.
Здесь и далее на всех графиках окружностями обозначены расчетные точки, а сплошные линии – сглаживающие кривые.
Рис. 31. Зависимость выработки аммиака Gа от отбора газа V в контур
метанола при различных нагрузках по природному газу:
1 - 38000 нм3/ч; 2 - 40000 нм3/ч; 3 - 42000 нм3/ч.
Из графиков на рис. 32 следует, что выработка метанола возрастает пропорционально отбору газа в контур и практически не зависит от нагрузки по природному газу. С увеличением нагрузки производства по природному газу можно увеличивать выработку метанола.

Рис. 32. Зависимость выработки метанола Gм от отбора газа V в контур
метанола при различных нагрузках по природному газу:
1 - 38000 нм3/ч; 2 - 42000 нм3/ч.
На рис. 33 показано изменение расходного коэффициента по природному газу при разных нагрузках производства. Данный коэффициент рассчитывали делением суммарного расхода природного газа (на получение водорода и на топливо) на суммарную производительность (аммиак + метанол). Пунктирными линиями указаны расходные коэффициенты при производстве только аммиака.
Как видно из графиков, при комплексном производстве расходный коэффициент ниже, чем при производстве аммиака. Это говорит о том, что природный газ перерабатывается более эффективно, т.к. используется его углеродная составляющая (см. раздел. 1.2). Однако с увеличением нагрузки контура метанола Кпг возрастает. Это связано с ухудшением режима работы вторичного риформинга и увеличением расхода природного газа на производство пара высокого давления, о чем подробно говорилось в разделе 4.1.3.
Рис. 33. Расходный коэффициент Кпг при различных отборах газа V в
контур метанола и нагрузках по природному газу:
1 - 38000 нм3/ч; 2 - 40000 нм3/ч; 3 - 42000 нм3/ч.
Таким образом, в рассматриваемом комплексном производстве использование природного газа для технологических целей и в качестве топлива для производства энергоносителей тесно взаимосвязано. Улучшение показателей переработки в первом направлении вызывает повышенный расход газа в на топливо.
Для экономической оценки комплексного производства была использована величина нарастающего чистого дисконтированного дохода NPV за рассматриваемый период в 10 лет. Соответствующие графики приведены на рис. 34. Так как цена на метанол всегда выше цены на аммиак, то с увеличением нагрузки контура метанола показатель NPV неизбежно возрастает. Дальнейший рост ограничен только режимом работы компрессора синтез-газа, о чем говорилось выше.

Рис. 33. Чистый дисконтированный доход NPV при различных отборах
газа V в контур метанола и нагрузках по природному газу:
1 - 38000 нм3/ч; 2 - 40000 нм3/ч; 3 - 42000 нм3/ч.
Как указывалось в разделе 1.1, агрегат аммиака выбрасывает в атмосферу 35000-36000 нм3/ч СО2. Из результатов моделирования следует, что при комплексном производстве выбросы сокращаются на 7000-9000 нм3/ч, или 20-25 %. Это является существенным положительным эффектом с точки зрения защиты окружающей среды.
4.4.2. Баланс комплексного производства по пару.
Баланс комплексного производства по пару высокого давления (105 атм) при одном из режимов работы приведен в Приложении II. Потребление пара высокого давления на привод турбины определяется режимом работы компрессора синтез-газа, который, в свою очередь, зависит от всех остальных стадий теплоэнерготехнологического комплекса. Сходимость баланса по пару высокого давления обеспечивается изменением расхода природного газа во вспомогательный котел. Подробнее этот вопрос рассмотрен в разделе 4.4.3.
Для подтверждения эффективности предлагаемых в разделе 4.1. технических решений по организации выработки и потребления пара среднего и низкого давлений необходимо рассмотреть балансы по этим парам при различных режимах работы теплоэнерготехнологического комплекса.
На рис. 34 приведена характеристика контура метанола по выработке и потреблению пара среднего (43 ата) давления.

Рис. 34. Зависимость выработки Gвыр и потребления Gпотр пара среднего
давления от нагрузки контура метанола V.
При нагрузках до 85000 нм3/ч производство метанола является автономным по пару среднего давления. Дальнейшее увеличение нагрузки требует выработки небольшого количества дополнительного пара в агрегате аммиака. Для этого случая, а также для проведения пусковых операций необходима связь системы пара среднего давления контура метанола с системой пара этого же давления агрегата аммиака (см. рис. 26).
Требуемая мощность турбины для привода компрессора в контуре метанола пропорциональна нагрузке (рис. 35). Как видно из графика, турбина (4300 кВт), находящаяся в агрегате аммиака в законсервированном состоянии, имеет достаточную мощность для привода компрессора при любых нагрузках на контур метанола.

Рис. 35. Зависимость мощности N турбины от нагрузки контура
метанола V.
На рис. 36 приведен баланс выработки и потребления пара низкого давления при производстве метанола. Как следует из графиков, выработка пара существенно меньше, чем требуется для ректификации метанола-сырца. Недостаток (4-8 т/ч) можно покрыть за счет утилизации избыточного пара агрегата аммиака, выбрасываемого в атмосферу (10-15 т/ч). Таким образом, частично решается проблема утилизации низкопотенциального пара агрегата аммиака.
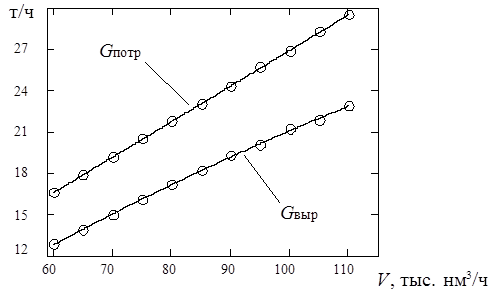
Рис. 36. Зависимость выработки Gвыр и потребления Gпотр пара низкого
давления от нагрузки контура метанола V.
Исходя из приведенных графиков, можно сделать следующие выводы:
1) замена электродвигателя на имеющуюся турбину позволяет экономить до 3300 кВт/ч электроэнергии, исключить капитальные затраты на приобретение и монтаж электродвигателя, а вместо этого использовать оборудование агрегата аммиака, выведенное из эксплуатации;
2) использование пара, вырабатываемого в контуре метанола, для привода турбины является наилучшим способом утилизации среднепотенциального тепла химических реакций;
3) тепло газовой смеси эффективно используется для выработки пара низкого давления и подогрева питательной воды для реактора синтеза;
4) использование избыточного пара низкого давления агрегата аммиака для ректификации метанола позволяет утилизировать около 50 % этого низкопотенциального пара, выбрасываемого в атмосферу;
5) подача питательной воды в контур метанола из блока подготовки воды агрегата аммиака и возврат парового конденсата в этот же блок обеспечивает замкнутость паро-водяного цикла и взаимосвязь контура метанола с агрегатом аммиака.
Таким образом, организация теплообмена и выработки энергоносителей согласно предложенных в разделе 4.1. полностью соответствует требованиям, выдвинутым в разделе 1.3.
4.4.3. Снижение расхода энергоресурсов при подаче
кислорода.
С целью изучения влияния дозировки кислорода с помощью разработанной модели были рассчитаны режимы работы теплоэнерготехнологического комплекса при различных расходах кислорода и нагрузках производства по природному газу. Расход газовой смеси в контур метанола оставался постоянным и равным 85000 нм3/ч.
Как видно из рис. 37, по мере увеличения дозировки кислорода температура на выходе из реактора вторичного риформинга быстро возрастает.

Рис. 37. Зависимость температуры газовой смеси t после вторичного
риформинга аммиака от дозировки кислорода VО2 при
различных нагрузках по природному газу:
1 - 38000 нм3/ч; 2 - 40000 нм3/ч; 3 - 42000 нм3/ч.
В результате увеличения температуры падает концентрация метана после риформинга (рис. 38), т.е. увеличивается степень переработки природного газа.

Рис. 38. Зависимость концентрации метана ССН4 в газовой смеси после
риформинга от дозировки кислорода VО2 при различных
нагрузках по природному газу:
1 - 38000 нм3/ч; 2 - 40000 нм3/ч; 3 - 42000 нм3/ч.
За счет увеличения температуры газовой смеси после стадии вторичного риформинга большее количество пара высокого давления вырабатывается в котлах-утилизаторах (см. рис. 8). В результате снижается потребление природного газа на выработку пара во вспомогательном котле, как это показано на рис. 39.
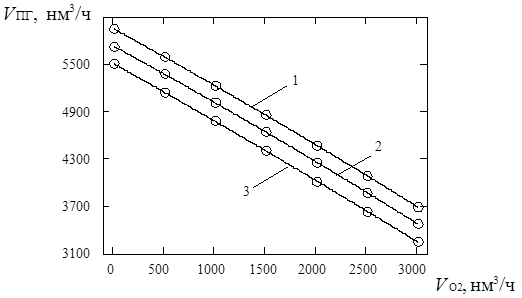
Рис. 39. Зависимость расхода природного газа Vпг во вспомогательный
котел от дозировки кислорода VО2 при различных нагрузках
по природному газу:
1 - 38000 нм3/ч; 2 - 40000 нм3/ч; 3 - 42000 нм3/ч.
За счет более полной переработки природного газа и уменьшении его потребления на выработку энергоносителя значительно снижается расходный коэффициент Кпг (рис. 40).

Рис. 40. Расходный коэффициент Кпг при различной дозировке
кислорода VО2 и нагрузках по природному газу:
1 - 38000 нм3/ч; 2 - 40000 нм3/ч; 3 - 42000 нм3/ч.
В конечном итоге улучшаются экономические показатели: растет чистый дисконтированный доход NPV (рис. 41).
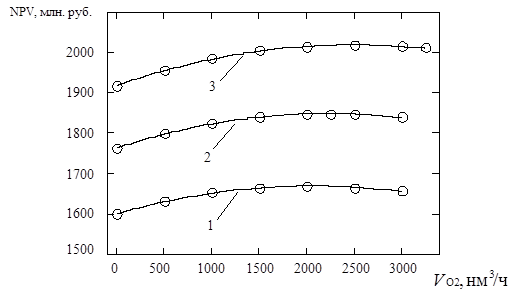
Рис. 42. Чистый дисконтированный доход NPV при различной
дозировке кислорода VО2 и нагрузках по природному газу:
1 - 38000 нм3/ч; 2 - 40000 нм3/ч; 3 - 42000 нм3/ч.
Как видно из графиков, при каждой нагрузке по природному газу показатель NPV проходит через максимум. Это связано со следующим. При подаче кислорода снижаются Кпг и потребление природного газа для выработки энергоносителей, поэтому вначале NPV растет. Однако по мере повышения расхода кислорода увеличиваются потери водорода по реакции (2.16), в результате чего все больше снижается выработка аммиака и, как результат, величина NPV. Поэтому на каждой нагрузке по природному газу существует наиболее эффективная величина дозировки кислорода, при которой NPV максимален. Как видно, здесь опять проявляется тесная взаимосвязь энергетической и технологической составляющих комплексного производства, что говорит о правильности рассмотрения последнего как теплоэнерготехнологического комплекса (см. раздел 1.4).
На рис. 43 приведен график требуемой мощности нагнетателя кислорода. Для привода нагнетателя необходим электродвигатель небольшой мощности – 50-70 кВт.
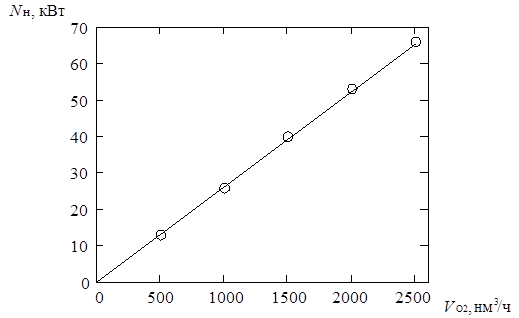
Рис. 54. Зависимость мощности нагнетателя Nн от дозировки
кислорода VО2.
На основании вышеприведенных графиков можно сделать следующие выводы:
1) дозирование кислорода в риформинг является эффективным мероприятием, позволяющим экономить до 3000 нм3/ч природного газа;
2) для реализации данного решения требуется минимальное количество оборудования – нагнетатель малой мощности с электродвигателем и холодильник с небольшой поверхностью теплообмена, а сырьем являются отходы цеха разделения воздуха - выбросы кислорода в атмосферу;
3) при каждой нагрузке по природному газу существует наиболее эффективная величина дозировки кислорода.
Выводы по главе:
1) В Главе 4 описаны технические решения, направленные на экономию природного газа и электроэнергии в теплоэнерготехнологическом комплексе: организация теплообмена и выработки энергоносителей в контуре метанола и дозирование кислорода в комплексное производство. Данные решения также позволяют более полно использовать оборудование агрегата аммиака (турбина, огневой подогреватель, блок подготовки воды, насосы питательной воды) и утилизировать неиспользуемые отходы (низкопотенциальный пар, кислород). Эффективность предложенных решений подтверждена результатами моделирования.
2) Основными результатами моделирования режимов работы теплоэнерготехнологического комплекса являются расчетные балансы комплексного производства по тепловым и материальным потокам, производству и потреблению энергоносителей, расчетный температурный профиль в реакторе синтеза метанола, поверочные расчеты теплообменного оборудования и расчет экономических параметров.
3) Сделано сравнение расчетных данных по разработанной математической модели с практическими данными, полученными при эксплуатации производства аммиака, и некоторыми литературными данными по комплексному производству. На основании этого сделан вывод о корректности разработанной модели.
4) С помощью разработанной модели рассчитаны режимы работы комплексного производства при различных нагрузках контура метанола и всего производства по природному газу. При комплексном производстве снижается коэффициент расхода природного газа на единицу продукции, на 20-25 % снижаются выбросы диоксида углерода в атмосферу, растет чистый дисконтированный доход. Контур метанола является автономным по пару среднего давления и вырабатывает 70-75 % пара низкого давления, необходимого для ректификации метанола-сырца.
5) Проведено моделирование работы производства при разных объемах дозирования кислорода. Показано, что при реализации данного мероприятия требуется существенно меньшее количество природного газа для выработки энергоносителя (водяного пара). На разных нагрузках производства по газу существует наиболее эффективная величина дозировки кислорода, при которой чистый дисконтированный доход достигает максимума.
ЗАКЛЮЧЕНИЕ
1) На основе системного подхода разработана концептуальная модель теплоэнерготехнологического комплекса производства аммиака, метанола и энергоносителей. Проведена декомпозиция объекта исследования с выделением относительно независимых подсистем и установлением существенных связей между ними. Детализация каждой подсистемы производилась до такого уровня, чтобы для каждого элемента были известны все параметры, которые обеспечивают определение интересующих исследователя характеристик системы; остальные параметры по возможности были исключены из модели.
2) Формализация объекта исследования выполнена с помощью известных математических уравнений и систем уравнений, описывающих свойства веществ, их смесей, процессы теплообмена и другие физико-химические процессы. В процессе формализации использованы некоторые допущения, каждое из которых критически оценено. Большинство уравнений и систем уравнений, полученных в результате формализации, необходимо решать итерационными методами. В связи с этим разработаны и реализованы на ЭВМ четкие алгоритмы моделирования отдельных подсистем и всей системы в целом.
3) Разработанная математическая модель позволяет: рассчитывать балансы комплексного производства по тепловым и материальным потокам, балансы по выработке и потреблению энергоносителей; определять некоторые экономические показатели производства; проводить поверочные расчеты теплообменного оборудования.
4) Сделано сравнение расчетных данных по модели с практическими данными, полученными при эксплуатации производства аммиака, и некоторыми литературными данными по комплексному производству. Полученные результаты достаточно хорошо совпадают. На основании вышесказанного сделан вывод о корректности разработанной модели.
5) В диссертационной работе предложены некоторые технические решения, направленные на снижение расхода природного газа и электроэнергии: организация выработки и потребления энергоносителей (водяной пар среднего и низкого давлений) при производстве метанола и дозирование кислорода в комплексное производство. Указанные решения, кроме того, позволяют более полно использовать имеющиеся отходы производств (кислород, низкопотенциальный пар) и законсервированное оборудование (паровую турбину).
6) Результаты расчета по разработанной модели показывают, что замена привода компрессора с электродвигателя на паровую турбину и организация выработки пара среднего давления при производстве метанола позволяет эффективно использовать тепло экзотермических реакций и экономить до 3300 кВт/ч электроэнергии. При этом контур метанола в составе комплексного производства является автономным по пару среднего давления.
7) Организация выработки пара низкого давления при производстве метанола позволяет использовать физическое тепло газовых смесей для получения теплоносителя (пара низкого давления), количества которого достаточно для обеспечения процесса ректификации метанола-сырца на 70-75 %. Недостающее количество теплоносителя восполняется за счет утилизации низкопотенциального пара, являющегося отходом существующего производства аммиака. При этом удается сработать до 50 % этого избыточного пара.
8) Дозирование кислорода в комплексное производство приводит к увеличению степени переработки природного газа и повышению выработки пара высокого давления за счет тепла физико-химических процессов. В результате потребление природного газа для получения этого энергоносителя снижается на 2500-3000 нм3/ч. Соответственно, снижается себестоимость основных продуктов, а величина чистого дисконтированного дохода возрастает на 50-90 млн. руб. за расчетный период в 10 лет.
9) Результаты моделирования различных режимов работы теплоэнерготехнологического комплекса совместного производства аммиака, метанола и энергоносителей показывают, что при комплексном производстве удельный расход природного газа на единицу произведенной продукции снижается на 3-4 %, значительно улучшаются экономические показатели производства и на 20-25 % сокращаются выбросы в атмосферу диоксида углерода.
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
1. Bob Brinker, Larry Shields, Nils Udenguard. Combining ammonia & methanol production. - Materials of a seminar on safe manufacture of ammonia. - Tuxon, USA, 1995.
2. Braun F. Creating a joint methanol and ammonia manufacture. Best options evaluation. - Materials of a seminar on safe manufacture of ammonia. - Tuxon, USA, 1995.
3. Combining methanol and ammonia production in ammonia production units. - Materials of a seminar of the company "Haldor Topsoe" on catalysts and technologies NН3 and МеОН. - Мoscou, 1995.
4. Combining methanol and ammonia production of ICI-Company. - Materials of a seminar on safe manufacture of ammonia. - Tuxon, USA, 1995.
5. Farnell Paul. Ways of steam reforming catalyst loading & unloading. - Materials of a seminar on safe manufacture of ammonia. - Tuxon, USA, 1995.
6. Geoffrey Gerald Weedon, Duhan Diego Martin, James Bernard. Process for the production of methanol. - United States Patent № 6,258,860. - 2001.
7. Haldor Topsoe's CMD cold bypass reactor operation results. - Materials of a seminar of the company "Haldor Topsoe" on catalysts and technologies NН3 and МеОН. - Мoscou, 1995.
8. Haldor Topsoe's methanol production processes overview. - Materials of a seminar of the company "Haldor Topsoe" on catalysts and technologies NН3 and МеОН. - Мoscou, 1995.
9. Instructions on SpiraLoadTM method of catalyst loading into tubular reforming furnace. - Materials of a seminar of the company "Haldor Topsoe" on catalysts and technologies NН3 and МеОН. - Мoscou, 1995.
10. Jeffrey H. Sherman, Peter C. Ford, Galen D. Stucky, Philip Grosso. Method of and apparatus for manufacturing methanol. - United States Patent № 6,214,176. - 2001.
11. Marco Badano, Franco Fabbri, Ermanno Filippi. Process for the ammonia and methanol co-production. United States Patent № 6,106,793. - 1997.
12. Simon Robert Early, Timothy Douglas Gamlin, Mark Andrew Linthwaite. Process and plant for the production of methanol. - United States Patent № 6,191,174. - 2001.
13. The technical information of company "TEC" on coproduction of ammonia and methanol. - Materials of a seminar of the company "Haldor Topsoe" on catalysts and technologies NН3 and МеОН. - Мoscou, 1995.
14. Toshio Hidaka, Emiko Yokose. Catalysts for methanol conversion reactions. - United States Patent № 6,153,798.- 1998.
15. АЗОТЭКОН. - № 12, 1999 г.
16. АЗОТЭКОН. - № 2, 2001 г.
17. АЗОТЭКОН. - № 8, 2002 г.
18. Аммиак. Вопросы технологии. / Под ред. Н.А. Янковского. – Донецк: ГИК ''Новая печать'', 2001. – 497 с.
19. Бесков В.С., Сафронов В.С. Общая химическая технология и основы промышленной экологии. – М.: Химия, 1999. – 472 с.
20. Бесков В.С., Флокк В. Математическое моделирование каталитических процессов и реакторов. – М.: Химия, 1991.
21. Вяткин Ю.Л. Некоторые результаты и задачи моделирования и оптимизации процесса синтеза метанола на медьсодержащем катализаторе. - Хим. пром., 1986, № 8, с.472.
22. Гультяев А. Визуальное моделирование в среде МАТLAB: учебный курс. - СПБ: ПИТЕР, 2000. – 432с.
23. Джон Р. Брайтлинг. Отчет о работе агрегата АМ-76. – ОАО ''Череповецкий ''Азот'', 2000.
24. Дытнерский Ю.И. Процессы и аппараты химической технологии. Т.1. – М.: Химия, 2002. – 400 с.
25. Ерохин В.Г. и др. Основы термодинамики и теплотехники. – М.: Машиностроение, 1980. – 224 с.
26. Жигарева Г.В. Состояние рынка и производства метанола. - ОАО ''НИИТЭХИМ'', 1999. - 24 с.
27. Золотарский И.А. и др. Совершенствование работы многотоннажных реакторов синтеза метанола. - Хим. пром., 1997, № 12, с.795.
28. Исследование технического состояния технологии и объектов ОАО ''Череповецкий ''Азот''. – Отчет ОАО НИУИФ. – М., 2002 г.
29. Каган Ю.Б. и др. О механизме синтеза метанола из двуокиси углерода и водорода. - Кинетика и катализ, 1976, т. 17, с. 440.
30. Карапетьянц М.Х. Химическая термодинамика. – М., Химия, 1975. – 546 с.
31. Касаткин А.Г. Основные процессы и аппараты химической технологии. – М.: Химия, 1973. – 752 с.
32. Кафаров В.В. Методы кибернетики в химии и химической технологии. - М.: Химия, 1968. – 234 с.
33. Кафаров В.В., Глебов М.Б. Математическое моделирование основных процессов химических производств. – М.: Высш. шк., 1991. – 400 с.
34. Кафаров В.В., Мешалкин В.П. Анализ и синтез химико-технологических систем. - М.: Химия, 1991. – 210 с.
35. Коваль П.И. и др. Оптимизация процесса синтеза метанола в агрегатах большой единичной мощности. - Хим. пром., 1995, № 3, с.3.
36. Коваль П.И. Физико-химический анализ и оптимизация технологии крупнотоннажного производства метанола. Диссертация на соискание ученой степени канд. техн. наук. РосАН. Сиб. отд-ние. Ин-т химии нефти. - Томск, 1997. - 132 с.
37. Кожухотрубчатые теплообменные аппараты общего и специального назначения. Каталог. - М.: ЦИНТИХИМНЕФТЕМАШ, 1991. – 108 с.
38. Колесов Ю.Б., Сениченков Ю. Б. Компьютерное моделирование в научных исследованиях и образовании. - EXPonenta: математика в приложениях. - 2003, №1, с. 12.
39. Кузнецов В.Д. и др. Равновесие синтеза метанола. - ТОХТ, 1977, № 6, с.866.
40. Лейтес И.Л., Сосна М.Х., Семенов В.П. Теория и практика химической энерготехнологии. – М.: Химия, 1988. – 280 с.
41. Лендер А.А. и др. Разработка ресурсо- и энергосберегающих технологий производства метанола – агрегат М-400, его совершенствование. - Хим. пром., 1999, № 3, с.172.
42. Лендер Ю.В. и др. О механизме низкотемпературного синтеза метанола. - Хим. пром., 1986, № 4, с.202.
43. Масленков С.Б., Масленкова Е.А. Стали и сплавы для высоких температур. Т.1. - М.: Металлургия, 1991. - 383 с.
44. Метанол и его переработка. Сб. науч. тр. Под ред. Ю.В. Лендера. – М.: НИИТЭхим, 1985. – 127 с.
45. Метанол: пути синтеза и использования. С.М. Локтев, А.Ш. Мосесов, А.Я. Розовский. – М.: ВНТИЦентр, 1984. – 139 с.
46. Методические рекомендации по оценке эффективности инвестиционных проектов. – В.В. Коссов, В.Н. Лившиц, А.Г. Шахназаров. – М.: Экономика, 2000 г. – 421 с.
47. Мочалин В.П. и др. Кинетическая модель процесса синтеза метанола на катализаторе СНМ-1. - Хим. пром., 1984, № 1, с.11.
48. Основные процессы и аппараты химической технологии. Пособие по курсовому проектированию. / Под ред. Ю.И. Дытнерского. – М.: Химия, 1991. – 496 с.
49. Очистка технологических газов. Под ред. Т.А. Семеновой и И.Л. Лейтеса. – М.: Химия, 1969. – 392 с.
50. Патрикеева Н.И. Направления разработок новых ресурсосберегающих технологий производства метанола. - Хим. пром., 1990, № 9, с.518.
51. Плановский А.Н. и др. Процессы и аппараты химической технологии. – М.:Химия, 1968. – 848 с.
52. Померанцев В.М., Редин А.В., Туболкин А.Ф. Равновесие реакции синтеза метанола при повышенных давлениях. - Хим. пром. 1998 № 6. с.333.
53. Производство аммиака. Под ред. В.П. Семенова. – М.: Химия, 1985. – 368 с.
54. Промышленная кожухотрубчатая теплообменная аппаратура. Справочник – каталог. - М.: ИНТЭК ЛТД, 1992. - 266 с.
55. Пястолов С.М. Экономический анализ деятельности предприятий - М. Академический Проект, 2002. – 573 с.
56. Редин А.В. Равновесие реакций синтеза метанола и конверсии оксида углерода (П) водяным паром в условиях промышленного синтеза. Автореферат диссертации на соискание ученой степени канд. техн. наук. - СПб., 2000. - 20 с.
57. Ривкин С.Л. Термодинамические свойства газов. – М.: Энергоатомиздат, 1987. – 287 с.
58. Ривкин С.Л., Александров А.А. Термодинамические свойства воды и водяного пара. – М.: Энергоатомиздат, 1984. – 80 с.
59. Рид Р., Праусниц Дж., Шервуд Т. Свойства газов и жидкостей/Пер. с англ. – Л.: Химия, 1982. – 592с.
60. Розовский А.Я. Синтез моторных топлив из природного газа. - Хим. пром., 2000, № 3, с.3.
61. Розовский А.Я. и др. Разработка гибких технологических схем производства метанола и модернизация действующих агрегатов. - Хим. пром., 1990, № 11, с.653.
62. Розовский А.Я. Кинетика каталитических реакций с участием прочно (''необратимо'') хемосорбироанных частиц. - Кинетика и катализ, 1989, т. 30, с. 533.
63. Розовский А.Я. Новые данные о механизме каталитических реакций с участием окислов углерода. - Кинетика и катализ, 1980, т. 21, с. 97.
64. Розовский А.Я., Лендер Ю.В. Развитие технологии производства метанола на базе новых теоретических основ процесса. - Хим. пром., 1990, № 8, с.454.
65. Селицкий А.П. и др. Материальные расчеты в производстве метанола-сырца. - Хим. пром., 1980, № 2, с.9.
66. Синтез аммиака. Под ред. Л.Д. Кузнецова. – М.: Химия, 1982. – 296 с.
67. Сиоли Г. и др. Новые промышленные реакторы для получения производных синтез-газа – аммиака и мочевины, метанола и формальдегида. - Хим. пром., 1997, № 5, с.63.
68. Скороход А.А. Оптимальная организация химико-технологических процессов на основе энерготехнологических циклов (на примере производств метанола и совместного синтеза метанола и высших спиртов). Автореферат диссертации на соискание ученой степени канд. техн. наук. - М., 2000. - 16 с.
69. Слинько М.Г. Математическое моделирование химических процессов и реакторов. - Хим. пром., 1990, № 2.
70. Слинько М.Г. Некоторые проблемы математического моделирования химических процессов и реакторов. - Хим. пром., 1987, № 2.
71. Соколов А.Ф., Аншелес В.Р. Некоторые вопросы оптимизации теплообмена в совместном производстве аммиака и метанола. - Материалы III-й международной научно-технической конференции ''Повышение эффективности теплообменных процессов и систем''. – Вологда, 2002 г.
72. Соколов А.Ф., Аншелес В.Р., Галанов М.Э. Некоторые вопросы создания математической модели производства аммиака при реальных условиях его реализации. Материалы международная научно-техническая конференция ''ИНФОТЕХ – 2001''. - Череповец, 2001г.
73. Сосна М.Х., Алейнов Д.П. Модернизация азотной промышленности – требования времени. - Хим. пром., 2001, № 5, с.7.
74. Справочник азотчика. Т.1. – М.: Химия, 1986. – 512 с.
75. Справочник по теплообменникам. Т.1. /Пер. с англ., под. ред. Б.С. Петухова. – М.: Энергоатомиздат, 1987. – 560 с.
76. Справочник по теплообменникам. Т.2. /Пер. с англ., под. ред. Б.С. Петухова. – М.: Энергоатомиздат, 1987. – 352 с.
77. Справочник химика. Т.5./ Под ред. Б.П. Никольского. – Л.: Химия, 1968. – 974 с.
78. Стандартные кожухотрубчатые теплообменные аппараты общего назначения. Каталог. - М.: ЦИНТИХИМНЕФТЕМАШ, 1988. – 38 с.
79. Столяров А.М., Столярова Е.С. Excel 2002. – М.: ДМК Пресс, 2002. – 480 с.
80. Теплотехника. / Под общей ред. И.Н. Сушкина. – М: Металлургия, 1973. – 480 с.
81. Технологический регламент производства аммиака мощностью 1360 т/сут на отечественном и частично импортном оборудовании. – ОАО ''Череповецкий ''Азот'', Череповец, 1997 г.
82. Технология синтетического метанола / Под ред. М.М. Караваева. – М.: Химия, 1984. – 240 с.
83. Тюрина Э.А. Математическое моделирование и технико-экономические исследования энерготехнологических установок синтеза метанола на угле и природном газе. Диссертация на соискание ученой степени канд.техн.наук. Рос.АН, Сиб. отд-ние, Сиб. энерг. ин-т. - Иркутск, 1994. - 123 с.
84. Унифицированные кожухотрубчатые теплообменные аппараты специального назначения. Каталог. - М.: ЦИНТИХИМНЕФТЕМАШ.,1987. - 30 с.
85. Халепа Н.В. Моделирование и оптимальная организация циклических режимов технологических схем получения метанола. Диссертация на соискание ученой степени канд. техн. наук. РХТУ им. Д.И.Менделеева. - М., 1994. - 136 с.
86. Черкасский В.М. Насосы, вентиляторы, компрессоры. – М.: Энергоатомиздат, 1984. – 416 с.
87. Широков Ю.Г. Теоретические основы технологии неорганических веществ. – Иваново, 2000. – 336 с.
88. Шуб Ф.С., Темкин М.И. О торможении водяным паром синтеза метанола на низкотемпературном катализаторе. - Хим. пром. 1990 № 12. с.702.
ПРИЛОЖЕНИЕ I.
Перечень исходных данных для
1. Составы потоков (% об.): Природный газ …Перечень основных расчетных результатов моделирования.
1. Концентрации целевых компонентов в газовой смеси после каждой стадии (% об.) 2. Соотношение Н2/N2 перед стадией синтеза аммиака 3. Производительность по аммиаку (т/час)– Конец работы –
Используемые теги: Современное, состояние, энергопотребления, производствах, аммиака, метанола0.088
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Современное состояние энергопотребления в производствах аммиака и метанола
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов