Физико-химический состав топлива
| Обозначения | Углерод С | Водород H | Кислород О | Азот N | Сера органическая Sорг | Сера колчеданная Sк | Гидратная влага Wг | Балласт | ||||||
| Зола А | Влага | |||||||||||||
| Аналитическая | Внешняя | |||||||||||||
| влага W а | влага W вн | |||||||||||||
| О | Органическая масса | |||||||||||||
| dаф | Сухая беззольная | |||||||||||||
| d | Сухая | |||||||||||||
| a | Аналитическая масса | |||||||||||||
| r | Рабочая (рабочее топливо) | |||||||||||||
| af | Влажная беззольная масса (-А) | |||||||||||||
Основными составляющими минеральной части топлива, поступающего на электростанцию, являются как простые оксиды и соли, так и сложные вещества:
– обводненные глинистые материалы (например, алюмосиликаты Al2O3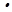 2SiO2
2SiO2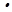 2H2O и др.);
2H2O и др.);
- кремнезем (кварц) SiO2;
- карбонаты СаСО3, МgСО3, FеСО3;
- сульфиды FeS2, СаS;
- сульфаты СаSО4, МgSО4, FеSО4;
- оксиды железа FеО, Fе2О3, Fе3О4;
- соли калия и натрия KCl, NaCl, фосфаты и др.;
- шпаты (например, К2О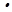 Al2O3
Al2O3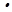 6SiO2);
6SiO2);
- доломит СаМg(СО3)2 ;
- так называемые малые отходы и др.
При всем многообразии состава минеральных веществ, для большей части топлива 95…98% из их балласта составляют алюмосиликаты, карбонаты и сульфаты.
Минеральная часть топлива в процессе горения балластирует горючую массу, образуя твердую или жидкую золу А, которая снижает теплотворную способность топлива. Участвуя в химических преобразованиях, она не создает теплового эффекта.
Отметим, что для выделения из минеральных веществ большинства из вышеназванных элементов (например, железа, алюминия и др.) в производственных технологиях используются термические приемы (расплавление).
2.4. Физико-химические процессы при сжигании топлива
Всякое топливо, как сырье тепловых электростанций, проходит цепочку технологических операций от момента добычи до выхода из котла в виде продуктов сгорания. Физико-химические преобразования его сопровождаются получением определенного количества энергии и выходом прогнозируемого количества различных газов, твердого шлака и золы (рис. 2.1).
Типичные экзотермические реакции горения топлива связаны, прежде всего, с процессами окисления различных химических элементов. В табл. 2.2 представлены такие реакции, проходящие с тепловым эффектом. Там же даны количественные характеристики, как самих химических элементов, так и энергетических результатов реакций. Как видно из табл. 2.2, основными продуктами реакций являются углекислый газ СО2 и водяной пар Н2О, при соединении которого с окислами серы, азота и углерода образуются кислоты. Помимо вышеперечисленных реакций, идут реакции с образованием  из азота, находящегося в топливе и в воздухе, привлекаемом к процессам окисления. Сера в топливе может быть не только в чистом виде, но и в составе колчедана
из азота, находящегося в топливе и в воздухе, привлекаемом к процессам окисления. Сера в топливе может быть не только в чистом виде, но и в составе колчедана  и сульфата (например,
и сульфата (например, 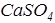 ), который может образовываться из реакции с карбонатами при температурах
), который может образовываться из реакции с карбонатами при температурах  . При t >1000 0С сульфаты, в свою очередь, разлагаются до окислов серы и кальция. Колчедан при
. При t >1000 0С сульфаты, в свою очередь, разлагаются до окислов серы и кальция. Колчедан при 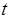 >400 0C окисляется с образованием окислов серы и железа.
>400 0C окисляется с образованием окислов серы и железа.
В процессе горения минеральная часть топлива преобразовывается в основном в простые оксиды SiO2, Al2O3, FeO, Fe2O3, CaO, MgO, K2O, Na2O, TiO2, количественное содержание которых в выбрасываемых на ТЭС золе и шлаке приведено в табл. 2.3. Однако в продуктах сгорания возможно существование сульфатов (СаSО4, МgSО4, FеSО4) как первичного, так и вторичного происхождения, а также малые отходы.
В условиях больших температур (более 1000 0С) из твердых составляющих продуктов сгорания образуются шлак (жидкий) и твердая зола. Шлак представляет собой минеральную массу с включением небольшого количества механического недожега. После высокотемпературной обработки шлак приобретает оплавленный (спекшийся) вид и повышенную прочность. В шлаковом расплаве между составляющими оксидами протекают химические реакции с образованием более сложных минералов кислотного и щелочного (основного) свойства.