Алғы сөз
Металдар мен қорытпалар өндіруді қарастыратын ғылым мен техника және өндіріс саласын металлургия деп атайды. Металлургия тарихи қара және түсті болып екіге бөлінсе, қара металлургия шойын металлургиясы, болат металлургиясы және т.б. бөлінеді.
Металлургияның, оның ішінде әсіресе болат металлургиясының, адамзат қоғамының дамуында маңызы өте зор. Өйткені болат өнеркәсіптің, техниканың және т.б. саланың негізгі конструкциялық материалы болып келді және болашақта да бола бермек.
Болат – көп компонентті негізі темір қорытпа. Болатты көптеген сипаттамалары бойынша жіктейді. Химиялық құрамы бойынша екі үлкен топқа бөлінеді:
1) көміртекті болат;
2) қосындылы (қоспалы) болат.
Құрамында тұрақты элементтермен (Si, Mn, P, S,) қатар көміртегісі 0,025-2,14%, негізі темір қорытпаны көміртекті болат деп атайды. Болатқа белгілі бір қасиет беру үшін қосынды (қоспа) деп аталатын элементтерді (Al, Cr, Ni, W, V, Mo, Ti және т.б.) арнайы қосу арқылы алынатын болатты қосындылы деп атайды.
Көміртегі-болаттың құрылымы мен қасиетін анықтайтын негізгі элементтің бірі. Кремний мен марганец пайдалы элементтер қатарына жатады, олардың мөлшері көміртекті болаттардағыдан асқанда қосынды элемент болып есептелінеді. Фосфор мен күкірт зиянды элементтер болғандықтан, олардың мөлшері болат сапасына қарай шектеулі (0,015-0,055% S; 0,025-0,045% Р).
Көміртегі мөлшері бойынша екі топтың да болаты төмен көміртекті (көміртегі 0,3%-дан төмен), орташа көміртекті (0,3-0,7% C) және жоғары көміртекті (көміртегі мөлшері 0,7%-дан жоғары) болып жіктеледі.
Қоспалы болат қосынды элемент түріне қарай хромды, марганецті, кремнийлі, хромникельді, хромникельмолибденді және т.б. болып бөлінеді. Қосынды элемент мөлшеріне қарай төменгі қосындылы (қосынды элементтер мөлшері 2,5%-ға дейін), орташа қосындылы (2,5-10%) және жоғары қосындылы, (10%-дан жоғары) болат болып жіктеледі.
Болат қорыту агрегатының түріне қарай электрлік пештерде болат өндіру, оттегілі конвертерлік және мартендік болып бөлінеді.
Кіріспе
Болат өңдірудің негізгі екі жолы бар:
1 Бір сатылы темір кені-болат сұлбасы бойынша темір кенін тотықсыздандыру арқылы темір алу. Бұл тәсілге темір кенін тура тотықсыздандыру арқылы кеуек темір алу жатады.
2 Екі сатылы темір кені-шойын-болат сұлбасы бойынша болат өндіру.
Қазіргі кезде болат өндіру негізінен екі сатылы сұлба бойынша жүзеге асырылады. Алдымен домна пешінде шойын қорытып, содан кейін шойыннан болат қорыту үрдістерінің бірімен болат өндіру.
Болат өндірудің негізгі тәсілдерінен электрлік пештерде және конвертерлік үрдістермен болат қорытуды атаған жөн. Болат қорыту агрегатындағы (конвертердегі) сұйық шойынды ауа немесе оттегімен үрлеп, болат алуды конвертерлік тәсіл деп атайды.
Болат қорыту тәсілдерінің ішінде оттегілі конвертерлік үрдістер болат өндіру бойынша бірінші орынға шықты. Қазіргі кезде барлық қорытылатын болаттың 2/3 бөлігі осы үрдістерге тиесілі. Өйткені тәсіл жоғары өнімділігімен, капиталсалымның аздығымен, химиялық құрамы әр түрлі шойынды пайдалану мүмкіншілігімен және т.б. артықшылықтарымен ерекшеленеді. Сонымен бірге шикіқұрамдық материалдарды алдын ала даярлау шаралары, балқыманы пештен тыс өңдеу тәсілдерін қолдану және т.б. конвертердің өнімділігін арттырумен қатар болаттың сапасын жақсартуды мүмкін етті.
Конвертерлік тәсілдің ішінде кеңірек тарағаны 20-ғасырдың екінші жартысында ашылған сұйық шойынды техникалық таза оттегімен үрлеу үрдістері. Дүниежүзілік практикада болат мөлшерін ұлғайту осы үрдістер арқылы іске асырылады.
Конвертер (ағылш. converter) деп аталатын болат қорыту агрегатының орталық цилиндрлік бөлігі төменнен сфералы түппен жалғасып, жоғарыдан ашық симметриялы қиық конуспен жалғасқан. Қазіргі конвертерлердің шегені негізді оттөзімді кірпіштен қаланып, сыртынан қалың болат қаңылтырмен қапталған.
Үрдістің негізгі шикіқұрамдық металдық бөлігі сұйық шойын мен скрап (болат қалдықтары). Шикіқұрам элементтерін тотықтырып төмендету үшін техникалық таза оттегімен үрлеп әрі қатты тотықтандырғыштар (темір кені және т.б.) қолданады. Қожтүзгіш материалдар ретінде әк және т.б. қолдану көзделген. Балқыманы оттегісіздендіру және қосындылау үшін әр түрлі ферроқорытпалар (ферросилиций, ферромарганец және т.б.) шөмішке металды ағызу кезінде салынады.
Скрапты салу, шойынды құю, қожтүзгіш материалдарды салу, балқыманы оттегімен үрлеу, болат пен қожды ағызу және т.б. технологиялық операцияларды орындау үшін конвертер горизонталь өс бойымен 3600-қа айнала алады.
Сонымен конвертердегі металдық шикіқұрамды (шойын, скрап) техникалық таза оттегімен (99,5%) үрлеу үрдісінде элементтер (Si, Mn, C, P, S және т.б.) тотығып, экзотермиялық реакциялардан балқыманың температурасы көтеріліп, элементтер керекті мөлшерге төменделген соң, шөмішке ферроқорытпаларды есептеп салып, болат маркасының берілген химиялық құрамы қорытылып алынады.
Конвертерлік үрдісте балқыманы техникалық таза оттегімен үрлеудің төрт тәсілі бар:
1) жоғарыдан;
2) түптен;
3) бүйірден;
4) комбинациялы (жоғарыдан әрі түптен).
Сұйық шойынды конвертер бүйірінен оттегімен үрлеу сыйымдылығы аз конвертерлерде орын алады әрі қолданылуы шектеулі. Қалған үшеуі жақсы даму үстінде, кейінгі кезде әсіресе комбинациялы үрлеу.
Сондықтан оқу құралында түптік ауа үрлеме конвертерлік үрдістерінен гөрі оттегілі конвертерлік үрдістерге көбірек көңіл бөлінген.
Жоғары оқу орындарының металлургиялық және т.б. техникалық мамандықтарындағы студенттерге арналған оқу құралы болат қорытудың конвертерлік үрдістерінің теориясы мен технологиясына арналған.
1 Болат қорыту үрдісінің физика-химиялық негізі
1.1 Болат қорыту үрдісінде физикалық химияның заңдарын қолдану
Конвертерлік болат қорыту-күрделі үрдіс. Болат қорыту барысында үрлеме әсерінен шойын элементтері тотығып, қожтүзгіш материалдармен қож түзіліп, шеген-металл-қож-газ жүйесінде физика-химиялық үрдістер орын алады. Сондықтан болат қорыту үрдісін басқаруда физикалық химияның заңдарына сүйенеді. Металл мен қождағы әр түрлі түрленістердің энергетикалық жағдайын, үрдіс мүмкіндігін, бағытын және тепе-теңдігін анықтауда термодинамиканың жалпы заңдарына, ал орын алып жатқан үрдістердің жылдамдығын анықтауда кинетиканың заңдарына сүйенеді [1, 2].
Жылу тепе-теңдігін және жылудың энергияның басқа түрлеріне түрлену заңдарын зерттейтін ғылымды термодинамика деп атайды. Химиялық термодинамикада термодинамиканың жалпы заңдарын физика-химиялық үрдістерге қолдану қарастырылады [1]:
1) белгілі жағдайда химиялық реакциялардың немесе фазалық түрленістердің өздігінен өту мүмкіндігін білу;
2) әр түрлі заттардың тепе-теңдікте болу шарттарын тағайындау;
3) химиялық реакциялар мен фазалық түрленістердің термо-химиялық эффектін анықтау.
Болат металлургиясында қолданылатын термодинамиканың негізгі қағидалары. Термодинамикада әр түрлі жүйелер зерттеледі. Зерттеу үшін қоршаған ортадан бөлініп алынған денелер тобын жүйе деп атайды. Конвертердің шегені, металы, қожы және газ атмосферасы жүйе мысалы бола алады. Физика-химиялық жүйесінің күйі фаза және компонент санымен сипатталады. Жүйенің басқа бөлігінен бет аралық бөлінген, оның біртекті бөлігін фаза дейді. Жүйені құратын заттарды компонент деп атайды. Жүйе гомогенді (бір фазалы) және гетерогенді (көп фазалы) болып бөлінеді. Жүйе гомогенді, егер оның барлық бөлігі құрамы және қасиеті бойынша бірдей болса. Қасиеттері әр түрлі жүйе бөліктері (фазалары) бір-бірімен бет аралық бөлінсе, онда жүйе – гетерогенді.
Жүйе күйін термодинамикалық параметрлер – температура, қысым, көлем, концентрация және т.б. сипаттайды. Жүйе күйі параметрлерінің өзгеруінен термодинамикалық үрдіс орын алады.
Күй параметрлерінің өзгеруіне байланысты жүйедегі өзгерістерді, яғни үрдісті сипаттайтын шамаларды үрдіс параметрлері деп атайды.
Болат қорыту үрдісі негізінен изобаралық жағдайда (қысым тұрақты) өтетіндіктен, термодинамикалық есептеулерде Гиббс энергиясының (∆G), энтальпияның (∆H), жылу эффектісінің (Qp) өзгеру мәндері қолданылады.
 |
Негізгі термодинамикалық функциялардың ара қатынасын сұлба ретінде келтіруге болады (1.1 сурет). Заттың жалпы энергия қорын ішкі энергия (U) деп атайды. Химиялық реакциялардың жүру нәтижесінде ішкі энергия не азайып, не көбейіп өзгереді (∆U). Термодинамикалық есептеулерде ∆U мәнін білу жеткілікті.
Қысым тұрақты болғанда энтальпия мен ішкі энергия арасында қатынас мынандай [1]
H=U+pV (1.1)
мұндағы
Н - энтальпия;
U - ішкі энергия;
pV - сыртқы ортаға шығатын көлемдік энергия.
Қатты және сұйық затқа үлкен қысым түссе немесе зат газ күйінде болса, онда көлемдік энергияның мәні едәуір. Аз қысым түсетін қатты және сұйық үшін pV мәні өте аз, сондықтан энтальпия мен ішкі энергия өзара тең деуге болады.
Энтальпияның абсалюттік шамасының өзгеруі жылу эффектісіне тең. Егер реакция кезінде жылу шығарылса, онда жылу эффекті оң (+Qp). Бұндай реакцияны экзотермиялық деп атайды. Жүйе энтальпиясының өзгеруі теріс (∆H<0). Бөлініп шыққан жылу шамасына жүйенің энталпиясы кемиді, яғни Qp= –∆H.
Егер реакция кезінде жылу сіңірілсе, онда жылу эффекті теріс (–Qp). Реакция эндотермиялық. Жүйе энтальпиясының өзгеруі оң (∆H>0). Сонда –Qp=∆H.
Термодинамиканың екінші заңы бойынша ішкі энергияның толықтай жұмысқа түрленуі мүмкін емес. Ішкі энергияның жұмысқа түрленбейтін бөлігін байланған энергия, ал энергияның жұмысқа түрленетін бөлігін бос энергия (F) деп атайды. Байланған энергия температура мен энтропияның көбейтіндісіне (TS) тең.
Көлем тұрақты болғанда жүйенің немесе заттың бос энергиясының өзгеруін төмендегі теңдеумен көрсетуге болады
∆Fv=∆U – T∆S (1.2)
(U–TS) функциясы көлем тұрақты болғандағы бос энергияны сипаттайды.
Температурасы мен қысымы тұрақты келген жүйе үрдісінің жүру мүмкіндігінің бағытын көрсететін функцияны Гиббс энергиясы деп атап, мына теңдеумен анықтайды
G = H – TS (1.3)
немесе
∆G = ∆H – T∆S (1.4)
Термодинамиканың екінші заңы бойынша изобара-изотермиялық жүйе үрдісі өздігінен жүре алады, егер жүйенің бос энергиясы кемитін болса. Егер ∆G<0 болса, онда үрдіс (реакция) тура бағытта жүре алады. Егер ∆G=0 болса, реакцияның тепе-теңдік күйіне жеткені. Егер ∆G>0 болса, реакция тек кері бағытта жүре алады.
Реакцияның қай бағытта қандай дәрежеде жүретінін тепе-теңдік константасы (Кр) көрсетеді. Бос энергия өзгеруі мен реакцияның тепе-теңдік константасының арасында мынандай қатынас бар [1]
ΔG=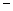 RT·lnKp (1.5)
RT·lnKp (1.5)
мұндағы
R – газ тұрақтысы.
Егер ∆G=∆H–T∆S десек, онда
RlnKp=ΔS–ΔH/T (1.6)
Соңғы теңдеуден (1.6) ∆S мәні неғұрлым үлкен, ал ∆H мәні неғұрлым кіші болса, соғұрлым реакцияның толымды өтетіні көрінеді. Температура жоғарылаған сайын энтропиялық фактор артып, энтальпиялық фактор кемиді.
Теңдеуге (1.5) газ тұрақтылығының мәнін қойып, натурал логарифмді ондыққа ауыстырсақ, қолдануға ыңғайлы мына формула алынады
∆G= –19,155T·lgKp (1.7)
Бос энергия өзгеруінің таңбасы тепе-теңдіктің ығысу бағытын анықтаса, оның шамасы ығысу дәрежесін көрсетеді.
Болат қорыту реакциялары константасының мәнін эксперименттік және есептік жолмен анықтайды. Практикалық есептеулер үшін бос энергияның өзгеруін үрдістің (реакцияның) стандарттық жағдайында анықтау ыңғайлы болады. Стандарттық күйде әрбір компоненттің парциалдық қысымы 100 кПа, активтілігі бірге тең деп қабылданады. Стандарттық температураны 25°С-ға тең, яғни 298К деп алып, параметр шамаларын ∆G°, ∆H°, ∆S° деп белгілейді.
Теңдеуден (1.7) lgKp табамыз, сонда
lgKp= –∆G0/19,155 Т (1.8)
мұндағы
∆G0 – реакцияға қатысушы стандартты күйдегі заттардың бос энергиясының өзгеруі.
Теңдеуге (1.8) ΔG=ΔH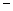 TΔS қойсақ мына формула шығады
TΔS қойсақ мына формула шығады
lgKp= –∆H0/19,155 Т + ∆S0/19,155 (1.9)
Болат қорыту үрдісінің температураларында ∆H0, ∆S0 мәндері аз өзгеретіндіктен, есептеу үшін олардың 16000С-дағы мәндерін алады. Сонда
lgKp= –∆H01873/19,155 Т + ∆S01873/19,155 (1.10)
Идеал жүйенің кейбір заңдарын нақты жүйе үрдісінде қолдану.Физика-химиялық үрдістерді зерттеуде, идеал жүйенің де қағидаларын пайдаланады. Идеал газ үшін молекула аралық күш әсері мен молекулалардың көлемін есепке алмайды. Сонда физика-химиялық тепе-теңдік теңдеулері ықшамдалады. Енді оларды қасиеттері бойынша идеалға жақын жүйелерге, яғни сиреген газ бен сұйытылған ерітіндіге қолдануға болады [3]. Жоғары температура мен төменгі қысымдағы нақты газдың қасиеттері идеал газға жақын.
Болат балқымасының көптеген компоненттерінің темірдегі ерітінділері идеал күйге жақындай қоймайды. Бірақ кейбір компоненттердің темірдегі мөлшері аз. Ерігіш заттың концентрациясы азайғанда, нақты ерітіндінің қасиеті идеалға жақындайды. Бұндай ерітіндіні сұйытылған деп атайды. Сұйытылған ерітіндіге Генри заңын қолдануға болады. Сұйытылған ерітіндінің тепе-теңдік күйінде еріген газдың концентрациясы, оның ерітінді үстіндегі қысымына тура пропорционал
С = L×p (1.11)
мұндағы
С – газ концентрациясы;
L – Генри константасы;
р – газдың парциалдық қысымы.
Газ ерігіштігінің тепе-теңдік константасының температураға тәуелділігі
dlnL/dT=ΔH/RT2 (1.12)
Еріткіш пен ерігіш бөлшектерінің өзара әрекеті әр түрлі болуы мүмкін. Ерігіштің еріткішпен әрекеттесуінің сандық сипаттамасының шамасын, берілген компоненттің ерітіндідегі активтілігі деп атайды.
Идеал күйге арналған заңдарды нақты жүйенің үрдістеріне қолдану үшін тепе-теңдік теңдеулеріндегі концентрация мен парциалдық қысым орнына активтілік (а) пен газ ұшпалығын (f) қолданып, түзетулер енгізеді. Активтілік немесе ұшпалық мәнін анықтау үшін концентрацияны немесе парциалдық қысымды түзету коэффициенті немесе нақты жүйедегі компонент қасиеттерінің идеал жүйедегі қасиеттерінен ауытқу дәрежесі болып табылатын, активтілік коэффициентіне (γ) көбейтеді: а=gi·Сі, fі=gi·pі. Өте сұйытылған ерітіндіде активтілікті концентрацияға немесе мольдік бөлікке тең деп алуға болады: аі=Сі, аі=Ni.
Болат қорыту үрдісінде ерігіш компонент сипаттамасының өзгерісін қарастырғанда Генри заңы қолданылса, еріткіш компонент сыйпаттамасын қарастырғанда Рауль заңы қолданылады. Тепе-теңдік күйде (берілген температурада) ерітінді компоненті буының парциалдық қысымы, оның ерітіндідегі мольдік бөлігіне тура пропарционал
p = p0·N (1.13)
немесе нақты жүйе үшін
p = p0·а (1.14)
мұндағы
р – ерітінді үстіндегі компонент буының парциалдық қысымы;
p0 – таза компонент үстіндегі қаныққан бу қысымы;
N – компоненттің ерітіндідегі мольдік бөлігі;
а – компоненттің ерітіндідегі активтілігі.
Егер екі өзара араласпайтын сұйықтан тұратын гетерогенді жүйеге екі сұйықта да еритін үшінші затты қосса, ол екі сұйық арасында Нернст-Шилов бөліну заңы бойынша бөлінеді. Екі өзара жанасқан, бірақ араласпайтын фазаларда еріген зат концентрациясының немесе активтілігінің қатынасы тепе-теңдік күйде тұрақты температурада тұрақты шама болады
L=(M)/[M]=a(M)/a[M] (1.15)
мұндағы
L – заттың фазалар арасында бөліну коэффициенті немесе константасы;
(М) – заттың қождағы концентрациясы;
[М] – заттың металдағы концентрациясы;
а(М) – заттың қождағы активтілігі;
а[М] – заттың металдағы активтілігі.
Металдың оттегімен тотығуға бейімділігі.Болат өндіруде темір және басқа элементтердің (Si, Mn, C, P және т.б.) оттегімен тотығу үрдісі орын алады
Me+O2=MeO2. (1.16)
Металдың тотығушылығы оттегі-тотық жүйесінің тепе-теңдік жағдайында оттегі қысымының шамасымен анықталады
KP=1/pО2 (1.17)
∆G°=RTlnpО2 (1.18)
Оттегі қысымы неғұрлым аз болса, соғұрлым тотық берік.
Егер металл мен оның тотықтары ерітіндіде бос күйде болмаса, онда
m[MeO]=n[Me]+O2; (1.19)
Kp=рО2аn[Me]/am[MeO] (1.20)
pO2=Kpam[MeO]/аn[Me] (1.21)
Егер металл мен оның тотығы стандарттық күйде болса, олардың активтілігін бірге тең деуге болады, сонда
Kp=рО2=р0О2 (1.22)
Жалпы жағдайда
рО2=р0О2am[MeO]/аn[Me] (1.23)
Оттегі қысымы ерітіндідегі тотықтың активтілігіне тура пропорцианал, ал ерігіш компонент активтілігіне кері пропорционал.
1.2 Болат қорыту үрдісінің кинетикасы
Химиялық құрамы белгілі болат алу үшін физика-химиялық үрдістің термодинамикалық сипаттамаларымен бірге оның кинетикалық сипаттамалары керек. Химиялық реакциялар жылдамдықтарының өзгеру заңдылықтарын білу өте маңызды.
Болат қорыту үрдісінің реакциялары негізінен араласымды сұйық ортада жоғары температуралығымен (балқыманы шөмішке ағызардағы температурасы 1600-1650°), гетерогендігімен (реагенттер түрлі фазадан) және бір мезгілде өтуімен ерекшеленеді.
Болат қорыту үрдісінде орын алатын реакцияларды үш кезеңнен тұрады деуге болады [4]:
1) реакциялық зонаға реагенттерді жеткізу;
2) химиялық реакцияның өтуі;
3) реакциялық зонадан өнімдерді әкету.
Химиялық реакцияның өтуі негізінен жылдам, сондықтан үрдіс жылдамдығы не реагенттерді жеткізу жылдамдығымен, не өнімдерді әкету жылдамдығымен анықталады.
Реакциялық зонаға реагенттерді жеткізуді қарастырғанда, элементтің металдағы немесе қождағы диффузия жылдамдығын, элементтің фаза аралық шекарадан өтуін және балқыманың араласуына әсер ететін факторларды ескерген жөн.
Химиялық реакцияның жылдамдығы.Гомогенді реакцияның
m[A]+n[B]=[D] (1.24)
жылдамдығын әсер етуші массалар заңы бойынша мына теңдеумен анықтауға болады [5]
υ=K[A]m·[B]n (1.25)
мұндағы
[А], [В] – компоненттердің концентрациясы (активтілігі);
m, n – стехиометрикалық коэффициенттер немесе компоненттер-дің мольдік саны;
k – компоненттер концентрациясы (активтілігі) бірге тең болғандағы реакция жылдамдығының константасы.
Нағыз жылдамдық константасы реагенттер концентрациясына тәуелді емес, ол заттың табиғатын, үрдіс температурасын және т.б. сыртқы факторлар әсерін ескеретін реакцияның кинетикалық сипаттамасы болып табылады.
Жылдамдық константасының температураға тәуелділігі Аррениус теңдеуі арқылы анықталады
k = k0e–E/RT (1.26)
мұндағы
k0 – экспоненциал алдындағы көбейткіш;
E – реакцияны активтендіру энергиясы.
Реакцияны активтендіру энергиясы зат бөлшектері (ион, атом, молекула) энергиясының орташа деңгейінен жоғары, үрдістің орын алуы үшін керекті қосымша энергия.
Жалпы жағдайда болат қорыту реакциялары сияқты көп сатылы үрдістің жылдамдығы, әр сатының жылдамдығымен анықталады
υΣ =1/(1/υ1+1/υ2+1/υ3+…) (1.27)
мұндағы
υå – үрдістің жалпы жылдамдығы;
υ1, υ2, υ3 және т.б. – жеке сатылардың жылдамдығы.
Айталық бір сатының жылдамдығы басқалардан өте төмен. Онда үрдістің жылдамдығы, осы ең ақырын жүретін сатының жылдамдығымен анықталады.
Болат қорыту реакцияларының жылдамдығы диффузия жылдамдығымен де анықталады, әсіресе болат қорыту агрегатында балқыма аз қозғалмалы болғанда. Фика заңы бойынша заттың диффузиялық ағыны концентрация градиентіне тура пропорционал
Q = –DΔC(1.28)
мұндағы
Q – заттың диффузиялық ағыны;
D – диффузия коэффициенті;
∆С – зат концентрациясының градиенті.
Сұйықтың диффузиялық коэффициенті температураға, сұйық тұтқырлығына және диффузиядағы бөлшектің өлшеміне байланысты болып, Стокс-Эйнштейн теңдеуі бойынша анықталады
D=RT/N·1/6πηr=kT/6πηr (1.29)
мұндағы
N – Авогадро саны;
k – Больцман тұрақтысы;
η – сұйықтың динамикалық тұтқырлығы;
r – диффузиядағы бөлшек радиусы.
Көпшілік жағдайда болат қорыту астауы фазалық бөліну беті әжептәуір үлкен және жаңа фазаның түзілу үрдісі жеңілдеу келетін жүйе болып табылады. Металл-шеген, металл-газ көпіршігі, металл-металл емес кірінді және т.б. бөліну беті жаңа фазаның түзілуін жеделдетеді. Балқыманы оттегімен үрлеу орын алғанда, үрдіс жылдамдығы негізінен массажылжым арқылы анықталады.
Қазіргі қолда бар реакция жылдамдығы константасының өзгеру заңдылықтары мен диффузия коэффициенті туралы деректер жетімсіз.
Болат қорытудың теориялық қағидалары мен өндірістік деректер элементтердің тотығу реакциясының кинетикасында мынадай заңдылықты тұжырымдауға негіз болады: элементтердің жалпы тотығу жылдамдығы оттегінің балқымаға ену жылдамдығына тура пропорционал
υå =k·iO2(1.30)
мұндағы
k – пропорционалдық коэффиценті;
iO2– оттегінің меншікті қарқындылығы.
Қорыта айтқанда, бірнеше сатыдан тұратын күрделі гетерогенді болат алу үрдісінің жылдамдығы, химиялық реакцияның жылдамдығымен емес, үрдістің ең ақырын жүретін сатысының жылдамдылығымен анықталады. Демек реакциялардың жылдамдығы реакциялық зонаға реагенттерді жеткізу мен одан өнімді әкетудің диффузиялық үрдістерімен анықталады.
Реагенттерді реакциялық зонаға жеткізу және реакция өнімдерін әкетуде, фазалар жанасу бетінің үлкен, фазалар тұтқырлығының және фаза аралық кедергінің аз болуының маңызы зор.
Егер фазалар жақсы араласатын болса, онда орын алатын реакциялар турбуленттік диффузия әсерінен үдейтін болады. Конвертерлік үрдісте турбуленттік диффузия коэффициенті жоғары. Оттегімен үрлеу барысында металл мен қож көптеген тамшыларға бөлініп, фазалардың жанасу беті ұлғайып, соның әсерінен реакциялардың жылдамдығы артып, СО көпіршіктерінің әсерінен газметаллқож эмульсиясы түзіліп, беттік құбылыстардың рөлі артады.