Ождың құрылысы мен қасиеті
Конвертерлік болат қорыту үрдісінде шойын мен скрап элементтері тотығып, қожтүзгіш және басқа қосымша материалдар қож түзілу үрдісіне араласып, балқыма мен жоғары температура әсерінен шегеннің тозуы орын алып, нәтижесінде болатпен қатар қож деп аталатын қосымша өнім немесе металл емес фаза түзіледі.
Сонымен болат қорыту барысында қож құрылады:
1) шойын мен скрап элементтерінің тотығу өнімдерінен (SiO2, MnO, FeO, P2O5, FeS және т.б.);
2) әк, боксит және т.б. қожтүзгіш материалдардан (CaO, SiO2, Al2O3, Fe2O3, CaF2 және т.б.);
3) темір кені, агломерат және окатыштан (темір тотықтары, кремнезем және т.б.);
4) скрап татынан (темір тотықтары);
5) конвертер шегенінің тозуынан (СаО, MgО және т.б.);
6) шикіқұрамдық материалдармен енетін құм, балшық т.с.с. (SiO2, Al2O3 және т.б.).
Қождың рөлі.Металл-қож фазалары арасындағы химиялық реакциялар тепе-теңдікке жетуге бағытталған, сондықтан берілген құрамды болатты қорытуда қож маңызды рөл атқарады. Мысалы, зиянды элементтерді (P, S) металл фазасынан негізді қож (СаО мөлшері жоғары) фазасына шығарып, кері өтпеу жағдайын туғызу арқылы, олардың болаттағы мөлшерін төмендетеді.
Қожға қойылатын негізгі талаптар:
1) металды зиянды элементтерден тазартуды қамтамасыз ету;
2) болат балқыту үрдісінің технологиясына сәйкес оттегіні металға керекті қарқындылықпен жеткізу;
3) зиянды газдардың (азот, сутегі т.б.) металға өтуін тежеу;
4) жоғары көтерілген металл емес кірінділерге жақсы жұғып, ассимиляциялау және өзінде еріту;
5) шөміштегі болаттың салқындауын тежеу.
Шикіқұрамдық, қожтүзгіш материалдардың және қорытылатын болат құрамына қарай қожтүзгіштерді есептеп салып, қождың керекті құрамы алынады. Қож түзілу жылдамдығы, яғни қожтүзгіш материалдардың сұйық гомогенді ерітіндіге өту жылдамдығы температура, қождың алғашқы құрамы, араласу қарқындылығы, материалдардың ірілігі, оларды салу реті және т.б. факторларға байланысты. Ал конвертер сияқты болат өндіру өнімділігі өте жоғары агрегат қож түзу үрдісін қарқынды жүргізуді талап етеді. Сондықтан қож түзу үрдісін жеделдету шаралары қарастырылады.
Қождың минералогиялық құрамы.Қождың тотықтарын химиялық қасиеттері бойынша үш топқа бөлуге болады:
1) қышқылды (SiO2, P2O5, TiO2, V2O5);
2) негізді (CaO, MgO, FeO, MnO);
3) амфотерлі (Al2O3, Fe2O3, Cr2O3).
Болат қорыту үрдістері қождарының минералогиялық талдауы, олардың мына қосылыстардан тұратынын көрсетеді:
1) силикаттар (CaO)2·SiO2; (FeO)2SiO2; (MgO)2·SiO2 және т.б.
2) фосфаттар (CaO)4·P2O5; (FeO)3· P2O5 және т.б.
3) алюминаттар FeO·Al2O3; CaO·Al2O3; MgO·Al2O3;
4) ферриттер FeO·Fe2O3; CaO·Fe2O3; (CaO)3·Fe2O3.
Қождарда бұлардан да құрамы күрделілеу қосылыстардың түзілуі орын алады.
Сульфидтер қожда CaS, MnS, FeS түрінде кездеседі.
Балқыған қождың құрылысы.Сұйық қож теориясының дамуы өзінің бастауын қождың молекулалық немесе химиялық теориясынан алады. 20-ғасырдың 30-жылдары Г. Шенктің (Германия) дамытқан молекулалық теориясы бойынша балқыған қождағы өзара әлсіз байланысқан оксидтер және олардың қосылыстары молекулалар түрінде деп қарастырылды. Оксидтің химиялық активтілігі, оның бос концентрациясына тең деп алынды.
Молекулалық теория металл-қож фазалары арасында орын алатын үрдістер, қождың физика-химиялық қасиеттерін және т.б. сипаттауда жетімсіздеу болды. Осы салада жүргізілген терең зерттеулердің нәтижесінде балқыған қождың иондық теориясы дүниеге келді.
20-ғасырдың 50-60 жылдары Россия ғалымдары А.И. Самарин, О.А. Есин, М.И. Темкин, Л.А. Шварцман, В.А. Кожеуров және т.б. еңбектерімен қож құрылысының иондық теориясы құрылды [8-10].
Иондық теорияға сәйкес қож иондар ерітіндісі болып табылады. Катиондар мен аниондардан тұратын қож балқымасында иондық (гетерополярлы) байланыс басым, сонымен қатар коваленттік (гомеополярлы) байланыс та орын алады.
Рентген құрылымдық зерттеулер қождың кристалды оксидтері, силикаттары, алюминаттары, ферриттері,фосфаттары молекулалардан емес, кристалл торы түйіндерінде орналасқан иондардан тұратынын көрсетті. Мысалы, Ca2SiO4 қосылысы Ca2+ және SO44- иондарынан тұрады.
Қождың оксиді, сульфиді және фториді мына иондарға ыдырайды:
FeO→ Fe2++O2–; CaO→Ca2++O2–; MnO→Mn2++O2–;
MgO→Mg2++O2–; SiO2+2O2–→SiO44–; P2O5+3O2–→2PO43–;
Fe2O3+O2–→2FeO2–; Al2O3+O2–→2AlO2–; CaF2→Ca2++2F–;
CaS→Ca2++S2–; FeS→Fe2++S2–.
Кремнезем мөлшері жоғары қожда кремнийоттегілі иондар тізбекті, қабатты және т.с.с. келген өте үлкен аниондар түзеді, бұл аниондарда негізінен коваленттік байланыс болады.
Қождың физикалық қасиеттері мен иондар арасындағы химиялық байланыстар осы иондардың табиғатымен (зарядтың таңбасы мен шамасы, ион өлшемі және т.б.) анықталады.
Иондық теория металл мен қождың өзара химиялық әрекеттесуінің табиғаты, түзілген иондардың құрамы мен пішіні туралы қанағаттан-арлықтай түсініктемелер береді. Сонымен қатар оттегі, сутегі, күкірттің газ фазасынан қож арқылы металл фазасына өту механизмін ашып және т.б. бұрын түсіндірілмеген сұрақтарға жауап бере алады.
Дегенмен П. Герасименконың жұмыстары көрсеткендей, оксид молекуласының концентрациясын сәйкес иондардың концентрациясы-мен жәй айырбастай салу, болат қорыту үрдісінің металл мен қож өзара әрекеттесуінің термодинамикалық сұрақтарына сандық сипаттама беруге жеткіліксіз болды. Иондардың активтілігін табу үшін қож құрылымы иондық үлгісінің біреуін қабылдау керек болды.
М.И. Темкин «жетілген иондық ерітінділер» үлгісін ұсынды. Оның негізгі талаптары:
1) қож түгелдей дерлік иондарға ыдыраған молекулалардың балқымасы;
2) таңбасы бірдей иондар өзара энергетикалық эквивалентті;
3) жылулық қозғалыс үрдісінде таңбасы бірдей иондардың ғана өзара орын алмасуы орын алады.
Осы үлгі негізінде қож компоненттерінің иондық үлесі, энтропия және металл-қож фазалары арасында элементтердің бөліну үрдісінің тепе-теңдік константасы анықталады. Жетілген иондық ерітінділер теориясы негізді қасиетті қождарды (5-10%-ға дейін SiO2 бар) сипаттауда жақсы нәтижелер берді. Мысалы, негізділігі жоғары қож компоненттерінің активтілік мәні эксперименттік жолмен анықталған шамаға жуықтады. Ал өлшемі үлкен аниондардың мөлшері ұлғайғанда, қождың қасиеті жетілген иондық балқыманың қасиетінен алшақтады.
О.А. Есин ұсынған сұйық қождың микробіркелкі еместік теориясы бойынша, қож қасиетінің жетілген иондық ерітінділер теориясынан ауытқуы, иондардың энергетикалық әрекетінің бірдей еместігінен. Иондар арасындағы энергетикалық айырмашылықтың нәтижесінде, жетілген иондық ерітінділер теориясы есепке алмайтын, ∆Н жылуы мен араласудың артық энтропиясы ∆S пайда болады.
Қож балқымасы иондарының байланыс энергиясының өзгеруі, В.А. Кожеуров ашқан реттелген иондық ерітінділер теориясында ескерілген. Активтілікті табу үшін иондар арасындағы байланыс энергиясын анықтағанда, В.А. Кожеуров тек компоненттердің араласу жылуын есепке алған, ал араласу энтропиясын жетілген иондық ерітінділер теориясы бойынша есептеген. Оның ұсынған үлгісі бойынша сұйық қож оттегі анионымен байланысқан қарапайым катиондардан тұрады. Бір анион түрлі катиондармен байланысқандықтан, олардың араласу энергиясының шамасы әр түрлі. Осы қағидалардың негізінде В.А. Кожеуров көп компонентті (FeO, MnO, CaO, MgO, SiO2, P2O5) негізді қож құраушылардың активтілік коэффициенттерін анықтауды ұсынған. Кейінірек ол осы әдісті әр түрлі анионды қождарға қолдана бастады.
Болат қорыту үрдістері қождарының құрылыс теориясы даму үстінде. Осы орайда жүргізілген көптеген зерттеулердің ішінде А.Г. Пономаренконың қождарда тек иондық қана емес, сонымен бірге электрондық өткізгіштік орын алады дегенін ескерген жөн. Қождарды белгілі бір дәрежеде металдарға жақындайтын, коллективті электрондық жүйесі бар фаза деп қарастыру жөн.
Қождың химиялық қасиеті.Қождың химиялық құрамы, оның негізгі физика-химиялық қасиеттерін анықтайтын маңызды сипаттамасы болып табылады.
Химиялық құрамы бойынша қож негізді және қышқылды болып бөлінеді. Негізді қожда негізді оксидтер (CaO, MgO, MnO, FeO) басым болса, қышқылды қожда-қышқылды оксидтер (SiO2, P2O5).
Болат қорыту үрдісі үшін қождың химиялық қасиетінің ішіндегі ең маңыздысы қождың негізділігі мен тотықтырғыштық қабілеті.
Қождың негізділігі деп негізді оксидтер концентрациясының қышқылды оксидтер концентрациясына қатынасын айтады. Болат өндірісінде қождың негізділігін
B=(CaO)/(SiO2) (1.35)
қатынасымен көрсету кең орын алады. Фосфорлы шойыннан болат қорытуда қождағы P2O5 мөлшері ескеріледі
B=(CaO)/(SiO2)+(P2O5) (1.36)
Болат өндірісінің қожын негізділігі бойынша үшке бөлуге болады:
1) негізділігі төмен (В<1,5);
2) негізділігі орташа (В=1,6-2,5);
3) негізділігі жоғары (В>2,5).
Әктің еруіне қарай қож негізділігі балқыманың басында төмендеу болып, содан кейін жоғарылай бастайды. Негізділігі жоғары гомогенді қождың фосфор мен күкіртті сіңіру қабілеті жоғары келеді.
Қышқылды қождың құрамы қышқылдық дәрежесімен сипатталып,
(SiO2)/(FeO)+(MnO) (1.37)
қатынасымен өрнектеледі.
Қождың тотықтырғыш қабілеті, оның металл фазасына оттегіні беру қабілетімен сипатталады
(FeO)=[Fe]+[O] (1.38)
Қазіргі кезде реакцияларды иондық түрде жазумен бірге әлі молекулалық түрде жазу қолданыста болғандықтан, біз де соны қолдандық.
Қождың тотықтырғыш қабілетіне әсер ететін негізгі факторлар:
1) қождағы темір оксидтерінің мөлшері;
2) қождың негізділігі;
3) металдағы көміртегі мөлшері;
4) балқыма температурасы.
Гомогенді сұйықтай аққыш қождағы темір оксидтерінің концентрациясы, металдағы көміртегі мөлшері және балқыма температурасы жоғарылаған сайын, ал қождың негізділігі 1,7-1,8-ге төмендесе, онда қождың тотықтырғыш қабілеті артады.
Қождың физикалық қасиеті.Қождың негізгі физикалық қасиетіне балқу температурасы, тұтқырлығы, беттік керілісі, жылуөткізгіштігі және т.б. жатады.
Қождың балқу температурасына, оның әрбір құраушысы өз әсерін тигізеді. Негізді қождардың балқу температурасын СаО жоғарылатып, ал FeO, SiO2, Al2O3 төмендетеді.
Қождың тұтқырлығы, оның құрамы мен температурасына тәуелді. Температура жоғарылаған сайын қождың тұтқырлығы құрамына байланысты төмендейді (1.3 сурет). Болат қорыту үрдісінің температураларында негізді қождың тұтқырлығы 0,1-0,3 Па·с.
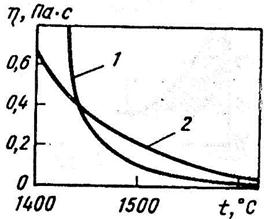
1 – негізді қож; 2 – қышқылды қож
1.3 сурет – Қож тұтқырлығының температураға тәуелділігі
Негізді қождардың тұтқырлығы СаО мөлшері жоғарылаған сайын артады. Қождың тұтқырлығын әсіресе MgO (10-12%-дан жоғары) жоғарылатады. Негізді қождың тұтқырлығын Fe2O3, SiO2, Al2O3, CaF2 төмендетеді. Өйткені бұл компоненттер СаО мен MgO-ның қожда еруіне әсер етеді. Сондықтан қождың сұйықтай аққыштығын жоғарылатып, балқу температурасын төмендету үшін конвертерге боксит (құрамы Al2O3, SiO2, Fe2O3 және т.б.) салады. Қождың балқу температурасын төмендетіп, сұйық аққыштығын едәуір арттыратын әрі әктің еруін жеделдететін балқытқыш шпат (90-95% CaF2; 5% SiO2). Темір кенін салу да қожды сұйылтып, әктің тезірек еруіне әсер етеді.
Тұтқырлығы төмен қож жылу-мен массажылжымды жақсартып, жалпы үрдіске оң әсер етеді.
Қождың беттік керілісі, оның элементар бөлшектерінің байланыс күші арқылы анықталады. Болат қорыту үрдісі қождарының беттік керілісі құрам мен температураға тәуелді болып, 1400-1600ºС аралығында sқ-г=0,2-0,6 Дж/м2. Негізді қожға беттік активті қосылыстарды (SiO2, CaF2, TiO2 және т.б.) қосу оның беттік керілісін төмендетеді.
Металл-негізді қож фаза аралық керілісі sм-қ=1,0-1,2 Дж/м2, ал sм‑г=1,2-1,8 Дж/м2.
Металл-қож фазаларының өзара және оттөзімді материалмен әрекеттесуі, металл емес кірінділердің құрылуы мен бөлінуі және т.с.с. жұғу құбылысына байланысты. Ол жұғу бұрышымен (1.31) сипатталады.