Болезни сельскохозяйственных животных
П.А.Красочко, М.В.Якубовский, А.И.Ятусевич
БОЛЕЗНИ СЕЛЬСКОХОЗЯЙСТВЕННЫХ
ЖИВОТНЫХ
МИНСК 2005.
П.А.Красочко, М.В.Якубовский, А.И.Ятусевич
ЖИВОТНЫХПОСВЯЩАЕТСЯ
Летию со дня рождения
доктора ветеринарных наук, профессора,
Академика Академии наук БССР
Р.С.Чеботарева
ПРЕДИСЛОВИЕ (Красочко П.А.) РАСПРОСТРАНЕНИЕ И УЩЕРБ ОТ РЕСПИРАТОРНЫХ И ЖЕЛУДОЧНО-КИШЕЧНЫХ ЗАБОЛЕВАНИЙ… …ПРЕДИСЛОВИЕ
Для современного ведения скотоводства и свиноводства характерна высокая концентрация поголовья на ограниченных площадях, комплектование животноводческих ферм и комплексов одновозрастными и одновидовыми животными, что способствует быстрому распространению инфекционных заболеваний.
Такие болезни крупного рогатого скота и свиней, как респираторные и желудочно-кишечные, наносят огромный экономический ущерб животноводству. При тяжелом течении указанных заболеваний телят наступает значительное угнетение клеточного и гуморального звеньев иммунитета. На этом фоне условно-патогенная микрофлора активизируется и у животных развивается “энзоотическая пневмония”, приводящая к значительному снижению их продуктивности и отходу.
В этиологической структуре возбудителей желудочно-кишечного тракта и дыхательных путей телят, как показали наши исследования, важная роль принадлежит вирусным агентам. К ним относятся, прежде всего, вирусы парагриппа-3, вирусной диареи, инфекционного ринотрахеита, аденовирусной и респираторно-синцитиальной, а также рота-, корона- и парвовирусной инфекций. Одновременное или последовательное инфицирование телят данными возбудителями приводит к длительному течению болезни и неблагополучию хозяйств. Это способствует активизации банальной условно-патогенной и сапрофитной микрофлоры, которая в значительной мере отягощает инфекционный процесс.
Аналогичная ситуация сложилась и в свиноводстве. Желудочно-кишечные заболевания поросят регистрируются практически во всех регионах мира. Их удельный вес в патологии свиней составляет 50--60 % от общей заболеваемости. Ежегодные потери от гастроэнтеритов свиней среди новорожденных поросят, например в США, составляют 35 %.
Вирусные гастроэнтериты поросят зачастую проходят под общей рубрикой желудочно-кишечных заболеваний. Практические ветеринарные специалисты недостаточно полно владеют информацией, что представляют собой вирусные гастроэнтериты поросят, какие причины их вызывают, как они распознаются среди других диарейных заболеваний, как вести с ними борьбу и предупреждать их.
Одним из “пусковых механизмов” поражения животных инфекционными заболеваниями является снижение иммунологической реактивности организма. Этому способствует ряд факторов — недоразвитость иммунной системы молодняка (первичный иммунодефицит), пищевые токсикозы, недостаточное и несбалансированное по различным компонентам кормление. К ним относят и сильное стрессовое воздействие, так называемый “технологический стресс”, обусловленный современной технологией производства продукции животноводства.
Составляющими современной промышленной технологии, способными вызвать стрессовые воздействия на организм животных, являются их безвыгульное и безвыпасное содержание (особенно для крупного рогатого скота), транспортировка, нарушение микроклимата, теснота, малый фронт кормления, интенсивная эксплуатация.
Указанные факторы значительно снижают устойчивость животных к инфекционным заболеваниям, особенно к тем, возбудителями которых являются условно-патогенные микроорганизмы и вирусы. Пораженная иммунная система под воздействием отрицательных факторов не в состоянии противостоять вирусам-возбудителям даже с невысокой патогенностью.
Разносторонний анализ этиологических причинно-следственных факторов, связанных с заболеванием телят и поросят, показал, что “пусковым механизмом” острых респираторных и энтеральных болезней являются вирусы, а бактерии и микоплазмы играют вторичную роль. В таких условиях возникает необходимость нейтрализации не только вирусов, но и условно-патогенных бактерий. Слабопатогенный вирус, обладающий цитопатогенным действием, разрушая эпителий дыхательной, желудочно-кишечной и генитальной систем, создает оптимальные условия для репродукции бактерий, что приводит к летальному исходу.
В связи с этим изучение закономерностей развития инфекционного процесса при вирусных респираторных и энтеральных болезнях является чрезвычайно актуальным моментом и должно включать:
— эпизоотологическое обследование хозяйств;
—изучение иммунного и биохимического статуса животных;
—анализ результатов клинического и патологоанатомического исследования;
—проведение микробиологических и вирусологических исследований с выделением и идентификацией этиологического агента;
—осуществление серологического исследования больных и павших телят.
Указанные положения позволяют своевременно и эффективно разрабатывать и реализовать мероприятия по профилактике и снижению респираторных и энтеральных болезней телят и поросят. Проведение этих исследований позволяет снизить экономический ущерб от данных болезней.
В предлагаемом справочнике рассматриваются вопросы этиологии, патогенеза, клинического проявления и эпизоотологических особенностей вирусных и бактериальных инфекций телят и поросят, паразитарных и незаразных заболеваний животных. описана их диагностика, дифференциальная диагностика, профилактика и меры борьбы.
Монография «болезни сельСКОХОЗЯЙСТВЕННЫХ ЖИВОТНЫХ» подготовлен коллективом научных сотрудников РНИУП «Институт экспериментальной ветеринарии им. С.Н.Вышелесского НАН Беларуси», Витебской ордена «Знак Почета» государственной академии ветеринарной медицины.
П.А.Красочко –доктор ветеринарных наук, профессор, академик Международной академии экологии и Международной академии ветеринарных наук, заведующий отделом болезней крупного рогатого скота и прионных инфекций РНИУП «Институт экспериментальной ветеринарии им. С.Н.Вышелесского НАН Беларуси»;
М.В.Якубовский -доктор ветеринарных наук, профессор, заведующий отделом паразитологии РНИУП «Институт экспериментальной ветеринарии им. С.Н.Вышелесского НАН Беларуси»;
А.И.Ятусевич - доктор ветеринарных наук, профессор, заслуженный деятель науки Республики Беларусь, академик Международной академии информационных технологий, академик Петровской академии науки и искусств, ректор УО «Витебская ордена «Знак Почета» государственная академия ветеринарной медицины»;
И.А.Красочко – кандидат ветеринарныхнаук, доцент,член-корреспондент Международной академии экологии, ученый секретарь РНИУП «Институт экспериментальной ветеринарии им. С.Н.Вышелесского НАН Беларуси»;
А.П.Лысенко -доктор ветеринарных наук, профессор, директор РНИУП «Институт экспериментальной ветеринарии им. С.Н.Вышелесского НАН Беларуси»;
В.В.Максимович -доктор ветеринарных наук, профессор, заведующий кафедрой эпизоотологии УО «Витебская ордена «Знак Почета» государственная академия ветеринарной медицины»;
В.С.Прудников -доктор ветеринарных наук, профессор, академик Международной академии экологии, заведующий кафедрой патологической анатомии УО «Витебская ордена «Знак Почета» государственная академия ветеринарной медицины»;
С.Л.Борознов –кандидат ветеринарныхнаук, главный ветеринарный врач Минского района;
Р.Г.Кузьмич -доктор ветеринарных наук, профессор, заведующий кафедрой акушерства УО «Витебская ордена «Знак Почета» государственная академия ветеринарной медицины»;
А.П.Курдеко - кандидат ветеринарныхнаук, доцент,проректор по научной работу, заведующий кафедрой терапии УО «Витебская ордена «Знак Почета» государственная академия ветеринарной медицины»;
Ю.Г.Зелютков -кандидат ветеринарных наук, доцент, член-корреспондент Международной академии экологии, директор Научно-производственного центра «Ветзоомир»;
Т.Я.Мясцова -кандидат ветеринарных наук, ведущий научный сотрудник отдела паразитологии РНИУП «Институт экспериментальной ветеринарии им. С.Н.Вышелесского НАН Беларуси»;
Н.Г.Толкач -кандидат ветеринарныхнаук, доцент,заведующий кафедрой фармакологии и токсикологии УО «Витебская ордена «Знак Почета» государственная академия ветеринарной медицины»;
В.И.Еремец –доктор биологических наук, профессор, заместитель директора Всероссийского научно-исследовательского и технологическго института биологической промышленности;
В.Е.Иванов -кандидат ветеринарных наук, ведущий научный сотрудник отдела ветсанитарии РНИУП «Институт экспериментальной ветеринарии им. С.Н.Вышелесского НАН Беларуси»;
М.П.Кучинский -кандидат ветеринарных наук, заведующий лабораторией токсикологии и фармакологии РНИУП «Институт экспериментальной ветеринарии им. С.Н.Вышелесского НАН Беларуси»;
А.С.Ястребов -доктор ветеринарных наук, главный научный сотрудник отдела болезней свиней РНИУП «Институт экспериментальной ветеринарии им. С.Н.Вышелесского НАН Беларуси»;
Т.А.Савельева -кандидат ветеринарныхнаук, доцент, заместитель директора РНИУП «Институт экспериментальной ветеринарии им. С.Н.Вышелесского НАН Беларуси»;
А.Э.Высоцкий -кандидат ветеринарных наук, старший научный сотрудник отдела туберкулеза РНИУП «Институт экспериментальной ветеринарии им. С.Н.Вышелесского НАН Беларуси;
И.И.Румачик -доктор ветеринарных наук, главный научный сотрудник отдела туберкулеза и лейкоза РНИУП «Институт экспериментальной ветеринарии им. С.Н.Вышелесского НАН Беларуси»;
Т.Н.Агеева -кандидат ветеринарных наук, заведующая лабораторией радиоэкологических проблем в животноводстве МФ РНИУП «Институт радиологии»;
В.Е.Дубиковский –главный ветеринарный врач Главного управления ветеринарии с Государственной ветеринарной инспекцией Министерства сельского хозяйства и продовольствия Республики Беларусь;
В.Н.Алешкевич -кандидат ветеринарныхнаук, доцент кафедры микробиологии и вирусологии токсикологии УО «Витебская ордена «Знак Почета» государственная академия ветеринарной медицины».
РАСПРОСТРАНЕНИЕ И УЩЕРБ ОТ РЕСПИРАТОРНЫХ И ЖЕЛУДОЧНО-КИШЕЧНЫХ ЗАБОЛЕВАНИЙ ТЕЛЯТ И ПОРОСЯТ
Указанные выше болезни часто регистрируются среди молодняка к.р.с. и свиней начиная с 1-го дня жизни до 6-месячного возраста. В отдельных хозяйствах… О значимости проблемы изучения патологии респираторных и желудочно-кишечных… В этой связи для правильного подбора средств и способов профилактики и терапии респираторных и желудочно-кишечных…ЭТИОЛОГИЧЕСКАЯ СТРУКТУРА РЕСПИРАТОРНЫХ И ЖЕЛУДОЧНО-КИШЕЧНЫХ ЗАБОЛЕВАНИЙ ТЕЛЯТ И ПОРОСЯТ
-основными возбудителями респираторных и желудочно-кишечных инфекций телят являются вирусы инфекционного ринотрахеита, диареи,… - иммунодефицитное состояние организма новорожденных телят (первичный… -переболевание молодняка вирусными респираторными и желудочно-кишечными инфекциями усугубляет иммунодефицит;ОБЩАЯ ХАРАКТЕРИСТИКА ОСНОВНЫХ ВОЗБУДИТЕЛЕЙ ИНФЕКЦИОННЫХ ЗАБОЛЕВАНИЙ ЖИВОТНЫХ
Отдельные возбудители инфекционных заболеваний к.р.с., такие, как инфекционный ринотрахеит, парагрипп‑3, вирус диареи,… У свиней также обнаружена взаимосвязь между инфицированностью свиноматок… — заболевание полового аппарата у коров и телок, исключающее возможность оплодотворения;ВИРУСНЫЕ ИНФЕКЦИИ СЕЛЬСКОХОЗЯЙСТВЕННЫХ ЖИВОТНЫХ
ВИРУСНЫЕ И ПРИОННЫЕ БОЛЕЗНИ крупного рогатого скота
Губкообразная энцефалопатия крупного рогатого скота
Определение.Губкообразная энцефалопатия крупного рогатого скота (бешенство коров, бычья спонгиоформная энцефалопатия) – медленно развивающаяся… Возбудитель. Особенностью возбудителей спонгиозных энцефалопатий человека и… В настоящее время считается общепризнанным, что губкообразная энцефалопатия крупного рогатого скота появилась в…Диагностика губкообразной энцефалопатии крупного рогатого скота.
- изучение клинических признаков; - изучение эпизоотологической ситуации; - проведение патогистологических исследований;Рисунок 4.
Рисунок 5

Рисунок 6.
Подтвержденным на для губкоообразную энцефалопатию крупного рогатого скота диагноз следует считать только на основании комплексного анализа эпизоотологических, клинико-анатомических и патогистологических исследований. При этом следует сравнивать гистопрепараты отделов головного мозга, полученных от заведомо здоровых животных (контроль).
Сомнительным считается диагноз при наличии ассиметричных признаков вакуолизации в нейроглии или в нейронном околоядерном пространстве.
Отрицательныйдиагноз ставится в случае отсутствия гистологических изменений в основных участках головного мозга, необходимых для диагностики, а при подозрении и остальных участков мозга.
Примечание:В настоящее время в странах мира применяются следующие методы иммунологической диагностики губкообразной энцефалопатии:
иммуноблотинг (тест-система «Прионикс-Чек»),
-иммуноферментный анализ (тест-система «Биорад»);
-иммунолюминисцентный методы (тест-система «Прионикс-Лиа»);
- метод иммунострипов (тест-сситема «Прионикс-стрип»);
-электронно-микроскопический метод;
-иммуногистохимический метод выявления патологических PrP sc- белков в обычных фиксированных в формалине срезах;
-биопроба (заражение подозрительнам материалом хомяков и мышей).
Дифференциальный диагноз.Губкообразную энцефалопатию крупного рогатого скота необходимо дифференцировать от бешенства, листериоза, болезни Ауески, нервной формы инфекционного ринотрахеита, злокачественной катаральной горячки, а также отравлений фосфорорганическими, хлорорганическими, ртутьорганическими соединениями, фосфидом цинка, мышьяком, поваренной солью.
Основным отличительным признаком от губкообразной энцефалопатии крупного рогатого скота является короткий латентный период (от 5 до 15 дней) острое или подострое течение, повышение температуры тела, отказ от корма и другие симптомы, присущие указанным заболеваниям, биопроба, данные вирусологических, бактериологических и токсикологических исследований.
Бешенство – острая контагиозная болезнь различных видов животных и человека, характризующаяся параличами, агрессией, водоборязнью.
Возбудитель - рабдовирус.
Бешенство крупного рогатого скота чаще протекает в буйной форме и характеризуется возбуждением, извращением аппетита, расширением зрачков, обильным слюноотделением. Агрессивность по отношению к человеку и животным наблюдается редко. К концу болезни развиваются параличи –спазм гортани и глотки, затем передних и задних конечностей. Смерть наступает на 3-6 день. При тихой форме бешенства симптомы возбуждения выражены в незначительной степени, но очень рано развиваются параличи.
Необходимо отметить, что прижизненная дифференциальная диагностика губкообразной энцефалопатии крупного рогатого скота и бешенства, несмотря на всю ее значимость, имеет лишь ориентировочное значение. Основное практическое значение имеет посмертная диагностика, основанная на данных морфологического, серологического исследования и биопробы.
Гистологические изменения головного и спинного мозга при бешенстве характеризуются рассеянным энцефаломиелитом, проявляющимся воспалительными изменениями сосудов и поражением нервных клеток. Указанные изменения для бешенстве неспецифичны и при диагностике играют второстепенную роль. Специфическим является обнаружение в цитоплазме нейронов головного мозга особых образований, названных тельцами Бабеша-Негри, наиболее часто они обнаруживаются в клетках аммонова рога, реже – в других отделах. Тельца Бабеша–Негри представляют собой полиморфные образования со сложной внутренней структурой: в середине одно или несколько плотных гранул, по периферии – более мелкие зернышки. Размеры телец колебаются от 0,25-1 до 20-25 мк. В одной клетке может быть одно или несколько телец различной величины и формы (рис.7)
 .
.
Рисунок 7. Тельца Бабеша-Негри у больного животного в головном мозге.
Для обнаружения телец Бабеша-Негри в гистосрезах, мазках и отпечатках мозга предложено множество способов окраски последних: по Михину, Муромцеву, Манну, Ленцу, Адуцкевичу и др.
Из серологических методов исследования наиболее специфичным при бешенстве является метод флюоресцирующих антител, позволяющий выявлять при наличии вируса в мозге специфическое свечение (разной величины и формы гранулы яркого желто-зеленого цвета в величиной от едва заметных образований до 15-20 мк.
При отрицательных результатах, полученных морфологическими и серологическими методами, для окончательной постановке диагноза проводится биологическая проба, основанная на заражении исследуемым материалом лабораторных животных, главным образом белых мышей. С этой целью суспензией мозга 1:10 с добавлением антибиотиков заражают в мозг в дозе 0,03 мл 5-6 белых мышей весом 4-6 г. Наблюдение за животными проводят в течение 14 дней. В случае падежа животных их мозг исследуют на наличие телец Бабеша-Негри. Если в течение 14 дней у зараженных животных не будут выявлены тельца Бабеша-Негри, то результат считается отрицательным.
Болезнь Ауески (псевдобешенство) – контиагиозная болезнь домашних и диких животных, в том числе и крупного рогатого скота, сопровождается поражением центральной нервной системы и органов дыхания.
Возбудителем является герпесвирус. Вирус обладает пантропностью, Инкубационный период от 1 до 15 дней. У крупного рогатого скота вначале повышается температура тела до 41,9оС, прекращается жвачка, появляется сильный зуд в области ноздрей, губ, щек или глаз, реже – на других участках тела. Животные вялые, отказываются от корма, беспокоятся, непрерывно лижут зудящие места, трутся об окружающие предметы. Возбуждение нарастает, глаза выражают испуг, животное мычит, стонет, рвется с привязи (агрессивности не проявляет). Нередко наблюдаются судорожные сокращения жевательных и шейных мышц.
При вскрытии у животных расчесы в области головы, спины, конечностей. На месте расчетов кожа гиперемирована, края раны отечные, подкожная клетчатка геморрагически инфильтрирована. При гистологическом исследовании в мозге отмечается картина негнойного менингоэнцефалита. Он характеризуется образованием диффузной и очаговой пролиферации клеток глии, периваскулярной инфильтрацией, клетками ретикулоэндотериального типа, вакуолизацией и пикнозом ганглиозных нервных клеток, нейрофагией, многорядовой пролиферацией клеток мозговых оболочек и боковых желудочков (Рис.8.)

Рисунок 8. Негнойный энцефалит у больных болезнью Ауески животных.
Лабораторная диагностика болезни Ауески заключается в обнаружении и идентификации возбудителя болезни в патологическом материале (РИФ или ИФА), выделении вируса на культуре клеток с последующей его типизацией, в также обнаружении противовирусных антител в сыворотке крови от больных и переболевших животных в РНГА, ИФА, РН.
Листериоз – инфекционная болезнь, протекающая с признаками сепсиса, поражения центральной нервной системы, половых органов и молочной железы.
Возбудителем инфекции является Listeria monocytogenes.
Инкубационный период длится 1-4 недели. Течение болезни бывает острое, подострое и хроническое. Листериоз может проявляться несколькими формами: нервной, септической, смешанной, бессимптомной или выражаться в виде поражения половых органов и молочной железы. У крупного рогатого скота и овец отмечается преимущественное центральной нервной системы. Их первых признаков характерно угнетение, снижение аппетита, в дальнейшем - (1-7 дней) проявляются некоординированность движений, круговые движения, потеря равновесия, судороги, парезы отдельных групп мышц, потеря зрения, конъюнктивит, стоматит, оглумоподобное состояние, иногда приступы буйства. В начальной стадии болезни температура тела может быть несколько повышена или не превышать физиологической нормы, длительность болезни 7-10 дней и большинстве случаев животные погибают.
При вскрытии у крупного рогатого скота отмечают острую венозную гиперемию и отек легких, гистогнойный энецефалит (стволовая часть головного мозга и шейная часть спинного мозга) (рис. 9).

Рисунок 9. Гнойный энцефалит у больного животного
Диагноз на листериоз устанавливают на основе эпизоотологических, клинических, патологоанатомических и лабораторных методов исследований.
Основание для постановки диагноза является выделение возбудителя на питательных средах, его идентификация, биопроба на белых мышах и кроликах. Для серологической диаоностики используют сыаороки крови от больных и переболевших животных. Наличие антител выявляют в РА, РСК, ИФА. Для ускорения диагностики используют люминисцентную микроскопию с использованием гипериммунной антилистериозной сыфоротки, меченой флюорохромами.
Злокачественная катаральная горячка крупного рогатого скота – острая инфекционная болезнь крупного рогатого скота , характеризующаяся поражением слизистой оболочки головы, глаз и нервной системы.
Возбудитель – герпесвирус.
Начальная стадия заболевания характеризуется высокой температурой в течение 1-2 дней, воспалением слизистых оболочек ротовой и носовой полостей. Из носа появляются истечения слизистого, затем гнойно-кровянистого секрета. Повышенная температура тела (40-42оС) держится на постоянном уровне на протяжение болезни. Смерть может наступить через 24 часа, иногда длится до 2-х недель и более. Летальность – 90%.
Патологоанатомические измерения зависят от тяжести и продолжительности заболевания и характеризуются катарально-гнойным конъюнктивитом и кератитом, некрозом эпидермиса носового зеркальца и слизистой оболочки ротовой полости, гнойно-фибринозным ринитом, ларингитом, крупозно-геморрагическим или дифтеретическим колитом. При гистологическом исследовании головного мозга – негнойный менингоэнцефалит.
Методы диагностики основаны на выделении и идентификации вируса на культуре клеток и обнаружения специфических антител в РИД, РНГА или ИФА.
Инфекционный ринотрахеит – острое инфекционное заболевание крупного рогатого скота, характеризующееся поражением органов дыхания и пищеварения у молодняка и половых органов у взрослых животных, также менингоэнцефалитом у телят.
Возбудитель – герпесвирус.
Заболеваемость животных инфекционным ринотрахеитом зависит от локализации вируса, его вирулентности, возраста, пола и физиологического состояния животного. Отмечены респираторная, энтеральная, генитальная, конъюнктивальная и нервная формы течения инфекционного ринотрахеита. Наиболее часто встречается у новорожденных телят энтеральная форма, у телят старше 1 месяца - респираторная, конъюнктивальная, реже – нервная формы, у взрослых – генитальная форма.
Нервная или менингоэнцефалитная форма инфекционного ринотрахеита возникает у животных после проникновения вируса через гематоэнцефалический барьер. Ее наблюдают редко и, как правило, у молодняка 2-6 месяцев.. Она характеризуется расстройством двигательных функций и нарушением равновесия. Болезнь сопровождается мышечным тремором, мычанием, скрежетом зубов, конвульсиями, слюнотечением.
На вскрытии у животных с менингоэнцефалитной формой инфекционного ринотрахеита в головном мозге гиперемия сосудов, отечность тканей и мелкие кровоизлияния. При гистологическом исследовании – хорошо выраженный лимфоцитарный менингоэнцефалит. Ему сопутствуют периваскулярная лимфоцитарная инфильтрация в различных отделах полушарий и мозжечка, сильная инъекция сосудов и отечность вещества мозга. У животных, которые погибают, в веществе мозга преобладают кровоизлияния, а при затяжном течении болезни – дегенеративные изменения нервных клеток и клеточно-пролиферативные процессы глиальных элементов.
Диагноз на инфекционный ринотрахеит ставят путем выделения и идентификации вирусов на культуре клеток, обнаружении противовирусных антител в сыворотках крови больных и переболевших животных в РН, РНГА, ИФА.
Отравления мочевиной характеризуется сильным угнетением. Потливостью, атаксией, слюнотечением, клоническими и тетаническими судоргами. Отравлению подвержены в основном взрослые животные. Температура тела в норме. Заболевают едничные животные до 30-40%-го поражения стада.
На вскрытии – геморрагический гастроэнтерит, вздутие рубца (при разрезе ощущается резкий запах аммиака), зернистая (жировая) дистрофия печения и некрозы в ней. Основанием для постановки диагноза являются лабораторные исследования содержимого рубца на наличие в нем мочевины.
Отравление ртутьорганическими соединения характеризуется резким угнетением, сильной саливацией, поносом, полиурией, угнетением сердечной деятельности, атаксией, парезами, параличами. Температура тела в норме. Заболевают едничные животные до массовых случаев поражения стада.
На вскрытии серозно-катаральный гастроэнтерит, некротический некроз, зернистая (жировая) дистрофия миокарда и печени, крупозно-дифтеретический колит, кровоизлияния в серозных оболочках пищеварительного тракта.
Основанием для постановки диагноза являются лабораторные исследования содержимого рубца на наличие в нем соединений ртути.
Отравление хлорорганическими соединениями - характеризуется резким угнетением или возбуждением, сильной саливацией, поносом, полиурией, судоргами, сердечной недостаточностью, парезами, параличами. Температура тела в норме. Заболевают едничные животные до массовых случаев поражения стада.
На вскрытии – катарально-геморрагический гастроэнтерит, кровоизлияния в слизистой оболочке бронхов, плевре, под эпи- и эндокардом, зернистая дистрофия и венозная гиперемия в миокарде, печени, почках, венозная гиперемия и отек легких.
Основанием для постановки диагноза являются химико-токсикологические лабораторные исследования содержимого рубца на наличие в нем хлорорганических соединений.
Отравление фосфорорганическими соединениями - характеризуется расстройством нервной системы, повышенной возбудимостью, затем угасанием рефлексов, атаксией, сильной саливацией, поносом, судоргами, сердечной недостаточностью. Температура тела в норме. Заболевают едничные животные до массовых случаев поражения стада.
При вскрытии – обильная саливация в ротовой полости, цианоз слизистых оболочек глаз и ротовой полости, венозная гиперемия печени и легких (отек легких), гиперемия и отек головного мозга, сужение зрачков, кровоизлияния под эпи – и эндокардом, в слизистой оболочке очевого пузыря, щитовидной и поджелудочной железах, головном мозге.
Основанием для постановки диагноза являются химико-токсикологические лабораторные исследования содержимого рубца на наличие в нем хлорорганических соединений.
Наряду с поражением крупного рогатого скота губкообразной энцефалопатией, аналогичные изменения отмечаются и у овец при скрепи, аденоматозе, висна.
При аденоматозе овец наряду с головным мозгом поражаются и легкие. При этом отмечают метаплазию альвеолярного эпителия в виде онкоподобных аденом на фоне расплавления межальвеолярных перегородок и образования эмфизематозных полостей.
При заболевании овец висна отмечают периваскулярный инфильтрат крупноклеточных элементов в стволовой части продолговатого мозга.
При скрепи овец имеются различные стадии поражения головного мозга. Отмечают кариопикноз, каогуляцию и пониженную оксифилию цитоплазмы нейронов, цитокариолизис нейронов, хроматолизис ядра и вакуолизация цитоплазмы нейронов, лизис цитоплазмы и оттеснение остатков ядра к периферии нейрона. Иногда отмечают наиболее характерный патогномоничный признак – перстневидный нейрон (рис.10).
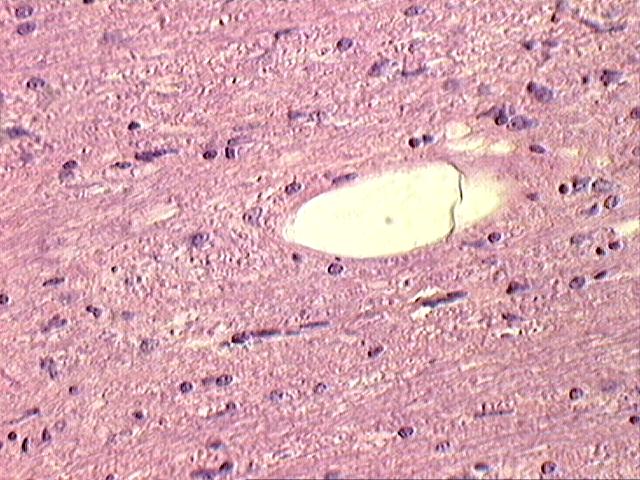
Рисунок 10. Перстневидный некроз в мозге овец.
При меди овец отмечается пролиферация круглоклеточных элементов в интерстициальной ткани легких, перибронхим, расплавление межальвеолярных перегородок и образование эмфиземоподобных полостей (рис.11).
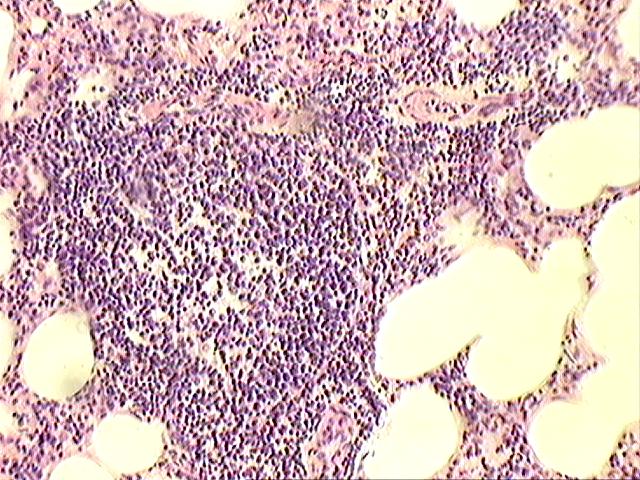
Рисунок 11. Поражение легких у больных овец.
При проведении гистологических исследований в нормальных участках головного мозга преобладают волокна нейроглии, заметны нейроны. При микроскопии гистосрезов из мозжечка здоровых животных при микроскопии видны грушевидные клетки Пуркинье, зернистый слой с мелкими нейронами, модекулярный слой (немиелизированные волокна) нейроны.
Установление окончательного диагноза на губкообразную энцефалопатию крупного рогатого скота.Подтвержденным на для губкоообразную энцефалопатию крупного рогатого скота диагноз следует считать только на основании комплексного анализа эпизоотологических, клинико-анатомических и патогистологических исследований. При этом следует сравнивать гистопрепараты отделов головного мозга, полученных от заведомо здоровых животных и от животных с различными поражениями центральной нервной системы.
Подтверждением диагноза на губкообразную энцефалопатию крупного рогатого скота является заключение Региональной референтной лаборатории Международного Эпизоотического Бюро, расположенной во Всероссийском НИИ защиты животных (г.Владимир, Российская Федерация) путем исследования иммуногистохимическим методом наличия патологических PrP- белков в обычных фиксированных в формалине срезах участков головного мозга крупного рогатого скота с наиболее характерными патогномоничными признаками, характерными для этого заболевания, выявленными после патогистологических исследований
Меры безопасности при работе с патологическим материалом при проведении диагностических исследований.При работе с патологическим материалом, содержащим возбудитель губкообразной энцефалопатии крупного рогатого скота необходимо учитывать высокую устойчивость возбудителя к физико-химическим факторам и в этой связи строго соблюдать правила техники безопасности.
Все работы, связанные с распиловкой головы, извлечением головного мозга, отбору проб для патогистологических, бактериологических и вирусологических исследований следует проводить в соответствии с требованиями Санитарных правил 1.2.011 от 04.05.1994 “Безопасность работы с микроорганизмами I и II групп патогенности” которые являются до настоящего времени действующими на территории государств СНГ.
Специалист, который проводит исследования, должен иметь халат, прорезиненный (лучше хлорвиниловый) фартук с нарукавниками, анатомические перчатки, резиновые сапоги, водонепроницаемый капюшон, защитную маску из оргстекла для исключения попадания на лицо или глаза брызг крови, осколков костной ткани и интрацеребральной жидкости.
По окончании работ необходимо обработать настойкой йода или бриллиантовой зелени ногти и различные царапины или травмы рук.
Также по окончании работ инструменты, которыми проводили отделение головы, укладываются стерилизатор с 2% раствором гипохлорита натрия не менее чем на 1 час (инструменты должны быть погружены в раствор полностью). Сапоги, фартук, капюшон, маску и перчатки также обрабатывают с 2% раствором гипохлорита натрия. Халаты обрабатывают автоклавированием при 134-138оС в течение 20-30 минут. Горючие отходы сжигают.
Труп животного, а также и голову (после отбора мозга) рекомендуется утилизировать в яме Беккари, или обильно засыпав хлорной известью сжигать. Неиспользованные участки головного мозга целесообразно сжечь в муфельной печи, а при ее отсутствии утилизировать как труп животного.
Инфекционный ринотрахеит крупного рогатого скота
(Rinotracheitis infectiosa bovinum)
Определение.Инфекционный ринотрахеит (пузырьковая сыпь, инфекционный вульвовагинит, инфекционный некротический ринотрахеит, инфекционный ринит, красный нос, инфекционный катар верхних дыхательных путей) — остро протекающая контагиозная болезнь крупного рогатого скота, характеризующаяся поражением дыхательных путей, лихорадкой, общим угнетением и конъюнктивитом. В некоторых случаях появляется пустулезный вульвовагинит и баланопостит при попадании вируса в половые органы животных. У беременных животных неизбежны аборты.
Историческая справка.Впервые болезнь зарегистрирована в США в 1950 г. у откормочного скота N.G.Miller (1955). Вирус выделен H.Madin et al. (1956) из носовых истечений телят с острым респираторным заболеванием. После этого инфекционный ринотрахеит (ИРТ) обнаружен в различных странах мира.
В бывшем СССР сходное по клиническим и патологоанатомическим признакам заболевание наблюдал в 1938 г. Ф.М.Пономаренко (1940). Вирус впервые выделил Н.Н.Крюков в 1969 г. от больных телят из хозяйств Тамбовской области. В результате проведенных исследований установлено, что ИРТ имеет тенденцию к более широкому распространению в животноводческих хозяйствах мясо-молочного направления и особенно в хозяйствах с высокой концентрацией сборного поголовья.
Эпизоотологические данные.В естественных условиях инфекционным ринотрахеитом болеет крупный рогатый скот, особенно тяжело - телята и молодняк на откорме. Кроме того, генитальная форма заболевания установлена у беловежских зубров. При серологическом обследовании различных видов копытных жвачных антитела к вирусу ИРТ установлены в Танзании у взрослых буйволов. Лабораторные животные к вирусу не чувствительны, однако в ВИЭВ были проведены исследования по адаптации вируса инфекционного ринотрахеита к белым мышам (Н.Н.Крюков, А.Г.Глотов, 1987). При этом у них отмечались характерные клинические признаки.
Источником возбудителя инфекции являются больные и переболевшие животные, выделяющие вирус 6—12 мес. после выздоровления. Очень опасны быки-производители, переболевшие генитальной формой и длительное время содержащие вирус в сперме.
Из организма животных вирус выделяется с секретом из носа и глаз, истечениями из половых органов, со спермой, молоком, мочой, калом. Заражение происходит аэрогенным, контактным путем и при случке. Факторами передачи возбудителя инфекции служат инфицированные воздух, корма, подстилка, предметы ухода за животными, одежда и руки обслуживающего персонала, инструментарий и др.
Нами (П.А.Красочко, П.П.Фукс и соавт., 1994) установлено, что одним из путей сохранения в природе и передачи чувствительным животным являются бактерии, в частности, Bacillus alvei — возбудитель европейского гнильца пчел, который в своем геноме содержит нуклеиновую кислоту вируса ИРТ. Инокуляция телятам убитой и дезинтегрированной бактериальной массы вызывает заражение, подтверждающееся клинически и серологически.
Заболевание не имеет выраженной сезонности. На комплексах по выращиванию крупного рогатого скота (нетелей или откорму бычков) инфекционный ринотрахеит проявляется в виде периодических вспышек, возникающих на 5—7-й день после завоза сборного поголовья телят, предназначенных для комплектования групп животных в помещениях комплексов и ферм. Вначале заболевают отдельные животные, затем количество их быстро нарастает, достигая максимума на 9—14-й день. Вспышка заболевания длится до 21—24 дней, в течение которых подвергается заражению до 95% животных. При инфекционном ринотрахеите летальность достигает 25%.
Для ИРТ характерным является осложнение секундарной микрофлорой, что обусловливает более тяжелое течение заболевания и более высокую летальность (до 40%). В неспециализированных хозяйствах и мелких фермах инфекция протекает значительно слабее и бессимптомно.
К вирусу инфекционного ринотрахеита чувствителен плод крупного рогатого скота: внутриутробное заражение приводит к его гибели или возникновению иммунологической толерантности.
Нами (П.А.Красочко, 1985—1999; И.А.Красочко, 1989—1997) проведено серологическое обследование крупного рогатого скота и овец из животноводческих хозяйств Республики Беларусь и беловежских зубров на наличие антител к вирусу ИРТ. Результаты исследований представлены в табл. 6.
Таблица 6
Результаты исследования сывороток крови от копытных жвачных на наличие антител к вирусу инфекционного ринотрахеита
| Клиническое состояние и возраст | Исследо-вано проб | Положительный результат (%) | Клиническое состояние и возраст | Исследовано проб | Положи-тельный результат (%) | |
| Крупный рогатый скот | Беловежские зубры | |||||
| Коровы, 3—10 лет, клинически здоровые | 62,4 | Самцы, начальная стадия некротического баланопостита 1—10 лет | 66,7 | |||
| Телята, 1—6 мес., больные ОРЗ | 37,9 | Самцы, больные некротическим баланопоститом 1—10 лет | 76,2 | |||
| Телята, 1—6 мес., переболевшие ОРЗ | 60,6 | Самцы, клинически здоровые, старше 10 лет | 80,0 | |||
| Телята старше 6 мес., клинически здоровые | 65,9 | Самцы, клинически здоровые, 1—7 лет | 57,1 | |||
| Телята до 1 мес., клинически здоровые | 29,5 | Самки, клинически здоровые, старше 10 лет | 53,9 | |||
| Коровы абортировавшие | 77,4 | Самки, клинически здоровые, 1—7 лет | 44,4 | |||
| Овцы | ||||||
| Коровы с гинекологическими заболеваниями | 83.3 | Взрослые овцы в возрасте 1—5 лет | 76,7 | |||
| Коровы, многократно перегуливающие | 94,9 | Ягнята, переболевшие ОРЗ | 29,5 |
Представленные в таблице данные свидетельствуют о достаточно широком распространении инфекционного ринотрахеита в Беларуси и его роли в заболеваемости животных с различной патологией.
Биологические свойства возбудителя.По современной классификации возбудителем ИРТ является ДНК-геномный вирус, принадлежащий к семейству Herpetoviridae, роду Herpesvirus I. Свойства вируса ИРТ общие для всех представителей рода Herpesvirus и включают: центральное ядро двухцепочнонй ДНК, окруженное икосаэдрическим капсидом, состоящим из 162 камсомеров; формирование капсидов в ядре клетки-хозяина и почкование их на ядерной мембране при созревании; наличие трехслойной оболочки, состоящей из компонентов вируса и клетки-хозяина; продуцирование внутриядерных телец-включений; способность к длительной персистенции, латенции и рецидивам заболевания.
Вирусные частицы имеют следующие размеры, установленные различными способами: 175 нм — метод фильтрования; 148—210 нм — метод ультрацентрифугирования; 100—300 нм — электронная микроскопия. Диаметр нуклеотида — 36—45, молекулярный вес ДНК — 92—102´106 дальтон, диаметр нуклеокапсида — 82—110 нм. Константа седиментации зрелого вириона 1630—1830 S; плавучая плотность в градиенте плотности сахарозы — 1,248—1,267.
Культивирование возбудителя.Для культивирования вируса ИРТ применяют различные культуры клеток из тканей крупного рогатого скота, овец, коз, лошадей, реже — свиней и кроликов. Этот вирус обладает широчайшим тканевым тропизмом. Он может инфицировать клетки надпочечников, вилочковой, щитовидной и поджелудочной желез, семенников, легких, лимфатических узлов, почек как крупного рогатого скота, так и других видов животных.
При изучении ЦПД в неокрашенных препаратах в клеточном монослое заметно округление клеток, зернистость, расположение их кучками в виде скоплений, конгломератов — в виде гроздьев винограда.
В связи с тем, что вирус ИРТ вызывает разнообразные клинические симптомы у крупного рогатого скота, были проведены многочисленные исследования по дифференциации штаммов герпесвирусов I, вызываемых различные формы заболевания.
Были использованы многие методы, такие, как нейтрализационная кинетика, термолабильность, электронное микроскопирование, размножение в тканевых культурах, плавучая плотность, величина бляшек в клеточных культурах, устойчивость к трипсину, зональный электрофорез, рестрикционный анализ, позволившие установить некоторое различие между штаммами вирусов, вызывающих ИРТ и пустулезный вульвовагинит.
Однако эти различия не обнаруживают зависимости между клиническими признаками заболевания и геномным анализом данных штаммов. Это позволило предположить, что только путь инфицирования и тип хозяйства могут быть более важным фактором для клинического проявления заболевания, чем штамм вируса.
Патогенез инфекционного ринотрахеита.Особенностью вируса ИРТ является то, что он имеет тропизм к клеткам органов дыхания, размножения, конъюнктивы, желудочно-кишечного тракта, почек. В результате репродукции вируса в чувствительных клетках наступает их дегенерация, теряется их функция. При этом угнетается иммунная система и нарушаются обменные процессы организма. В зависимости от локализации возбудителя в организме, места его репродукции отмечают и разнообразные клинические признаки болезни.
Клинические признаки болезни.В зависимости от локализации патологического процесса различают несколько форм болезни — респираторную, конъюнктивитальную, нервную, генитальную, абортивную, кожную, стомальную, энтеральную.
В патологии крупного рогатого скота наибольшее распространение получили респираторная, генитальная, абортивная формы, которые и наносят большой экономический ущерб животноводству. Ряд исследователей установили взаимосвязь течения энтеральной, генитальной и респираторной форм ИРТ у крупного рогатого скота различных половозрастных групп.
Генитальная форма проявления ИРТ у коров протекает с признаками воспаления слизистой оболочки с последующей некротизацией эпителия с образованием пустул и язв. Локализация процесса во влагалище не всегда приводит к нарушению репродуктивной функции. Если же вирус проникает в более глубокие части полового аппарата, например, при осеменении инфицированной спермой, возникают цервициты, эндометриты, сальпингиты, оварииты, которые носят временный характер, хотя могут наблюдаться случаи продолжительного бесплодного периода, который выражается в многократных перегулах.
У стельных животных вирус ИРТ может вызывать гибель эмбриона, на более поздних стадиях стельности — гибель плода и аборт или же рождение нежизнеспособных, гибнущих в первые сутки телят. Действие вируса на плод выражается в постепенном прекращении плацентарного кровообращения и последующей дегенерации плаценты, что сопровождается абортами или поражением плода без патологических изменений в плаценте. Это говорит о том, что плод может быть местом первичного размножения вируса.
Установлено, что у плодов 90—100-дневного возраста вырабатываются противовирусные антитела, относящиеся к Ig G1, Ig G2, Ig M и Ig А классов. В защите плода принимают участие и неспецифические факторы — интерферон и фагоцитоз.
Респираторная форма заболевания наиболее часто встречается у молодняка, хотя могут поражаться и взрослые животные. Заболевание клинически проявляется повышением температуры тела, застойной гиперемией, воспалением слизистых оболочек носа, выделением вначале серозного, а затем слизисто-гнойного экссудата. Воспаление слизистой оболочки гортани, трахеи вызывает повышенную секрецию в этих участках, сужение щели гортани и просвета трахеи, закупорку бронхиол, что сильно затрудняет дыхание и усиливает дыхательный шум. В результате этого возникает кашель. При тяжелом течении ИРТ болезнь часто заканчивается гибелью животного.
От инфицированных вирусом инфекционного ринотрахеита коров телята рождаются нежизнеспособными. У них болезнь протекает в генерализованной форме с поражением желудочно-кишечного тракта.
Так, вирус инфекционного ринотрахеита крупного рогатого скота вызывает у животных клиническое проявление заболевания с различным течением — генитальным, респираторным, энтеральным, которые взаимодействуют и создают цепь: плод—теленок—взрослое животное.
Диагноз на инфекционный ринотрахеит ставят комплексно на основании клинико-эпизоотологических данных, патологоанатомических изменений и лабораторных исследований.
Клинико-эпизоотологические данные. Для постановки диагноза с учетом клинико-эпизоотических данных необходимо учитывать следующие моменты:
—тип хозяйства, характер комплектации помещений;
—время возникновения заболевания от начала комплектования помещения;
—характеристика заболеваемости в данном хозяйстве за последних 3—5 лет;
—клинические признаки заболевания;
—характеристика заболевших животных.
Патологоанатомические изменения при инфекционном ринотрахеите. Патологоанатомические изменения характерны для той формы заболевания, от которой животное пало или вынужденно убито.
При респираторной форме болезни устанавливают катаральное воспаление и отек слизистой оболочки носовой полости, гортани, трахеи, скопление серозного или гнойного экссудата в носовых ходах и трахее.Иногда на слизистой оболочке носа обнаруживают очаги некроза, кровоизлияния, серозно-фибринозные пленки.
Конъюнктива отечна, гиперемирована, легкие увеличены в объеме, просветы бронхов и альвеол заполнены пенистой жидкостью или слизисто-гнойным экссудатом. В случаях, когда ИРТ осложняется секундарной микрофлорой, на слизистой носовой полости и трахеи выявляют очаги некроза, дифтеретические наложения, эмфизему легких, катарально-гнойную бронхопневмонию.
При генитальной форме у крупного рогатого скота выявляют гиперемию слизистых оболочек преддверия вагины у коров, препуция и пениса у быков, появление на них кровоизлияний, пустул, а в более поздние сроки - эрозий и язв. Иногда обнаруживают некротические очаги слизистой оболочки, покрытые дифтероидной пленкой.
При патологоанатомическом исследовании некротического баланопостита у зубров, вызванного вирусом инфекционного ринотрахеита, выявляют хроническое катаральное воспаление препуциального мешка, проявляющееся набуханием кожи и подкожной клетчатки. Крайняя плоть набухшая, отечная, сужена с наличием в просвете тягучего экссудата с примесью гнойной жидкости зеленоватого цвета, выход пениса затруднен. Иногда отмечают флегмонозные изменения от пениса до промежности. При некротическом баланопостите отмечается уроцистит.
При конъюнктивальной форме при вскрытии обнаруживаются неровности с серыми наложениями, которые придают слизистой оболочке зернистый вид. Иногда отмечается кератоконъюнктивит с помутнением роговицы.
При энцефалитной форме, которая проявляется одновременно с респираторной, видимых поражений головного мозга не отмечается. Однако имеется гиперемия мозговых оболочек. При гистологическом исследовании обнаруживают негнойный энцефалит.
При энтеральной форме инфекционного ринотрахеита на вскрытии отмечают обезвоживание организма, катаральное воспаление тонкого кишечника, поражение почек.
Лабораторные исследования при инфекционном ринотрахеитевключают в себя:
—выявление вируса или вирусного антигена в биологическом материале;
—выявление антител у больных или переболевших животных;
—гистологические исследования.
Материалом для выделения вируса или вирусного антигена служат экссудат из носа, влагалища, конъюнктивы, препуция, пораженные ткани респираторных органов, кишечника, а также кровь от больных животных.
Вирусовыделение из биологического материала от больных животных проводят на первично-трипсинизированных клетках почки эмбриона коровы (ПЭК), тестикул бычка (ТБ), перевиваемых клетках почки теленка (ПТ-80 или МДБК). Для вирусовыделения проводят 3 слепых пассажа на культуре клеток и затем проводят идентификацию вируса в одной из иммунологических реакций: нейтрализации (РН), иммуноферментном анализе (ИФА), непрямой гемагглютинации (РНГА), торможения непрямой гемагглютинации (РТНГА).
Выявление вирусного антигена осуществляют из биологического материала — мазков отпечатков из пораженных органов — трахеи, слизистой носовой полости, легких, почек, желудочно-кишечного тракта в в одной из иммунологических реакций: иммунофлуоресценции (МФА), иммуноферментном анализе (ИФА).
Серологические исследования проводят путем исследования сывороток крови, молока, молозива, носовых секретов на обнаружение специфических противовирусных антител. Для подтверждения диагноза обычно используют парные сыворотки крови, взятые от животных в начале заболевания и через 2—3 недели. Также исследуют и одинарные пробы крови. Но при этом необходимо учитывать следующее: наличие антител в сыворотках крови от телят до месячного возраста свидетельствует о состоянии колостральной защиты молодняка; наличие антител у телят старше 4—5-месячного возраста свидетельствует о наличии постинфекционных антител.
Наличие антител у взрослых животных в крови, молоке или молозиве свидетельствует о циркуляции возбудителя в стаде и о степени инфицирования животных; наличие антител в носовых секретах свидетельствует о местной иммунной защите животных (у переболевших животных — о постинфекционном иммунитете, у вакцинированных животных — о наличии поствакцинальных антител).
Для выявления антител к вирусу инфекционного ринотрахеита используют следующие иммунологические реакции: нейтрализации (РН), иммуноферментный анализ (ИФА), непрямой гемагглютинации (РНГА), задержки гемагглютинации (РЗГА), связывания комплемента (РСК).
Вирусная диарея крупного рогатого скота
(Diarrhea vizalis bovum)
Определение.Вирусная диарея крупного рогатого скота (болезнь слизистых оболочек, мукозальная болезнь, инфекционная диарея крупного рогатого скота, инфекционный энтерит крупного рогатого скота, диарея новорожденных телят) — контагиозная болезнь преимущественно молодых животных, характеризующаяся эрозивно-язвенным воспалением слизистых оболочек пищеварительного тракта. Зачастую возникает синдром респираторного заболевания, эрозивно-язвенный стоматит с хромотой, а также латентная инфекция коров, приводящая к острой инфекции плодов, вызывая их мумификацию, аборты, врожденные дефекты и диарею новорожденных телят.
Историческая справка.Впервые вспышку вирусной диареи (ВД) описали в Северной Америке в штате Нью-Йорк в 1946—1947 гг. Olafson et al. Ими установлено, что среди взрослых коров до 90% могут иметь противовирусные антитела без клинических признаков болезни.
Вирусная диарея крупного рогатого скота широко распространена во всех странах мира с развитым промышленным животноводством. Вспышки ВД отмечены в ФРГ в земле Шлезвиг-Гольтшвейн, Ирландии, Великобритании, США, Молдове, России, Беларуси, на Украине и т.д.
Эпизоотологические данные.Наряду с крупным рогатым скотом в естественных условиях к вирусной диарее восприимчивы буйволы, олени, косули, козы, овцы. У свиней инфекция протекает бессимптомно. Серологические исследования показали, что в полевых условиях вирус диареи инфицирует свиней, коз, буйволов, оленей , косуль, овец, беловежских зубров, красных оленей. Вирус диареи выделен от человека при наличии у него специфических антител. Имеются сообщения о возможности экспериментального заражения овец, коз, поросят и кроликов. Лабораторные животные — белые мыши, крысы, морские свинки, хомячки, собаки, кошки, цыплята, голуби устойчивы к заражению.
Нами проведено серологическое обследований различных чувствительных к вирусной диарее животных ( табл.7).
Приведенные в таблице данные показывают, что вирус диареи широко распространен в природных условиях. Наряду с поражением сельскохозяйственных животных (крупного рогатого скота, овец, коз), вызывая у них заболевание, вирус циркулирует в стадах диких животных (зубры и маралы), а также у человека.
Основным источником возбудителя инфекции являются больные животные, выделяющие вирус во внешнюю среду со слюной, слезами, носовыми истечениями, мочой, фекалиями, спермой и молоком. Большую опасность представляют животные-вирусоносители с хроническим и латентным течением болезни. В клетках лимфоидной ткани переболевших животных вирус может персистировать (находиться) от 120 до 200 дней. Перезаражение происходит воздушно-капельным путем, при прямом контакте здоровых животных с больными, а также при поедании инфицированного корма. Установлено внутриутробное заражение, а также через молоко больных матерей.
Вирусная диарея регистрируется в любое время года, но более тяжело она протекает поздней осенью и зимой. Возникновению болезни способствуют факторы, понижающие резистентность организма: переохлаждение, неполноценное и несбалансированное кормление, транспортировка и др.
Таблица 7
Результаты исследования сывороток крови от различных видов животных на наличие антител к вирусу диареи крупного рогатого скота
| Клиническое состояние и возраст | Исследовано проб | Положительный результат (%) | Клиническое состояние и возраст | Исследовано проб | Положительный результат (%) | |||||||
| Крупный рогатый скот | Беловежские зубры | |||||||||||
| Коровы, 3—10 лет, клинически здоровые | 83,1 | Самцы, начальная стадия некротического баланопостита 1—10 лет | 44,4 | |||||||||
| Телята, 1—6 мес., больные ОРЗ | 68,1 | Самцы, больные некротическим баланопоститом 1—10 лет | 76,2 | |||||||||
| Телята, 1—6 мес., переболевшие ОРЗ | 81,1 | Самцы, клинически здоровые, старше 10 лет | 40,0 | |||||||||
| Телята старше 6 мес., клинически здоровые | 87,7 | Самцы, клинически здоровые, 1—7 лет | 85,7 | |||||||||
| Телята до 1 мес., клинически здоровые | 57,7 | Самки, клинически здоровые, старше 10 лет | 53,9 | |||||||||
| Коровы, абортировавшие | 84,4 | Самки, клинически здоровые, 1—7 лет | 55,5 | |||||||||
| Овцы | ||||||||||||
| Коровы с гинекологическими заболеваниями | 100,0 | Взрослые овцы в возрасте 1—5 лет | 59,6 | |||||||||
| Коровы, многократно перегуливающие | 94,9 | Ягнята, переболевшие ОРЗ | 91,2 | |||||||||
| Маралы | Козы | |||||||||||
| Самцы, клинически здоровые, возраст 2—6 лет | 11,0 | Самки, клинически здоровые, возраст 2—6 лет | 34,9 | |||||||||
Вирусная диарея чаще всего проявляется в виде энзоотических вспышек среди молодняка на животноводческих фермах и комплексах. Заболеваемость колеблется от 10 до 100%, летальность - от 5 до 95%. Это зависит от вирулентности штамма вируса, резистентности организма животных, уровня иммунитета, зоогигиенических условий содержания.
Биологические свойства возбудителя.Возбудителем вирусной диареи крупного рогатого скота является РНК-геномный вирус, относящийся к семейству Тogaviridaе, роду Pestivirus. Плавучая плотность вируса диареи (штаммы “NADL”, “Oregon C24-V”, C-1220) в градиенте плотности хлористого цезия составляет 1,15 г/см3.; 1,115 г/см3 (для вируса Oregon C24-V”) в градиенте плотности тартрата калия; 1,075—1,115 (средняя 1,092) для штамма NADL в градиенте плотности сахарозы. Вирус диареи к.р.с. имеет родственные растворимые антигены с вирусом чумы свиней.
Культивирование возбудителя.Вирус диареи в значительной степени обладает пантропностью, т.е. репродуцируется в различных органах и тканях крупного рогатого скота и других видов животных. Вирус размножается в первичных культурах клеток ПЭК, семенников теленка, почки ягненка, перевиваемой культуре клеток селезенки эмбриона коровы, макрофагах и лимфоцитах крупного рогатого скота. Имеются сведения о возможности культивирования вируса в перевиваемой культуре почек свиньи РК-15, почек хомяка (линии НАК), человеческих клетках линий ЕРК-1, Не1а.
Цитопатический эффект в инфицированной культуре обычно начинает развиваться на 3—5-е сутки инкубации и выражается в появлении мелкозернистой инфильтрации в клетках фибробластического типа. По мере развития инфекции клетки постепенно отторгаются от поверхности стекла. Но некоторые долго сохраняются, образуя островки распластанных по стеклу истонченных клеток эпителиодного типа. В конце концов на стекле остается сеть зернистого материала.
A.L.Fеrnelius изучал динамику накопления вирусного антигена в культуре клеток методом иммунофлуоресценции и установил, что развитие вируса начинается в ядре через 6—8 часов после заражения, затем вирусный антиген перемещается в перинуклеарную зону и обнаруживается в области аппарата Гольджи (12—24 часа), а затем — в цитоплазму клеток, вызывая яркое гранулярное свечение (48—71 час), а затем диффундирует по всей цитоплазме (96 часов). Сроки наступления ЦПД не соответствуют скорости размножения вируса, максимальное накопление которого в инфицированной культуре клеток ПЭК происходит обычно через 96 часов инкубации (титр 106,5 ТЦД 50) мл, а наибольшее развитие ЦПД обнаруживают в более поздние сроки (на 4—6-е сутки).
Патогенез вирусной диареи.Учитывая то, что вирус диареи имеет тропизм к клеткам органов дыхания, размножения, иммунной системы, желудочно-кишечного тракта, почек, его воздействие на организм различно. В результате репродукции вируса в чувствительных клетках наступает дегенерация и нарушается их функция. Особенно это касается иммунной системы. Из-за переболевания животных вирусной диареей отмечена сильная иммунодепрессия. По этой причине иммунная система организма не в состоянии отвечать на другие вирусные и бактериальные антигены. Кроме того, после болезни отмечаются нарушения обменных процессов организма. В зависимости от локализации возбудителя в организме, места его репродукции отмечают и клинические признаки заболевания.
У животных, у которых развивалась персистентная инаппаратная инфекция вирусной диареи, очень часто поражались почки и мозг. При микроскопическом исследовании отмечались диффузные и фокусные утолщения гломерулярных мембран, в глорумелах — значительное увеличение мезенхимальных клеток и небольшое количество нейтрофилов. В коре головного мозга наблюдалась дегенерация нейронов, окруженных небольшим количеством астроцитов и макрофагов. В мозжечке лишь редкие клетки Пуркинье содержали флуоресцирующий антиген, так же, как и в спинном мозге (затылочной части).
Клинические признаки заболевания.При переболевании крупного рогатого скота вирусной диареей наблюдаются различные формы течения болезни: энтеральная, респираторная, генитальная, абортивная, что зависит от вирулентности штамма, возраста и чувствительности животных, наличия неблагоприятных факторов внешней среды. Ряд авторов отмечали течение вирусной диареи с поражением кожи в виде дерматита в области межкопытной щели и вокруг венчика, струпьев на лицевой части головы и по всей поверхности тела. Установлена связь между инфекцией вирусной диареи с абортами у коров, диареей новорожденных и респираторных заболеваний у телят старше 3—4-месячного возраста.
Как и при инфекционном ринотрахеите, чаще всего при вирусной диарее регистрируют энтеральную, генитальную, абортивную и респираторную формы инфекции, которые наносят большой экономический ущерб животноводству.
Энтеральная форма вирусной диареи встречается как у новорожденных телят, так и у взрослых животных. Вначале у телят наблюдается сильная диарея, а в фекалиях — значительное количество слизи. Через несколько дней отмечается обезвоживание организма различной степени тяжести. Лечение животных антибиотиками и вяжущими средствами неэффективно.
У коров основными признаками заболевания бывает лихорадка, затяжные поносы, кашель, поражение слизистой оболочки носовой и ротовой полостей, желудочно-кишечного тракта. Смерть наступает от обезвоживания. У телят до 6 мес. заболевание имеет тенденцию к длительному хроническому течению (до 10 мес.) с периодическими ремиссиями. Летальность достигает 80%. Основными клиническими симптомами являются: понос, обезвоживание, потеря аппетита, снижение живой массы.
После переболевания новорожденных телят энтеральной формой вирусной диареи у них через 2—3 мес. можно отметить поражение респираторных органов. При этом наблюдается повышение температуры, кашель, истечение из носовой полости.
У взрослых животных вирусная диарея протекает в основном в хроническом и субклиническом проявлениях и сопровождается абортами, иммуносупрессией, персистентной инфекцией, появлением на свет слабого потомства.
Одним из путей передачи вирусной диареи и внутриутробного заражения является трансплантация эмбрионов. При этом поражаются как плоды крупного рогатого скота, так и репродуктивные органы коров. У телят, трансплацентарно инфицированных вирусом диареи, установили гипоплазию мозжечка и водянку головного мозга. Молодняк, полученный от коров, вакцинированных между 90 и 118 днями стельности, имел поражения центральной нервной системы: атаксию, искривление шеи, астазию, опистотонус.
При абортивном течении вирусной диареи у недоношенных плодов раннего возраста наблюдают геморрагические изъязвления слизистой оболочки, некроз легких, кожи, головного мозга, воспалительные поражения околоплодных оболочек и кожного покрова.
Диагноз на вирусную диарею ставят комплексно на основании клинико-эпизоотологических данных, патологоанатомических изменений и лабораторных исследований(см.главу “Инфекционный ринотрахеит”).
Патологоанатомические изменения при вирусной диарее. Патологоанатомические изменения характерны для той формы заболевания, от которой животное пало или вынужденно убито.
Характерные патологоанатомические изменения обнаруживают на слизистых оболочках желудочно-кишечного тракта и дыхательных путей. Эрозии и язвы находят на слизистой оболочке губ, щек, десен, на боковых поверхностях языка, на небе и у основания гортани. Аналогичные изменения обнаруживают в рубце и сычуге. В тонком кишечнике отмечают изменения, характерные для катарального, фибринозно-некротического или геморрагического энтерита.
При генитальной форме заболевания, возникающей у взрослых животных, на вскрытии у павших или вынужденно убитых животных не обнаруживают характерных патологоанатомических изменений. На абортированных плодах имеются характерные для вирусной диареи изменения — геморрагические изъязвления слизистой оболочки, некроз легких, кожи, головного мозга, воспалительные поражения околоплодных оболочек и кожного покрова. Иногда можно наблюдать гипоплазию мозжечка и водянку головного мозга.
Комплекс лабораторных исследований при вирусной диареетакой же, как и при ИРТ - выявление специфического антигена из биологического материала с использованием иммуноферментного анализа (ИФА) или иммунофлуоресценции (МФА), выделение вируса на культуре клеток и его идентификация в реакциях нейтрализации (РН) и торможения непрямой гемагглютинации (РТНГА). Сюда же входит реакция связывания комплемента (РСК), иммуноферментный анализ (ИФА), а также ретроспективная диагностика с помощью реакции непрямой гемагглютинации (РНГА), иммуноферментного анализа (ИФА), нейтрализации (РН), связывания комплемента (РСК).
Респираторно-синцитиальная инфекция крупного рогатого скота
(Bovine respiratory suncytial disease)
Определение.Респираторно-синцитиальная инфекция к.р.с. (заразный кашель, пульмональная эмфизема) - контагиозная, остро протекающая болезнь, преимущественно телят. Она характеризуется лихорадкой и катаральным воспалением слизистых оболочек органов дыхания, сильным кашлем, потерей аппетита, поражением легких.
Историческая справка.Респираторно-синцитиальный вирус впервые изолирован в 1956 г. от шимпанзе с клиническими признаками поражения верхних дыхательных путей и назван “возбудителем насморка шимпанзе”. В следующем году R.M.Chanock et al. выделили антигенно-родственный изолят от двух детенышей с симптомами заболевания нижнего отдела органов дыхания. С учетом специфики развивающегося в инфицированной культуре клеток цитопатического действия вирус был переименован в “респираторно-синцитиальный”.
Впервые в 1968 г. J.E.Dagget et al. сообщили об обнаружении вируснейтрализующих антител к респираторно-синцитиальному вирусу человека в сыворотках крови крупного рогатого скота. Это позволило им предположить присутствие у к.р.с. антигенно-родственного человеку респираторно-синцитиального вируса.
Спустя два года респираторно-синцитиальный вирус крупного рогатого скота был, наконец, изолирован M.F.Paccand et al. Последующие исследования подтвердили значение респираторно-синцитиального вируса в возникновении респираторных болезней крупного рогатого скота. Впоследствии вирус был изолирован от людей и к.р.с. на Европейском континенте, в Америке, Азии.
Респираторно-синцитиальный вирус от крупного рогатого скота выделен в Венгрии, Норвегии, ФРГ, Англии, Нидерландах, США, бывшем СССР. Антитела к респираторно-синцитиальному вирусу обнаружены в сыворотках крови крупного рогатого скота на территории Болгарии, Нидерландов, Швейцарии, США, Венгрии, Кубы, бывшего СССР.
Эпизоотологические данные.К респираторно-синцитиальному вирусу восприимчивы различные возрастные группы животных. Однако наиболее часто встречаются сообщения о заболеваниях молодняка крупного рогатого скота. Так, Х.Е.Хараламбиев с соав. описали в Болгарии энзоотию среди телят 30—90-дневного возраста, вызванную респираторно-синцитиальным вирусом. В США была зарегистрирована эпизоотия 1,5—3-месячных телят, в Канаде — 1—8-месячных, в Чехословакии — заболевание молодняка на откорме от 2 до 9-месячного возраста.
Респираторно-синцитиальной инфекцией чаще всего заболевает крупный рогатый скот различных возрастных групп.
У телят от 1 до 12 мес. указанная инфекция проявляется с поражением органов дыхания. У взрослых коров болезнь чаще всего протекает бессимптомно, но иногда отмечаются пневмонии и аборты. Кроме того, заболевание отмечают у овец, коз, лошадей. Экспериментально респираторно-синцитиальная инфекция воспроизведена у обезьян (шимпанзе, мартышка), хорька, норки, морских свинок, 1-дневных мышат.
Для изучения распространения респираторно-синцитиальной инфекции среди домашних и диких животных нами проведено серологическое обследование различных чувствительных к данному вирусу животных ( табл.8).
Представленные результаты свидетельствуют о широкой циркуляции респираторно-синцитиального вируса в стадах различных копытных жвачных.
Биологические свойства возбудителя.Возбудителем респираторно-синцитиальной инфекции является РНК-геномный вирус, относящийся к семейству Paramyхoviridae, роду Pneumovirus. РС‑вирус обладает большим полиморфизмом и имеет размер от 80 до 450 нм. Частицы чрезвычайно полиморфны от округлых шаровидных до вытянутых в разной степени. Разрушенные части вириона имеют внутреннюю структуру, состоящую из коротких, расположенных елочкой нитей диаметром 11—15 нм и регулярную периодичность приблизительно 74 ангстрем. Структурная особенность, уникальная для респираторно-синцитиального вируса — спиральная исчерченность вокруг сердцевины на внутренней поверхности оболочки.
Таблица 8
Результаты исследования сывороток крови от различных видов животных на наличие антител к респираторно-синцитиальному вирусу
| Клиническое состояние и возраст | Исследо-вано проб | Положи-тельный результат (%) | Клиническое состояние и возраст | Исследовано проб | Положительный результат (%) | |
| Крупный рогатый скот | Беловежские зубры | |||||
| Коровы, 3—10 лет, клинически здоровые | 60,8 | Самцы, начальная стадия некротического баланопостита 1—10 лет | 33,3 | |||
| Телята, 1—6 мес., больные ОРЗ | 50,5 | Самцы, больные некротическим баланопоститом 1—10 лет | 47,6 | |||
| Телята, 1—6 мес., переболевшие ОРЗ | 72,5 | Самцы, клинически здоровые, старше 10 лет | 20,0 | |||
| Телята, старше 6 мес., клинически здоровые | 73,4 | Самцы, клинически здоровые, 1—7 лет | 42,9 | |||
| Телята до 1 мес., клинически здоровые | 44,2 | Самки, клинически здоровые, старше 10 лет | 53,9 | |||
| Благородные олени | Самки, клинически здоровые, 1-7 лет | 44,4 | ||||
| Взрослые самки и самцы 3—8 лет | 38,2 | Овцы | ||||
| Козы | Взрослые овцы в возрасте 1—5 лет | 58,0 | ||||
| Самки, клинически здоровые, возраст 2—6 лет | 44,5 | Ягнята, переболевшие ОРЗ | 50,0 |
Плавучая плотность вирионов от 1,17—1,2 г/см3 до 123 г/см3, коэффициент седиментации РНК вириона — 52 S, плотность нуклеотидов 1,26—1,27 г/см3.
Гемагглютинин респираторно-синцитиального вируса имеет форму бутылок (длиной 1,2—1,6 нм), обращенную горлышком к базальной мембране. В оболочке вириона содержатся липиды и полисахариды, нет нейраминидазы. В ультратонких срезах установлено почкование зрелых вирионов от цитоплазматической мембраны.
Респираторно-синцитиальный вирус чрезвычайно чувствителен к эфиру, хлороформу, воздействию физико-химических факторов, хранению при температуре выше 700С. В антигенном отношении данный вирус крупного рогатого скота идентичен или антигенно-родственен респираторно-синцитиальному вирусу человека и вирусу пневмонии мышей.
Культивирование возбудителя.Все выделенные штаммы респираторно-синцитиального вируса хорошо размножаются на первичных культурах клеток крупного рогатого скота — почек эмбриона коровы, тестикулах бычка, а также органных культурах легких и трахеи первых пассажей. Многие гомологичные или гетерологичные культуры клеток восприимчивы к заражению РС-вирусом (крупного рогатого скота — ПЭК, ТБ, щитовидной железы, тимоцитарная культура, кишечный эпителий; свиньи — почки и легких эмбриона; хомяка — легких и почек; обезьяны — почки, Vero; человека — легкие и почки эмбриона, НеIа, Нер-2). Лучший рост бычьих штаммов отмечают в гомологичных культурах (полученных от крупного рогатого скота), так как и респираторно-синцитиальный вирус человека лучше репродуцируется в гомологичных и обезьянних культурах, чем в тех, которые, происходят от крупного рогатого скота.
Начальная стадия ЦПД, характеризующаяся округлением клеток и образованием небольших синцитиев, содержащих эозинофильные включения, обнаруживают от 2—3 до 6 суток после заражения. При размножении на культуре клеток респираторно-синцитиальный вирус не достигает высоких титров, максимум — 103—104 ТЦД 50 мл. Добавление 2—5% сыворотки телят, лишенной антител против респираторно-синцитиального вируса или 0,1 мг трипофлавина, значительно увеличивает образование синтициев, что облегчает его индикацию в культуре клеток.
Морфологическое изучение инфицированных респираторно-синцитиальным вирусом клеток посредством световой и электронной микроскопии выявило еще некоторые особенности вирусной репликации. Вирусный антиген, выявляемый с помощью реакции иммунофлуоресценции, появляется в цитоплазме инфицированных клеток через 8—9 часов после их заражения. Возле ядра появляются эозинофильные тельца-включения, окрашиваемые в желто-зеленый цвет акридиновым оранжевым. Это плеоморфные электронно-плотные тельца-включения имеют гранулярную или нитевидную структуру; гранулы или нити имеют диаметр около 12 нм. Моноклональные антитела к нуклеопротеину или фосфопротеину связываются с этими тельцами-включениями, что указывает на наличие в них нуклеокапсидов респираторно-синцитиального вируса.
Вирионы созревают посредством почкования от участков цитоплазматической мембраны, на которой располагаются выросты длиной 12 нм. Почкующиеся образования имеют округлую форму и диаметр от 80 до 150 нм, или в случае, когда имеют филаментозную (нитчатую) форму — длину до 10 мкм. На поперечных срезах филаменты содержат 6—12 электронно-плотных циркулярных структур или пятен диаметром 12 нм, а на продольном разрезе — несколько нитей того же размера. По всей вероятности, эти образования представляют собой нуклеокапсиды, так как их появление и размеры сходны с таковыми, выявленными в описываемых тельцах-включениях.
При иммунофлуоресцентном исследовании зараженных респираторно-синцитиальным вирусом культур клеток находят яркое свечение цитоплазмы, которое наступает через 10—24 часа после заражения и развивается вначале в перинуклеарной и ядерной зонах, затем охватывает всю цитоплазму. Часто обнаруживают яркосветящиеся включения округлой формы и различной величины.
Патогенез респираторно-синцитиальной инфекции.При заболевании вирус размножается в клетках эпителия слизистых оболочек бронхиол, вызывая в них развитие дистрофических и некротических изменений. Воспалительные процессы ведут к застою кровообращения, выпотеванию серозной жидкости в просвет альвеол и бронхиол, образованию небольших кровоизлияний. Однако слизистая оболочка воздухоносных путей при этом не повреждается. Длительная персистенция вируса в клетках обусловливает образование синцитиев из инфицированных клеток. При респираторно-синцитиальной инфекции в основном поражается нижний участок респираторного тракта.
Клинические признаки заболевания.Респираторно-синцитиальный вирус вызывает у телят в основном риниты, трахеиты, бронхиты, бронхиолиты и интерстициальную пневмонию.
Телята заражаются, в основном, в период отъема. У инфицированной особи в первые дни заболевания наблюдают редкий кашель, незначительные выделения из носа и потерю аппетита. Затем развивается острая аллергическая реакция на вирус, что нередко приводит к гибели животного. При хороших условиях содержания животных скотоводы не замечают заболевания и симптомом бедствия является внезапный падеж одного или нескольких телят-отъемышей.
Симптомы заболевания сходны с наблюдаемыми при других вирусных респираторных инфекциях и проявляются слабой лихорадкой, затрудненным дыханием, кашлем, водянистыми истечениями из носовой полости, учащенным абдоминальным дыханием, конъюнктивитами. Заболевание длится в среднем 3—5 или 7—10 дней, в некоторых случаях — 10—15 дней. Прогноз болезни, как правило, благоприятный. В большинстве случаев заболевание заканчивается выздоровлением животных без серьезных осложнений, если они подвергались лечению антибиотиками для предупреждения вторичной бактериальной инфекции. Некоторые авторы сообщили, что при более тяжелом течении заболевания может наблюдаться бронхопневмония, интерстициальная эмфизема, отек легких. В этих случаях выздоровление наступает в течение месяца или животное погибает.
Установлено, что вспышкам респираторно-синцитиальной инфекции у крупного рогатого скота может способствовать наличие стрессовых факторов. Вспышки болезни и тяжесть ее течения зависят от сезонности. По данным А. van Nienwstadt еt al., вспышки респираторно-синцитиальной инфекции среди крупного рогатого скота чаще всего регистрируются в осенне-зимний или зимне-осенний период.
Американские специалисты различают две стадии болезни: первую — первичное инфицирование в пастбищный период, которое проявляется слабыми клиническими симптомами и нередко остается незамеченным; и вторую, которую регистрируют обычно в период отъема телят.
Инкубационный период при респираторно-синцитиальной инфекции телят продолжается около 48 часов. В хозяйствах заболевание 4—12-месячных телят возникает обычно внезапно, в течение 2—3 дней достигает максимального развития и также быстро, через 3—5 дней, затухает. Заболеваемость на уровне 62—100%, смертность — 5—10%.
Патологоанатомические изменения.У естественно инфицированных и экспериментально зараженных животных после их смерти или убоя патологоанатомические изменения выявляются лишь в легких. Микроскопические поражения заключаются в катаральном воспалении дыхательных путей и образовании в паренхиме легких мелких (размером до 1 мм), участков уплотнения темно-красного или синюшного цвета. Пневмонические дольки отечны, разбросаны по всей паренхиме легкого. Выявляют небольшие геморрагии и разной степени выраженности компенсаторную мелкоочаговую интерстициальную эмфизему. Бронхи пораженных сегментов иногда содержат слизь. Бронхиальный и средостенный лимфатические узлы увеличены, гиперемированы, отечны, с кровоизлияниями. В более тяжелых случаях возможен слабый трахеит с отеком слизистой оболочки и кровоизлияниями в ней.
В чистом виде респираторно-синцитиальная инфекция встречается редко — в основном в ассоциациях с вирусами ИРТ, ВД, ПГ-3.
Комплекс лабораторных исследований при респираторно-синцитиальной инфекциитакой же, как и при инфекционном ринотрахеите — выявление специфического антигена из биологического материала с использованием иммуноферментного анализа (ИФА) или иммунофлуоресценции (МФА), выделение вируса на культуре клеток и его идентификация в реакциях нейтрализации (РН) и торможения непрямой гемагглютинации (РТНГА), связывания комплемента (РСК), иммуноферментном анализе (ИФА), а также ретроспективная диагностика с помощью реакции непрямой гемагглютинации (РНГА), иммуноферментного анализа (ИФА), нейтрализации (РН), связывания комплемента (РСК).
Парагрипп-3 крупного рогатого скота
(Parainfluenza-3 bovum)
Определение.Парагрипп-3 крупного рогатого скота (инфекционный бронхит, бронхопневмония, острый катар верхних дыхательных путей, транспортная лихорадка, параинфлуенца-3) - острое контагиозное заболевание к.р.с. (преимущественно молодняка до 6-месячного возраста) характеризующееся катарально-гнойным поражением органов дыхания, лихорадкой, общим угнетением, приступами сухого,болезненного кашля, катаральным конъюнктивитом.
Историческая справка. R.B.Canock et al. впервые в 1958 г. сообщил о новом гриппоподобном заболевании детей. Его возбудитель был отнесен к семейству Paramyxoviridae и обозначен как парагриппозный вирус тип 3 (ПГ-3). В 1959 г. P.S.Resinger et al. от телят с признаками “транспортной лихорадки” выделил вирус, идентифицированный впоследствии как парамиксовирус параинфлюэнцы 3 (штамм SF-4) и доказал его патогенность для к.р.с. Изолированный от крупного рогатого скота вирус (штамм SF-4) оказался в антигенном отношении близок к вирусу парагриппа-3 человека. Начиная с 1959 г., вирус парагриппа-3 изолировали во многих странах мира: США, Великобритании, ФРГ, Болгарии, Польше, Румынии и т.д.
В СССР вирус парагриппа-3 впервые выделили В.В.Гуненков и В.Н.Сюрин в 1968 г. от телят с респираторными заболеваниями в одном из спецхозов Тамбовской области. В последующем в различных республиках СССР диагноз на парагрипп-3 подтверждался серологически и с помощью вирусовыделения.
Эпизоотологические данные.В естественных условиях к вирусу парагриппа-3 восприимчивы различные возрастные группы к.р.с. Однако наиболее часто встречаются сообщения о заболевании молодняка крупного рогатого скота в возрасте до года. Имеются сообщения о выделении вируса парагриппа-3 от взрослых буйволов и буйволят в Египте, овец — в Болгарии, лошадей — в Австралии, коров с поражениями репродуктивных органов — в США. Антитела к вирусу парагриппа-3 обнаруживались у здоровых 96% коров, до 85% — у овец. Также антитела обнаруживались у лошадей, антилоп, бегемотов, коз, обезьян, кур, котов,собак, крыс, хомяков, мышей.
По данным Х.Хараламбиева (1968), резервуаром вируса парагриппа-3 в природе являются овцы.
При экспериментальном инфицировании вирусом парагриппа-3 возможно заразить мышей-сосунков с последующим накоплением вируса в тканях мозга, легких, печени и селезенки в титрах до 5,0 lg ТЦД 50/мл. Заражение морских свинок, кроликов, хомяков не приводит к развитию клинических признаков болезни: развивается бессимптомная инфекция. Аналогичное заражение ягнят и поросят бычьим штаммом не приводит к развитию клинических признаков парагриппа-3. Однако инфицированные ягнята и поросята при контакте с крупным рогатым скотом могут служить источником инфекции.
Нами проведены исследования по серологическому обследованию различных видов копытных на наличие антител к вирусу парагриппа-3 крупного рогатого скота (табл.9).
Таблица 9
Результаты исследования сывороток крови от различных видов животных на наличие антител к вирусу парагриппа-3 крупного рогатого скота
| Клиническое состояние и возраст | Исследо-вано проб | Положи-тельный результат (%) | Клиническое состояние и возраст | Исследовано проб | Положительный результат (%) | ||
| Крупный рогатый скот | Беловежские зубры | ||||||
| Коровы, 3-10 лет, клинически здоровые | 45,8 | Самцы, начальная стадия некротического баланопостита, 1-10 лет | 44,4 | ||||
| Телята, 1-6 мес., больные ОРЗ | 35,9 | Самцы, больные некротическим баланопоститом, 1-10 лет | 66,7 | ||||
| Телята, 1-6 мес., переболевшие ОРЗ | 66,5 | Самцы, клинически здоровые, старше 10 лет | 40,0 | ||||
| Телята старше 6 мес., клинически здоровые | 50,6 | Самцы, клинически здоровые, 1-7 лет | 71,4 | ||||
| Телята до 1 мес., клинически здоровые | 40,9 | Самки, клинически здоровые, старше 10 лет | 61,5 | ||||
| Благородные олени | Самки, клинически здоровые, 1-7 лет | 55,6 | |||||
| Взрослые самки и самцы, 3-8 лет | 40,0 | Овцы | |||||
| Козы | Взрослые овцы в возрасте 1-5 лет | 95,0 | |||||
| Самки, клинически здоровые, возраст 2—6 лет | 50,3 | Ягнята, переболевшие ОРЗ | 44,3 |
Данные таблицы свидетельствуют о широкой циркуляции вируса парагриппа-3 в стадах различных копытных жвачных.
Биологические свойства возбудителя.Возбудитель парагриппа-3 крупного рогатого скота — РНК-геномный вирус, относится к семейству Paramyxoviridae, роду Paramyxovius. Вирусные частицы — сферической или овальной формы, имеют величину 120—240 нм. По данным В.А.Надточей (1972), размеры вирионов варьируют в пределах 80—460 нм у круглых и 283—1410 нм у нитевидных частиц. По внешней оболочке вирионов расположены шиповидные отростки размером 30—35 х 100—150 ангстрем, которые содержат гемагглютинин. Геном вируса представлен несегментированной однонитевой линейной РНК с молекулярной массой 6—8 млн. дальтон. Молекулярная масса вириона — 500—700 мегадальтон, коэффициент седиментации — 1000 S, плавучая плотность в градиенте плотности сахарозы — 1,19 г/см3.
В состав вируса парагриппа-3 крупного рогатого скота входят: гемагглютинин, нейраминидаза, гемолизин и растворимый антиген. Антигенной вариабельности у штаммов вируса парагриппа-3 не установлено. Отдельные штаммы вируса различаются по гемагглютинирующей активности, вирулентности, характеру цитопатического действия.
Культивирование возбудителя.Для культивирования вируса парагриппа-3 к.р.с. успешно используются как первичные, так и перевиваемые линии клеток различных животных и человека. Так, из первичных клеток вирус парагриппа-3 культивируется на: эпителиальных клетках почки теленка, тестикул бычка, овцы, обезьяны, кошки, морской свинки, куриных фибробластах, клетках амниона человека и др. Из перевиваемых — на линиях опухолей человека Hela, Нер-2, почек теленка — МДБК, ПТ-80, тестикул бычка — ТБ, почки эмбрионов овцы, хомячка, морской свинки, диплоидных клетках фибробластов человека и т.д.
Пораженные клетки округляются, через 48—72 часа наблюдается появление гранулированных многоядерных клеток и синцитиальных полей. Клетки образуют симпласты, в цитоплазме появляются эозинофильные включения.Они наиболее часто обнаруживаются через 72—96 часов. Включения полиморфны, окружены светлым ореолом, располагаются как в перинуклеарной зоне, так и по периферии клеток. Включения содержат отработанные митохондрии и специфический антиген, но нет оформленных вирусных частиц.
При размножении вирусов парагриппа-3 в первично-трипсинизированных клеточных культурах цитопатические изменения ограничиваются разрежением монослоя, появлением гранулированных или пикнотизированных округлых клеток, быстро отстающих от стекла. Многоядерные клетки возникают в результате их слияния, а также цитофагии. В их основе лежит способность пораженных вирусом клеток продуцировать особое вещество — синцитин, способствующее расплавлению стенок клеток и вызывающее сближение ядер.
Патогенез парагриппа-3 крупного рогатого скота. Вирус парагриппа-3 к.р.с. проникает в плазму клеток с помощью гемагглютинина и нейраминидазы. Он репродуцируется в эпителиальных клетках дыхательных путей, главным образом бронхиол, вызывая их гиперплазию и деструкцию. На месте репродукции вируса отмечают воспалительные явления, кровоизлияния, образование дефектов слизистой оболочки, что способствует проникновению в организм секундарной микрофлоры и осложняет течение болезни.
Гистологические изменения характеризуются наличием эозинофильных цитоплазматических и внутриядерных включений, которые служат характерным признаком парагриппозной инфекции.
Клинические признаки заболевания.Инкубационный период при парагриппе-3 продолжается от 24—30 часов до 3—5 дней. Различают острое, подострое и хроническое течение.
При остром течении наблюдают повышение температуры тела до 41—42 °С, снижение аппетита, поверхностное, учащенное дыхание, кашель, серозные истечения из носа, слезотечение. Выявляют также повышенную чувствительность гортани и трахеи, гиперемию слизистой оболочки носовой полости, бронхопневмонию. Большинство животных выздоравливают в течение 1—2 недель.
В тяжелых случаях на 3—4-й день болезни истечения становятся гнойными, слюноотделение более интенсивным, иногда в ротовой полости появляются язвы и эрозии. Животные лежат или стоят с вытянутой вперед шеей, широко расставленными передними конечностями, часто находятся в состоянии прострации, очень угнетены, аппетит у них отсутствует. Прогноз неблагоприятный. Тяжелобольные телята, как правило, погибают.
При подостром течении парагриппа-3 отмечают повышение температуры тела до 40—40,5 °С, учащение пульса и дыхания, депрессию, понижение аппетита. Наблюдаются слизисто-гнойные выделения из носа и глаз. Одышка сопровождается сильным, болезненным кашлем, хрипами. Животные часто дышат через рот. Аускультацией и перкуссией устанавливают пневмонию.
При хроническом течении болезни, которая, как правило, является результатом осложнения парагриппа-3 секундарной (условно-патогенной) микрофлорой, регистрируются признаки пневмонии и высокая летальность.
Диагноз на парагрипп-3 ставят комплексно на основании клинико-эпизоотологических данных, патологоанатомических изменений и лабораторных исследований(см.главу “Инфекционный ринотрахеит”).
Патологоанатомические изменения при парагриппе-3. Патологоанатомические изменения развиваются в основном в верхушечных, сердечных и диафрагмальных долях легких: пораженные участки увеличены в объеме, сине-красного, темно-красного или серого цвета, нередко с зонами эмфиземы по периферии. Интерстициальная соединительная ткань отечна, хорошо видна на разрезе. Бронхиальные, средостенные, реже заглоточные и шейные лимфоузлы увеличены, гиперемированы, иногда с очагами некроза. Отмечают также катаральное воспаление слизистой оболочки носовой полости и трахеи, нежные наложения фибрина на поверхности плевры, эпикарда и перикарда.
Комплекс лабораторных исследований при парагриппе-3такой же, как и при инфекционном ринотрахеите: выявление специфического антигена из биологического материала с использованием иммуноферментного анализа (ИФА) или иммунофлуоресценции (МФА), выделение вируса на культуре клеток и его идентификация в реакциях гемагглютинации (РГА) и торможения гемагглютинации (РТГА), гемадсорбции (РГАдс) и торможения гемадсорбции (РТГАдс), а также ретроспективная диагностика с помощью реакции торможения гемагглютинации (РТГА), непрямой гемагглютинации (РНГА), иммуноферментного анализа (ИФА), нейтрализации (РН).
Аденовирусная инфекция
(Adenoviridae infection)
Определение.Аденовирусная инфекция крупного рогатого скота (аденовирусная пневмония телят, аденовирусный пневмоэнтерит телят) —остро протекающее заболевание молодняка сельскохозяйственных животных, характеризующееся поражением органов дыхания, пищеварения, лимфоидной ткани, конъюнктивитами. Крупный рогатый скот часто является носителем латентных аденовирусов, вызывающих бессимптомные инфекции.
Историческая справка.Впервые аденовирусы у животных, в частности, у свиней выделил и описал в 1950 г. американский ученый Олсен. Аденовирусная инфекция крупного рогатого скота была установлена Клейном в 1959 г. Им же была осуществлена и изоляция вируса. В последующие годы аденовирусная инфекция была установлена у лошадей, овец, птиц. В настоящее время аденовирусная инфекция зарегистрирована во многих странах мира: Италии, Польше, Великобритании, ФРГ, Канаде, Молдове, Беларуси, на Украине и др.
Эпизоотологические данные.В естественных условиях аденовирусной инфекцией чаще заражаются телята в возрасте от 2-недель до 4-мес., а также поросята, ягнята, цыплята, жеребята, щенята собак, лисиц, песцов. Установлена повышенная чувствительность к аденовирусной инфекции у жеребят арабских пород.
Источником возбудителя инфекции являются больные животные, выделяющие вирус с носовыми истечениями и фекалиями. Заражение происходит аэрогенным и алиментарным путями, через конъюнктиву глаз, при непосредственном контакте. Факторами передачи служат загрязненные выделениями больных животных, корм, вода, воздух, подстилка, инвентарь и др.
У взрослых животных аденовирусная инфекция протекает латентно, сопровождаясь длительным вирусоносительством. У молодняка болезнь проявляется спорадически или в виде энзоотических вспышек. У телят и поросят эта болезнь может перейти в опустошительную эпизоотию с острым течением, массовыми пневмониями, высокой летальностью. Отмечены случаи осложнений аденовирусной инфекции микоплазмами, бактериальной микрофлорой и другими вирусами.
Отмечена взаимосвязь течения аденовирусной инфекции крупного рогатого скота с лейкозом. При обследовании коров из неблагополучных по лейкозу хозяйств установлено, что серопозитивные коровы на 100% инфицированы аденовирусами.
Нами проведены исследования по серологическому обследованию различных видов копытных на наличие антител к аденовирусам крупного рогатого скота (табл.10).
Таблица 10
Результаты исследования сывороток крови от различных видов животных на наличие антител к аденовирусам к.р.с.
| Клиническое состояние и возраст | Исследо-вано проб | Положи-тельный результат (%) | Клиническое состояние и возраст | Исследовано проб | Положи-тельный результат (%) | |
| Крупный рогатый скот | Беловежские зубры | |||||
| Коровы, 3—10 лет, клинически здоровые | 71,2 | Самцы, начальная стадия некротического баланопостита 1—10 лет | 33,3 | |||
| Телята, 1—6 мес., больные ОРЗ | 63,4 | Самцы, больные некротическим баланопоститом 1—10 лет | 33,3 | |||
| Телята, 1—6 мес., переболевшие ОРЗ | 74,0 | Самцы, клинически здоровые, старше 10 лет | 20,0 | |||
| Телята, старше 6 мес., клинически здоровые | 48,2 | Самцы, клинически здоровые, 1—7 лет | 28,6 | |||
| Телята до 1 мес., клинически здоровые | 44,0 | Самки, клинически здоровые, старше 10 лет | 30,8 | |||
| Коровы, инфицированные вирусом лейкоза | 100,0 | Самки, клинически здоровые, 1—7 лет | 22,2 | |||
| Благородные олени | Козы | |||||
| Взрослые самки и самцы, 3—8 лет | 34,5 | Самки, клинически здоровые, возраст 2—6 лет | 39,8 | |||
| Овцы | ||||||
| Взрослые овцы в возрасте 1—5 лет | 89,3 | Ягнята, переболевшие ОРЗ | 67,1 |
Результаты исследований свидетельствуют о широкой циркуляции аденовирусов в стадах различных копытных жвачных.
Биологические свойства возбудителя.Возбудителем аденовриусной инфекции является ДНК-геномный вирус, принадлежащий к семейству Adenoviridae, роду Mastadenovirus. Вирусные частицы имеют форму икосаэдра, размер — от 73 до 87 нм, суперкапсида отсутствует. Капсида состоит из 252 капсомеров. Вершинные капсомеры имеют палочковидные отростки длиной от 29 до 80 нм и шириной 2 нм. Константа седиментации — 795 S, плавучая плотность в градиенте плотности хлористого цезия равна 1,34 г/см3. Константа седиментации ДНК аденовирусов равна 30,5—32 S, молекулярная масса 23 миллионов дальтон, плавучая плотность ДНК равна 1,72 г/см3 .
В настоящее время известно 32 типа аденовирусов человека, 25 типов — крупного рогатого скота, 4 типа — овец, по 2 типа аденовирусов собак и мышей, 8 типов кур.
Штаммы аденовирусов крупного рогатого скота 1-го, 2-го и 3-го серотипов имеют общий комплементсвязывающий антиген, отличающийся от антигена типов 4, 5, 6. На основании этих свойств аденовирусы к.р.с. делят на 2 антигенные подгруппы. Аденовирусы первой подгруппы более близки по биологическим свойствам к аденовирусам человека. Отдельные серотипы аденовирусов обладают онкогенными свойствами.
Аденовирусы в зависимости от серотипа вызывают гемагглютинацию эритроцитов белых крыс (1-й и 2-й серотипы), белых мышей (2-й серотип), обезьян.
Культивирование возбудителя.Для культивирования вируса парагриппа-3 крупного рогатого скота успешно используются различные методы культивирования: как первичные и перевиваемые линии клеток различных животных и человека, так и тканевые культуры. Так, из первичных клеток аденовирусы культивируются на: эпителиальных клетках почки теленка, тестикул бычка, овцы, легких эмбрионов коровы, обезьяны, кошки, морской свинки, куриных фибробластах, клетках амниона человека и др. Из перевиваемых — на культуре клеток почек теленка — МДБК, ПТ-80, тестикул бычка — ТБ, почки эмбрионов овцы, хомячка, диплоидных клетках фибробластов человека и т.д. Но на культуре клеток злокачественной опухоли человека Hela аденовриусы крупного рогатого скота не размножаются. Это является их отличительным признаком от аденовирусов человека.
При изучении ЦПД аденовирусов в клеточном монослое отмечают округление клеток, повышение их светопреломляемости, образование внутриядерных включений. Затем клетки постепенно группируются в конгломераты в виде гроздьев винограда. За счет некротизации клеток в монослое образуются “стерильные пятна”. Окрашивание инфицированного монослоя позволяет выявить в клетках базофильные внутриядерные включения.
Патогенез аденовирусной инфекции крупного рогатого скота. Аденовирусы репродуцируются в эпителиальных клетках дыхательных путей, главным образом бронхиол, вызывая их гиперплазию и деструкцию. На месте репродукции вируса отмечают воспалительные явления, кровоизлияния, образование дефектов слизистой оболочки, что способствует проникновению в организм секундарной микрофлоры, которая осложняет течение болезни. В результате переболевания животных в пораженных клетках отмечается гиперплазия, некроз и слущивание эпителия респираторного тракта, гиперплазия лимфоидной ткани, внутриядерные включения в эпителиальных клетках слизистой оболочки верхних дыхательных путей, бронхов, желудка, кишечника, клетках лимфоузлов печени и почек.
Клинические признаки заболевания.Инкубационный период у телят составляет 3—4 суток. Течение болезни у молодняка острое, в более старшем возрасте возможно и хроническое.
У телят устанавливают повышение температуры до 41,5 оС, отказ от корма, вначале серозное, а затем слизисто-гнойное истечение из носа, слезотечение, кашель, затрудненное дыхание и понос. Особенно тяжело болезнь протекает среди телят 15—20-суточного возраста, у которых выявляют понос с примесью крови и слизи, сильное угнетение, дегидратацию организма, гибель 50—60% больных за 1—3 суток болезни. У телят более старшего возраста отмечают кашель, поносы, истощение, отставание в росте и развитии.
Диагноз на аденовирусную инфекцию ставят комплексно на основании клинико-эпизоотологических данных, патологоанатомических изменений и лабораторных исследований(см.главу “Инфекционный ринотрахеит”).
Патологоанатомические изменения при аденовирусной инфекции При вскрытии павших телят устанавливают катарально-геморрагический энтерит, бронхопневмонию, ограниченные ателектазы, эмфизему легких, кровоизлияния на серозных оболочках и в почках.
Комплекс лабораторных исследований при аденовирусной инфекциитакой же, как и при инфекционном ринотрахеите - выявление специфического антигена из биологического материала с использованием иммуноферментного анализа (ИФА) или иммунофлуоресценции (МФА), выделение вируса на культуре клеток и его идентификация в реакциях нейтрализации (РН), гемагглютинации (РГА) и торможения гемагглютинации (РТГА), гемадсорбции (РГАдс) и торможения гемаадсорбции (РТГАдс) с использованием эритроцитов белых крыс и белых мышей, а также ретроспективная диагностика с помощью реакции торможения гемагглютинации (РТГА), непрямой гемагглютинации (РНГА), иммуноферментного анализа (ИФА), нейтрализации (РН), связывания комплемента.
Ротавирусная инфекция крупного рогатого скота
Rotaviridae infection bovinum
Историческая справка. Первое сообщение о выделении ротавирусов при диареи новорожденных телят было сделано в 1969 г. К.Мебусом с соавт., а в бывшем… Эпизоотологические данные.В естественных условиях болеют новорожденные телята… Источник возбудителя инфекции — больные и переболевшие животные, выделяющие вирус во внешнюю среду с экскрементами. В…Коронавирусный энтерит крупного рогатого скота
Koronaviridae infection bovis
Историческая справка. Впервые у телят коронавирус был выделен исследователями Линкольнского университета штата Небраска в США Е.Стар и др. (1972).… Эпизоотологические данные.Болезнь регистрируется у телят 7—18-дневного… Источником возбудителя инфекции являются больные и переболевшие телята, клинически здоровые взрослые…Парвовирусная инфекция крупного рогатого скота
Parvoviridae infection bovis
Историческая справка.Впервые о выделении парвовируса типа 1 крупного рогатого скота сообщил Бэтэс с сотр. в 1959 г. В 1961 г. в Великобритании… Эпизоотологические данные.Возбудители, относящиеся к парвовирусам, поражают… Проведенные исследования по распространению парвовирусов показали, что последние широко распространены среди различных…Диагностические критерии на РРСС
По их данным, совпадение любых двух из трех вышеперечисленных критериев позволяет заподозрить наличие РРСС. Диагностика. Диагноз на репродуктивно-респираторный синдром свиней ставят на… Для выявления антител к РРСС доставляют 2-5 мл сыворотки крови от нескольких свиноматок. В сопроводительной записке…БОЛЕЗНЬ АУЕСКИ
Определение болезни: Болезнь Ауески ( псевдобешенство, зудящая чума, бешеная чесотка, инфекционный бульбарный паралич) - остро протекающая… У взрослых свиней заболевание протекает с поражением органов дыхания, а у молодняка сопровождается расстройством…Цирковирусная инфекция свиней
В настоящее время СПМИ зарегистрирован во всех странах мира, где имеет место развитое свиноводство. Серологические исследования, проведенные в… Возбудитель.Инфекционным агентом СПМИ является мелкий вирус диаметром 17нм,… Впервые цирковирус был описан в 1974 г. как нецитопатический вирусный контаминант перевиваемой культуры клеток РК-15…БАКТЕРИАЛЬНЫЕ ИНФЕКЦИИ СЕЛЬСКОХОЗЯЙСТВЕННЫХ ЖИВОТНЫХ
БАКТЕРИАЛЬНЫЕ ИНФЕКЦИИ крупного рогатого скота
М И К О Б А К Т Е Р И О З Ы
Микобактериозы- болезни или скрытые инфекции, вызываемые микобактериями. Микобактерии вызывают туберкулез, лепру и некоторые другие хронические… Род Муcobacterium относится к семейству Mycobacteriacae, порядку… Для микобактерий характерно высокое содержание липидов, воска и миколовых кислот /Т.В Каронелли,1984/. В определителе…КРАТКАЯ ХАРАКТЕРИСТИКА ПРЕДСТАВИТЕЛЕЙ
РОДА MUCOBACTERIUM
M. bovis - патогенен для крупного рогатого скота, свиней, кроликов, морских свинок, белых мышей, коз, овец, лошадей, дики животных. У человека чаще… M. africanum- занимает промежуточное положение между М. tuberculosis и M.… M. leprae - возбудитель проказа человека. Не растет на искусственных питательных средах, однако хорошо размножается в…ТУБЕРКУЛЕЗ
Возбудители болезни. Туберкулез у млекопитающих вызывают микобактерии комплекса M.tuberculosis, M.bovis, M.africanum, у птиц - M.avium. Возбудитель… Как уже отмечалось ранее M.tuberculosis - возбудитель туберкулеза человека, но… Морфология и тинкториальные свойства. Возбудители туберкулеза имеют обычно форму тонких палочек, иногда прямых, но…Сокращенная схема дифференциации микобактерий с использованием биопробы
| Полученная культура |


| Пигментная (I, II, IVгруппы) | Беспигментная (бычий, человечий, птичий вид, микобактерии III и IV групп) |



| А) Посев на агаровую среду (МПА): I, II, III – не растут IV – все растут Б) Рост при 45 ºС: I, II – не растут III, IV - растут В) Образование пигмента под воздействием света: - I группа Г) Образование пигмента в темноте – II группа | Биопроба | |
| Кролик | Морская свинка | Вид (Группа) |
| + - + - | + + - - | Бычий Человеческий Птичий III группа атипичные микобактерии |
Примечание: + - наличие вирулентности к данному виду животного
(вызывает заболевание и гибель животных)
- - отсутствие вирулентности (не вызывает гибели и
заметных изменений в органах)
Биологический способ (биопроба). В большинстве районных ветеринарных лабораториях специалисты основное внимание уделяют биологической пробе с патматериалом от животных. Причем именно на этот метод возлагаются их основные надежды в диагностике туберкулеза, не уделяя должного внимания культуральному методу. Биопроба на морских свинках дает положительные результаты при наличии в инъецируемом материале 5 микобактерий туберкулеза.
После посева взвеси материала на питательные среды проверяют рН среды, при необходимости доводят ее до нейтральной и заражают 2-х морских свинок подкожно в области паха в объеме 1-2 см3 в зависимости от их общего состояния, веса (300,0 – 350,0), времени года и т.д. Срок наблюдения за инфицированными животными 3 месяца. Допускается объединение материала при биопробе от 2-х животных одной фермы.
Срок биопробы с материалом, а следовательно бактериологического исследования, может быть сокращен при положительном исходе. Так, в случае если хотя бы у одной их морских свинок, реагировавших на туберкулин через 30-45 дней (или павших до окончания срока биопробы) обнаружены туберкулезные поражения, подтвержденные микроскопией мазков из органов (печень, селезенка, почки, легкие), диагноз считается установленным. Вторую морскую свинку убивают, аналогично проводят дополнительно осмотр и микроскопическое исследование внутренних органов. Дальнейшие исследования не проводят. Срочно сообщают об этом хозяйству и высылают заключение.
Положительные результаты биопробы с материалом от животных свидетельствуют о наличии в исследуемом материале микобактерий туберкулеза бычьего или человечьего видов. Поэтому целесообразно биопробу ставить одновременно на 2 морских свинках и 2 кроликах весом 2,0-2,5 кг (заражают 1-2 см3 взвеси материала внутривенно в краевую вену уха), что позволяет сразу определить вид возбудителя туберкулеза, вызвавшего гибель определенного вида лабораторных животных.
Биопроба с культурой или определение видовой принадлежности выделенной культуры микобактерий проводят на 2 морских свинках и 2 кроликах, заражая их взвесью выделенной культуры в дозе 1 мг (обычно в объеме 1 см). Интерпретируют результаты биопробы аналогично. При необходимости заражают еще и 2-х кур, гибель которых вызывает только возбудитель туберкулеза птичьего вида. Критерии оценки результатов биопробы представлены в ранее приведенной схеме. При заражении лабораторных животных материалом, в котором находятся атипичные микобактерии, они остаются живы в течение 3-х месяцев (срок биопробы) и даже набирают в весе.
Исходя из выше изложенного, бактериологическая диагностика туберкулеза хотя и является в настоящее время обязательной, но имеет ряд существенных недостатков. Во-первых - это посмертная диагностика и ее результаты чаще всего касаются только группы убитых животных. Во-вторых, исследования растягиваются до 3 месяцев. В-третьих, используемые в настоящее время бактериологические методы исследования не позволяют выявить Л-формы возбудителя. Все это снижает ценность данного метода и заставляет искать более быстрые методы диагностики туберкулеза.
Кратность и порядок бактериологических исследований. Если на ферме (в стаде) выделилось до 10 реагирующих на туберкулин животных, то их подвергают контрольному диагностическому убою. При условии выделения более 10-и реагировавших животных убою подвергают 5 голов с наиболее выраженными реакциями по аллергии (можно и по серологии). Если при убое хотя бы у одного из реагировавших на туберкулин животных обнаружены изменения, характерные для туберкулеза, диагноз по данной ферме (стаду) считается установленным. Накладывается карантин и проводится оздоровление хозяйства от заболевания.
При не четко выраженных изменениях отбирают материал для лабораторного исследования с целью подтверждения диагноза. В данном случае, как уже отмечалось выше, положительное заключение микроскопического или гистологического исследования по подтверждению этиологии этих изменений, т.е. что они туберкулезной природы, имеет юридическую силу. Диагноз установлен, причем это проводится в более краткие сроки, выигрывается время:
- Бактериоскопическое исследование мазков-отпечатков из пораженных органов или лимфатических узлов – 1-2 дня.
- Гистологическое исследование – в течение 5-7 дней.
- Бактериологическое исследование (при отрицательных результатах бактериоскопического и гистологического исследований) – в сроки до 3 месяцев.
Особенно тщательно необходимо проводить экспертизу гранулематозных поражений, обнаруживаемых только в брыжеечных лимфатических узлах, так как они в большинстве случаев бывают обусловлены другими микроорганизмами (плесени, кандиды, нокардии), паразитами и т.д. В чистом виде «кишечная форма» туберкулеза на практике встречается крайне редко. Поэтому изменения, обнаруженные только в брыжеечных лимфоузлах необходимо подтверждать лабораторными исследованиями этого материала.
Если при проведении контрольного убоя с диагностической целью изменения у животных отсутствуют, то обязательно отбирают материал для лабораторного исследования от каждой туши животного отдельно по утвержденной схеме, упаковывают, этикетируют и доставляют в районную (или другие) лабораторию.
Если же у реагировавших животных при проведении вторичного контрольного убоя туберкулезные изменения отсутствуют, а в лаборатории получены предварительные положительные результаты бактериологического исследования материала от ранее убитых животных данной фермы (т.е. через 45-50 дней уже может быть получен рост колоний микобактерий на питательной среде), то отбирать во второй раз материал для бактериологического исследования не обязательно. И наоборот, если предварительного положительного результата по лабораторному исследованию ране взятого материала нет, то опять отбирают материал для повторного бактериологического исследования.
Очередные аллергические исследования скота на данной ферме проводят через 3 мес., симультанной пробой с применением туберкулина для млекопитающих и КАМ (или для птиц), применяют другие методы дифференциальной диагностики туберкулеза.
На основании результатов аллергических, патологоанатомических и бактериологических исследований с учетом клинических и эпизоотических данных устанавливают дифференцированный диагноз.
Профилактика туберкулеза. Основа профилактики туберкулеза – недопущение заноса инфекции в стадо. Молочно-товарные фермы должны быть огорожены и снабжены на входе дезобарьерами и дезоподушками. Комплектация стад должна осуществляться здоровыми животными из длительно благополучных стад и только после прохождения карантина под контролем ветеринарной службы.
Поголовье молочно-товарных ферм должно быть пронумеровано и учтено.
В пастбищный период целесообразно содержать животных в летних лагерях, а в животноводческих помещениях проводить санитарный ремонт и дезинфекцию.
При обнаружении больных животных на стадо решением райисполкома накладывают карантин. Ликвидацию болезни ведут по утвержденному плану оздоровления, за выполнение которого несет ответственность руководитель и зооветспециалисты хозяйства.
Если реагирующих животных обнаруживают в личном пользовании у граждан, на двор (ферму) накладывают ограничения (запрещают общий выпас, водопой, реализацию молочных продуктов). Молоко от таких животных необходимо пастеризовать или кипятить.
Оздоровление стад от туберкулеза. Наиболее эффективным способом оздоровления от туберкулеза является одновременная и полная сдача на убой неблагополучного стада.
При поражении туберкулезом менее 25% поголовья оздоровление проводят путем систематических исследований, изоляции и сдачи на убой реагирующих на туберкулин животных.
В обязательном порядке проводят организационно-хозяйственные мероприятия:
- дезинфекция помещений (после удаления реагирующих животных);
- благоустройство прифермской территории (уборка навоза, замена грунта, планировка, организация биотермического обеззараживания навоза и выдерживание его в буртах не менее 2 лет);
- организация пастеризации молока (при режимах нагрева до 850С в течении 30 мин или 900С 5 мин.);
- изолированное выращивание молодняка и подготовка нетелей для замены стада;
-улучшение кормления и условий содержания животных;
- текущий и капитальный ремонт помещений, строительство профилакториев, родильных отделений, навозохранилищ, летних лагерей;
Дезинфекция при туберкулезе. Для повышения эффективности дезинфекции важно провести тщательную механическую очистку поверхностей.
Дезинфекцию проводят горячим 3% раствором формальдегида в 3% каустической соде.
Эффективно убивает возбудитель туберкулеза малотоксичный дезинфектант Белстерил (0,4%), представляющий раствор надуксусной кислоты.
Использование новых нетоксичных дезинфектантов: Витана (3%), Комбинированного дезинфектанта поверхностей (2%), Дезавита П (3%), Демоса (3%), обладающих хорошими моющими свойствами, позволяет одновременно проводить механическую очистку и дезинфекцию поверхностей.
Дезинфектанты наносят на поверхности из расчета 0,75-1 л /м2 и выдерживают, как минимум 2ч. После применения малотоксичных дезинфектантов мойку поверхностей можно не проводить.
Меры личной профилактики. К работе на животноводческих фермах допускаются здоровые лица, после медицинского обследования. Ежегодно животноводы обязаны проходить флюорографию, а при необходимости и другие методы диагностики.
Животноводы должны быть обеспечены спецодежой и местами ее хранения.
Руководству хозяйств необходимо принимать меры для обеспечения персонала моющими и дезинфицирующими средствами, аптечками первой помощи, полотенцами.
ХЛАМИДИОЗ КРУПНОГО РОГАТОГО СКОТА
(Clamidiosis bovinum)
Определение. Хламидиоз крупного рогатого скота - инфекционная болезнь, протекающая хронически и характеризуется поражением околоплодных оболочек, в результате чего наступают аборты, преждевременное рождение мертвых или нежизнеспособных телят. У телят хламидиоз протекает с поражением респираторных путей, желудочно-кишечного тракта, суставов и глаз.
Возбудитель заболевания. Возбудителем хламидиоза крупного рогатого скота является Cl.psittaci, который представляет собой элементарные тельца округлой формы диаметром 250-350 нм. Хламидии развиваются в цитоплазматических включениях и проходят ряд переходных форм, различных по организации и зрелости. Цитоплазматические включения представляют собой как бы колонию хламидий, состоящую из незрелых, а в конце из зрелых форм или элементарных телец. Хламидии содержат ДНК и РНК, около 40% липидов, 35% белка, соляную и фолиевую кислоты имеют несколько автономных ферментных систем. В хламидиях найдены от 17 до 20 полипептидов с молекулярной массой от 29 000 до 120 000 Д.
Хламидии являются абсолютными паразитами, т.е. для их репродукции необходима живая клетка.
Антигенные свойства. Хламидии имеют групповой термостабильный комплементсвязывающий антиген, который имеется у возбудителей, выделенных после переболевания орнитозом, энзоотическим абортом овец, пневмонией и энтеритом крупного рогатого скота, энзоотической пневмонией свиней и коз. Поэтому, учитывая антигенное родство возбудителей хламидиоза у различных видов животных при проведении диагностических исследований на хламидиоз у крупного рогатого скота широко используются диагностические наборы для диагностики хламиоза овец и коз, а для профилактики хламидиоза крупного рогатого скота можно использовать гические препараты вакцины, которые применяются для профилактики хламидиоза овец и коз.
Спектр патогенности хламидий. В естественных условиях хламидии поражают крупный рогатый скот, овец, коз, человека, обезьян, птиц, белых мышей.
Распространение. Болезнь широко распространена практически во всех странах мира. В Республике Беларусь при исследовании сывороток крови телят и коров, переболевших респираторными и желудочно-кишечными заболевания в РСК или РДСК антитела выявляются от 10 до 60% у животных.
Клинические проявления хламидиоза. Отмечают 5 основных клинических проявлений:
- Абортивная форма. При этом болезнь сопровождается абортами на 4-9 месяце стельности. Абортированные плоды часто бывают желтого цвета. Ус коров отмечают повышенную температуру тела до 40,5оС, задержку последа, затем - эндометрит, цервицит, вагинит с кровоизлияниями на слизистой оболочке;
-Респираторная форма. Болезнь начинается внезапно с повышения температуры до 40,0-40,5оС, наблюдают диарею, серозно-слизистое истечение из носа, слезотечение, кашель, хрипы. В крови устанавливают лейкопению. У хронически больных животных - плеврит. На вскрытии - дольки легких темно-красного цвета, плотной консистенции и резко отграничены от соседних участков разросшейся соединительной ткани. У хронически больных телят - изменены все легкие. Селезенка и лимфоузлы увеличены, бронхиальные лимфоузлы достигают куриного яйца;
-Энтеральная форма. Возникает у телят с 1-2-го дня после рождения. Источник заражения - инфицированные коровы. Понос продолжается 3-5 дней, трудно поддается лечению. На вскрытии - желеобразные сгустки в брыжейке, воспаление лимфоузлов, катарально-геморрагический энтерит.
-Суставная форма. Поражаются суставы с образованием свищей и выделением гнойного экссудата;
-Глазная форма. В начале заболевания отмечают слезотечение, переходящее в гнойный конъюнктивит. Затем на пораженных глазах образуется бельмо и в конце - разрыв глазного яблока.
Диагноз на хламидиоз ставится комплексно с учетом клинико-эпизоотологических данных, патологоанатомических изменений, серологического исследования, хламидиевыделения и микроскопии мазков-отпечатков из пораженных органов и тканей.
Для проведения серологического обследования используются парные пробы сывороток крови, взятые через 14-21 день Антитела устанавливают с помощью РСК или РДСК. При наличии положительных проб (при титре 1:10) проводят раститровку до 1:320.
Для проведения хламидиевыделения используется культура клеток Мак-Кой, Vero, куриные эмбрионы и мышата весом 12-15 г. Для этого используется транспортная среда и заражение культуры проводится не позднее 24 часов после взятия патологического материала от животных.
Для обнаружения частиц-включений, характерных для хламидиоза берут мазки-отпечатки из пораженных органов и тканей (легких, глаз, печени, кишечника, суставов) и окрашивают по Романовскому-Гимзе, Стемпу, Маккиавело, а также флуоресцирующими антителами.
Диагноз можно считать установленным при наличии четырех и более кратного увеличения антител с одновременным хламидиевыделением или наличием частиц-включений; при установлении высокого уровня антител (свыше 1:160) с одновременным наличием клинических признаков заболевания; при хламидиевыделении из патматериала от больных животных.
Терапия при хламидиозе. Наиболее эффективными средствами являются: азитромицин (суммамед) одно - или двукратный прием по 1 г препарата внутрь (эффективность в медицинской практике достигает 98%); доксициллин внутрь в течение 1 недели; эритромицин (в течение 7-10 дней); антибиотики тетрациклинового ряда - гемицин-ретард, эгоцин, окситетрациклин, рифациклин, а также препараты энрофлоксацинового ряда (энрофлоксацин, энрозол и т.д.).
Колибактериоз телят
Определение.Колибактериоз - острая инфекционная болезнь телят, характеризующаяся профузным поносом, признаками тяжелой интоксикации и обезвоживанием организма. Заболевание распространено во многих странах мира.
Эпизоотологические данные. Колибактериозом болеют телята в возрасте до 10 дней. Заболеваемость достигает 40-75%, а летальность заболевших телят - до 100%. Основной источник возбудителя - больной молодняк, переболевшие колибактериозом животные и взрослые, носители патогенных эшерихий. Возбудитель во внешнюю среду из организма животных выделяется с фекалиями, иногда с мочой. Контаминированное возбудителем молозиво, питьевая вода, подстилка и предметы ухода за животными служат факторами передачи инфекции. Резервуаром и механическими переносчиками возбудителя являются грызуны и птицы. Путь заражения - алиментарный, реже аэрогенный, не исключается и внутриутробный.
Биологические свойства возбудителя. Возбудителем колибактериоза является кишечная палочка -E.coli. E.coli входит в микробиоценоз организма, является постоянным обитателем толстого кишечника, обладает широкой вариабельностью культурально-морфологических, биохимических, патогенных и других свойств. Живые микроорганизмы этого вида - прямые палочки размером 1,1-1,5-2-6 мкм, высушенные и окрашенные бактерии уменьшаются, их размеры равны 0,4-0,7-1-3 мкм. По Грамму окрашиваются отрицательно (10, 13, 28).
При t=600С эшерихии погибают за 15 минут, при t=1000С –мгновенно. Карболовая кислота, едкий натр, формалин, креолин, хлорная известь и другие дезинфицирующие вещества убивают их в течение 15-20 минут. Резистентность к применяемым антибиотикам у изолированных штаммов E.coli достигает 70-100%.
Возбудитель эшерихиоза отличается от симбионтных клонов E.coli антигенной структурой, токсигенностью и инвазивными свойствами
Патогенез.Пусковым механизмом инфекционного процесса является адгезия потогенных микроорганизмов на специфических рецепторах мембран хозяина. Возбудитель колибактериоза прикрепляется к эпителиальным клеткам тонкой кишки с помошью ворсинок (фимбрий, пили, адгезинов). Прилипшие бактерии размножаются, колонизируя слизистую оболочку. Возбудитель колибактериоза телят обладает пили К99 и F41.
Термостабильный эндотоксин (ТСЭ) измененияет активность гуанилатциклазы и усиливает ход жидкости в просвете тонкой кишки, он способен также нарушать ритм кишечной перистальтики.
Термолабильный эндотоксин (ТЛЭ) имеет специфические рецепторные зоны на слизистой оболочке кишечника новорожденных.
Эндотоксины являются сильными пирогенами и токсинами, вызывают феномен Шварцмана, приводят к изменениям в картине крови (лейкопения, лейкоцитоз) вызывают изменения кровяного давления, обладают адъювантной активностью, являются митогенами В-лимфоцитов, активизируют макрофаги и связывают комплемент, индуцируют синтез простогландинов и интерферона.
Возбудитель колибактериоза имеет сложную антигенную структуру. В основе бактериальной клетки различают соматический О-антиген, поверхностный К-антиген, жгутиковый Н-антиген. Некоторые штаммы Е.соli образуют значительное количество слизистого вещества, называемого М-антигеном.
Клинические признаки. Инкубационный период длится от нескольких часов до нескольких дней. Колибактериоз телят протекает в форме колисепсиса и колидиареи.
Колисепсис протекает сверхостро и остро. Сверхострое течение наблюдается у телят в возрасте до 3-х дней. Температура повышается до 40,5-41°С, учащаются пульс и дыхание, нарастает слабость. Через 1-2 дня он погибает.
При остром течении поражаются телята 3-7 дневного возраста. У больных регистрируют кратковременное повышение температуры тела, диарею. Фекалии жидкие, беловато-серого цвета, с примесью слизи, сгустков казеина, пузырьков газа, иногда крови. У телят нарастает общее угнетение в виде адинамии, залеживания, снижения реакции на внешние раздражители; усиливается жажда, отмечается тахикардия. В результате обезвоживания глазные яблоки западают. Телята погибают на 3-5 день болезни.
Подострое течение болезни отмечается в возрасте 6-10 дней. Преимущественно оно наблюдается при длительных энзоотиях в неблагополучных хозяйствах. В виде осложнений могут появляться пневмонии.
При колидиарее вследствие обезвоживания и обессоливания расстраивается сердечная деятальность, падает кровяное давление, наблюдаются судороги отдельных групп мышц туловища и конечностей, прекращается выделение мочи. Без лечения животное погибает в течение 24-48 часов.
Патологоанатомические изменения при колибактериозе зависят от течения болезни и ее формы.
При остром течении септической формы болезни регистрируют признаки катарального или геморрагического воспаления сычуга, толстого и тонкого кишечника. Содержимое сычуга – сгустки казеина. Мезентериальные лимфатические узлы отечны, гиперемированы и, часто, с кровоизлияниями. Под эпикардом, на эндокарде, брюшине часто находят кровоизлияния. Печень перерождена (жировая или зернистая дистрофия). Мочевой пузырь в состоянии геморрагического воспаления. Изменения селезенки зависят от продолжительности болезни – в одних случаях она не изменена, в других – незначительно увеличена и полнокровна.
Для септической формы характерно инфицирование сосудов головного мозга с кровоизлияниями, возможно скопление гнойного экссудата или розоватой жидкости в желудочках мозга.
При хронических процессах трупы истощены, слизистые оболочки синюшны.
В процессе диагностики колибактериоза используют широкий диапазон эпизоотологических, клинических, а также патологоанатомических данных.
Диагноз.Ведущее значение при установлении диагноза на колибактериоз отводится лабораторной диагностике, которая включает микроскопические, бактериологические, биологические и серологические методы.
Микроскопический метод основан на приготовлении препаратов-отпечатков из исходного материала и мазков из выделенной чистой культуры. Препараты окрашивают по Грамму с целью изучения морфологии, подвижность определяют в препарате (висячая капля)
Диагноз на колибактериоз считается установленным в следующих случаях:
n при выделении чистых культур эшерихий не менее, чем из 2-х нижеуказанных органов и тканей: селезенки, крови, сердца, костного мозга, головного мозга свежего трупа животного, без определения их патогенности для белых мышей или цыплят и установления серогрупповой принадлежности;
n при выделении из исследуемого материала культур эшерихий с одним или двумя и более типами адгезивных антигенов.
n при выделении из исследуемого материала культур эшерихий, относящихся к патогенным серогруппам и патогенных для белых мышей и цыплят;
Необходимо дифференцировать колибактериоз от вирусных энтеритов, сальмонеллеза, респираторной инфекции, пастереллеза, отравлений путем проведения бактериологических и вирусологических исследований.
Лечениеколибактериоза телят должно быть комплексным и сочетать в себе методы этиотропной, патогенетической, заместительной и симптоматической терапии. Обязательно применение диетотерапии.
В качестве этиотропной терапии при колибактериозе применяют антибиотики, сульфаниламидные препараты, нитрофураны, фторхинолоны, а также комбинированные противомикробные препараты, состоящие из антибиотиков, сульфаниламидов, иммуностимуляторов, витаминов и т.д. Например, использование уже в течение 5 дней в максимальных дозах неомицина, ампициллина и препаратов тетрациклинового ряда значительно ускоряет патологические процессы в пищеварительном тракте.
При энтеритах, в этиологии которых присутствуют Salmonella Dublin и E.coli, применяют бактериофаг против эшерихиоза (колибактериоза) телят и Коли-Гертнер ФАГ против паратифа и колибактериоза телят.
После завершения лечения антибактериальными препаратами рекомендуют нормализовать состав кишечной микрофлоры путем применения пробиотиков – энтеробифидина, бактерина-SL, бализа-2, бифидумбактерина.
Патогенетческая терапия включает в себя устранение дегидратации, интоксикации, а также восстановление функций желудочно-кишечного тракта.
В основе регидратации при лечении больных телят должен быть положен один принцип полного соответствия вводимой им инфузионной жидкости как по объему, так и по составу развившимся водно-электролитным потерям организма. Должна быть соблюдена изотония, изоиония и изогидрия. В начале болезни и при ее легком течении рекомендуют изотонические растворы, а при тяжелом течении – парэнтерально-гипотонические с обязательным включением ионов натрия, хлора и бикарбоната.
Если у больного теленка выражен сосательный рефлекс, водно-электролитные растворы можно задавать внутрь. Для перорального применения рекомендуют раствор Дальтона, ветглюкосолан, изотонические растворы глюкозы и натрия хлорида, 1-2% растворы натрия гидрокарбоната, глюкозо-спиртовые растворы, а также спиртовые растворы, содержащие отвары лекарственных трав (полыни, тысячелистника, крапивы, коры дуба) и др. Для парентерального введения применяют изотонические растворы натрия бикарбоната, глюкозы, натрия хлорида, раствор Рингер-Локка, раствор Филипса, регидрольтан, гипертон, растворы по прописи Шарабрина, ЛЕРСа, этровитан, серогидролизин, и другие, а также плазмозаменители: гемодез, полиглюкин и др.
Висцеральную новокаиновую блокаду (по К. Герову) или надплевральную новокаиновую блокаду чревных нервов и пограничных симпатических стволов (по В. В. Мосину) также используют как средства патогенетической терапии.
Для более быстрого заживления воспаленной слизистой кишечника назначают вяжущие средства: танин, танальбин, теальбин, кору дуба. корневище змеевика, кровохлебки, лапчатки, лист шалфея, траву зверобоя и цветки ромашки, тысячелистник обыкновенный и конский щавель.
Для предохранения нервных рецепторов кишечника от раздражения применяют слизистые отвары, приготовленные из крахмала, овсяной муки, риса, ячменя и семян льна.
В качестве заместительной терапии применяют натуральный желудочный сок, пепсин, трипсин, химопсин, панкреатин, ренин, кутикулин и другие ферментные препараты.
Так как при энтеритах у телят нарушаются обменные процессы и всасывание витаминов через слизистую оболочку кишечника, рекомендуют применение витаминов В12, В1, А, Д2, рутина, витамина С, а также комплексных витаминных препаратов.
Симптоматически применяют сердечные (кордиамин, камфарное масло, сульфокамфокаин и др.), антигистаминные (димедрол), болеутоляющие (анальгин) и спазмолитические (но-шпа, папаверина гидрохлорид) средства.
Сальмонеллез телят
Определение.Сальмонеллез – инфекционная болезнь, характеризующаяся расстройством функции кишечника, явлениями бактеремии, токсемии, абортами или рождением нежизнеспособного молодняка.
Эпизоотологические данные.Остро протекающий сальмонеллез чаще встречается у телят старше 10-15 дней. Источник возбудителя – больные и переболевшие животные (бактерионосители), выделяющие сальмонелл с фекалиями, мочой, истечениями из носа, а взрослые животные – с молоком и плодными оболочками, околоплодными водами, истечениями из родовых путей при аборте.
Заражение происходит чаще алиментарно – при выпойке молока, обрата, воды, контаминированных сальмонеллами. Эпизоотический процесс протекает неравномерно, периодически затухая. Но при введении в неблагополучное стадо здорового молодняка вспышки болезни повторяются вновь. Антисанитарные условия содержания, неудовлетворительное кормление понижают резистетность молодняка и способствуют возникновению, распространению и более тяжелому течению сальмонеллезов
Биологические свойства возбудителя. У телят сальмонеллез вызывает Salmonella Dublin, это небольшие (2-3мкм) аэробные, неспорообразующие, грамотрицательные, подвижные палочки. Во внешней среде устойчивы. Месяцами сохраняются в почве, воде, выдерживают нагревание при 70-75°С в течение 15-30 минут. Лучшие дезинфицирующие средства – 3-4% горячий раствор едкого натра, 5% эмульсия ксилонафта, 2% раствор формальдегида, 20% взвесь свежегашеной извести, осветленный раствор хлорной извести, содержащий не менее 2% активного хлора.
Патогенез.Размножаясь в кишечнике, сальмонеллы вызывают воспаление слизистой оболочки, (результат действия эндотоксина), проникают в лимфу и кровь, обусловливая септицемию, сопровождающуюся высокой температурой, угнетением животного. При хроническом течении болезни у молодняка развиваются бронхопневмонии, артриты.
Клинические признаки.У телят сальмонеллез протекает остро и хронически, иногда атипично. При остром течении болезни после инкубационного периода, составляющего 5-8 суток, начинается лихорадка, учащаются пульс и дыхание. Животные малоподвижны, аппетит отсутствует. Часто развиваются серозный ринит и конъюнктивит. На 2-3 день появляется основной клинический признак – диарея. Кал жидкий, с примесью слизи, а нередко и крови.
При хроническом течении сальмонеллеза признаки поражения органов пищеварения ослабевают, появляется аппетит, но нарастают симптомы поражения дыхания, развивается бронхопневмония. Течение хронического сальмонеллеза длительное – недели и месяцы. Атипичная форма болезни бывает у телят более старшего возраста и характеризуется кратковременной лихорадкой и поносом, который прекращается через 1-2 дня.
При остром сальмонеллезе у телят резко увеличена селезенка, несколко увеличена печень. Под эпи-и эндокардом, под капсулой селезенки, почек, на слизистой оболочке мочевого пузыря находят кровоизлияния. Слизистая оболочка сычуга и тонких кишок набухшая, гиперемирована, покрыта слизью, с кровоизлияниями. Легкие увеличены, местами уплотнены, с кровоизлияниями под плеврой.
Патологоанатомические признаки.У телят, павших от хронического сальмонеллеза в кишечнике обнаруживают очаги фибринозно-дифтеритического воспаления. Выражены изменения легких: ткань их уплотнена, вишнево-красного или серо-красного цвета, очаги пневмонии локализованы в передних и средних долях. У телят, павших от хронического сальмонеллеза, в кишечнике обнаруживают очаги фибринозно-дифтеритического воспаления. Выражены изменения легких: ткань их уплотнена, вишнево-красного или серо-красного цвета, очаги пневмонии локализованы в передних и средних долях..
Диагноз ставят на основании клинико-эпизоотологических, патолого-анатомических данных и результатов бактериологического, микроскопического, серологического, а при необходимости, и биологического исследования.
Лечениесальмонеллеза телят - аналогично, как и при колибактериозе.
Трихофитоз (стригущий лишай) крупного рогатого скота (Trichophytosis)
Определение.Контагиозная грибковая болезнь домашних животных, характеризующаяся образованием на коже округлых, резко ограниченных пятен с обломанными у основания волосами или экссудативным дерматитом и гнойным фолликулитом с толстой отрубъевидной коркой на поверхности пораженного участка. Болеет им и человек.
Заболевания, вызываемые патогенными грибками, известны с давних времен. Однако возбудитель трихофитоза был описан только в 1845 г. шведским ученым Малмстеном. В настоящее время трихофитоз крупного рогатого скота зарегистрирован в 113 странах Европы, Азии, Африки, Америки и причиняет огромный ущерб животноводству. Встречается в нашей стране.
Значительный вклад в разработку специфических средств борьбы с болезнью внесли советские ученые А. X. Саркисов, В. В. Петрович, Л. И. Никифоров, Л. М. Яблочник, предложившие первую в мировой практике противогрибковую вакцину ТФ-130.
Этиология. Возбудителями трихофитоза являются патогенные грибки из рода Trichophyton: у парнокопытных — Tr. verrucosum; у лошадей — Tr. equinum; у свиней, пушных зверей, кошек, собак, грызунов, реже у лошадей и крупного рогатого скота —Tr. mentagrophytes, gypseum; у верблюдов — Tr. sarcisovii Ivan, et Pol. В препаратах из пораженных волос и чешуек кожи при увеличении в 400 — 500 раз все перечисленные грибки обнаруживаются в виде тонких ветвящихся нитей, располагающихся рядами по длине волоса (вегетативная форма), и цепочек из круглых или овальных спор диаметром 3—8 мкм, локализующихся внутри и снаружи волоса в виде чехла. Грибки выращивают при 22—28°С на среде Сабуро, сусло-агаре, агаре Лит-мана (рН 6,5—6,8), где они на 5—30-й день образуют погруженные в среду, покрытые пушистыми ворсинками круглые, плотные колонии.
Из лабораторных животных к трихофитозу восприимчивы морские свинки и кролики.
Грибки, вызывающие заболевания у различных видов животных, отличаются друг от друга по величине и характеру роста на питательных средах.
Tr. verrucosum — грибы диаметром 5—8 мкм; колонии бело-серого цвета, появляющиеся на 15—20-й день после посева, имеют складчатый или бугристый вид, возвышенные или плоские, с ровными или паутинистыми краями. Мицелий ветвящийся, микроконидии овальные или грушевидные, размером 1—3X2—8 мкм. Макроконидии удлиненные, размером 3,5—8X20—50 мкм. Артоспоры округлой формы, диаметром 3,5—8 мкм.
Tr. eguinum — грибы диаметром 6—7 мкм; колонии белые, бархатистые, плоские, гладкие или бороздчатые, с ровными краями; появляются на 14—16-й день посева. Микроконидии овальные или грушевидные, размером 1—3x3—7 мкм; макроконидии булавовидные, септирован-ные, размером 3—7X15—45 мкм. Артроспоры отсутствуют.
Tr. mentagrophytes — грибы диаметром 3—5 мкм; колонии белые, кремовые, темно-желтые, бархатистые, гладкие или складчатые; появляются на 5—б-й день после посева. Микроконидии округлые или овальные, диаметром 2—4 мкм; макроконидии булавовидной формы, размером 5—10X30—50 мкм. Артроспоры (Отсутствуют.
Tr. sarcisovii Ivan et Pol — грибы диаметром 6—7 мкм; колонии появляются на 15—30-й день после посева; кремовые, бархатистые, плоские, ровные или бугристые, издают специфический запах. Микроконидии округлые или овальные, размером 2,5—5X3—8,5 мкм; макроконидии оваль-«ые, удлиненные, септированные, размером 4—6,5x14—35 мкм. Артроспоры округлые, диаметром 8—12 мкм.
Возбудители трихофитоза чрезвычайно устойчивы во внешней среде. В пораженных волосах сохраняются 4—7 лет, в патологическом материале—1,5 года. В инфицированных помещениях, предметах ухода за животными, кормах остаются жизнеспособными 4—8 лет, навозе и навозной жиже — 3—8 мес, почве — 3—4 мес. Устойчивы к замораживанию, высушиванию, воздействию прямых солнечных лучей. При кипячении инактивируются через 2 мин, при температуре 80°С— 7—10 мин. Под действием сухого жара при 110°С гибнут через 1 ч, при 80°С — через 2 ч.
Разрушаются щелочами .(1—3%-ный раствор), формальдегидом (1—3%-ный раствор), серо-карболовой смесью (5%-ный раствор) за 15—30 мин.
Диагноз устанавливают на основании клинических признаков заболевания, результатов лабораторных исследований патологического материала, а также эпизоотологических данных.
Эпизоотологические данные. Стригущий лишай чаще поражает крупный рогатый скот, лошадей, плотоядных, реже — мелкий рогатый скот, грызунов, свиней. Более чувствителен к заражению молодняк. Источником возбудителя болезни являются больные и переболевшие животные, а также мышевидные грызуны, суслики, которые выделяют возбудитель во внешнюю среду с чешуйками, корочками, волосами с пораженных участков кожи. Заражение здоровых животных происходит при непосредственном соприкосновении с больными, а также через контаминированные грибками предметы окружающей среды, одежду и руки обслуживающего персонала. Споры грибка могут переноситься по воздуху. Распространению болезни способствуют зоогигиенические нарушения в содержании -животных, несвоевременное лечение, отсутствие должного ухода за кожей. Заболевание пушных зверей может появиться после скармливания боенских отходов от больных трихофитозом животных. От больных животных могут заражаться люди.
Трихофитоз регистрируют в любое время года, но чаще в зимне-весенний период на фоне снижения резистен-тности организма, а также при смешивании во время перегруппировок здоровых животных с переболевшими. Заболевание проявляется в виде спорадических случаев или энзоотии; в хозяйствах промышленного типа может охватить большое количество животных.
Течение и симптомы болезни. Инкубационный период продолжается 6—30 дн. Течение болезни в большинстве случаев доброкачественное.
У крупного рогатого скота кожа поражается в области головы и шеи, реже — на боковой поверхности грудной клетки, спине и ягодицах. Различают поверхностную, глубокую (фолликулярную) и атипичную формы болезни.
Поверхностную форму наблюдают у взрослого скота. Заболевание характеризуется появлением на коже маленьких, величиной с горошину, узелков, на месте которых образуются резко очерченные, постепенно увеличивающиеся пятна, покрытые желто-серыми, асбестоподобными корками, толщиной от 2 мм до 1 см. Волосы на пораженных участках теряют блеск, становятся сухими, легко ломаются и выдергиваются. Через 1—2 мес корки начинают отпадать, обнажая голые пятна кожи, которые со временем зарастают волосами. При отсутствии лечения по соседству с пятнами, а также на других участках тела появляются новые очаги. Кожа на отдельных участках утолщается, приобретает складчатость. Наблюдается зуд, иногда очень сильный. Продолжительность болезни—1 год и более.
При глубокой (фолликулярной) форме отмечают резко выраженные воспалительные явления отдельных участков кожи, гнойный фолликулит, абсцессы, формирование толстых корок из засохшего гнойного экссудата, сильный зуд. Заживление таких очагов длится 2 мес и более, нередко заканчивается образованием рубцов.
Атипичная (стертая) форма характеризуется появлением на коже головы и других участках тела округлой формы очагов облысения без признаков воспаления. После шелушения чешуек обнажается гладкая поверхность кожи, на которой в течение 7—14 дн вырастают волосы. У теля т-м олочников кожа чаще всего поражается в области губ и лицевой части головы. Вследствие образующихся толстых корок морда кажется вымазанной в тесте — «тестяная морда». Отмечают болезненность пораженной кожи, зуд. Телята плохо развиваются, худеют, а при отсутствии лечения могут погибнуть.
Поверхностная форма болезни проявляется образованием округлых или овальных, покрытых сероватыми чешуйками участков, которые часто сливаются, образуя пятна диаметром от 1 до 5 см. Со временем пораженные участки освобождаются от корок, в центре пятна появляются новые волосы, имеющие обычно более темную окраску.
Глубокая форма болезни сопровождается развитием острого воспаления кожи, поражением фолликулов, образованием абсцессов. Пораженные участки могут сливаться, распространяться на нижнюю часть живота и конечностей.
Атипичная форма болезни является наиболее доброкачественной. В области крупа и головы обнаруживают небольшие потертости кожи, ссадины, облысения.
Патогенез. При попадании на кожу споры прорастают, начинается размножение грибка в роговом слое эпидермиса и волосах, что сопровождается воспалительными реакциями кожи, различной степени выраженности, нарушением питания волоса и его выпадением. Возможно распространение возбудителя по организму лимфогенным и гематогенным путями, образование диссеминированных мико-тических процессов в легких, печени, селезенке и других органах, нарушение обменных процессов, обусловливающих истощение и даже гибель животного.
Лабораторные исследования проводят путем микроскопии патологического материала и выделения возбудителя на питательных средах.
В лабораторию в пробирках с пробками или в небольших целлофановых пакетиках направляют волосы, корочки и чешуйки, отобранные с периферии пораженных участков кожи, не подвергавшихся лечению.
Микроскопическое исследование проводят непосредственно в хозяйстве или зональной лаборатории. Для микроскопии волосы, корочки, чешуйки помещают на часовое стекло с черным фоном. Корочки осторожно расщепляют препаровальной иглой, изолированные из корочек волосы, а также чешуйки переносят на предметное стекло в каплю 10%-ного едкого натра или калия. Препарат осторожно подогревают над спиртовкой (до появления паров) и накрывают покровным стеклом. Кусочком фильтровальной бумаги отсасывают из-под стекла щелочь и заменяют |ее каплей 50%-ного водного глицерина. Патологический материал можно обрабатывать и лактофенолом, который позволяет лучше сохранять морфологическую структуру гриба. Препараты просматривают вначале при малом, а затем большом увеличении. В положительных случаях обнаруживают прямые гифы мицелия с перегородками, располагающиеся правильными рядами по длине волоса, а также круглые или овальные споры диаметром 3—8 мкм, размещающиеся в виде цепочек на волосе или внутри его и образующие чехол у основания волоса.
Бактериологическое исследование. С помощью микроскопа отбирают пораженные волосы, измельчают их на кусочки длиной 1—2 мм прокаленной препаровальной иглой в стерильной чашке Петри, вносят по два кусочка на расстоянии 1 см один от другого в 8—10 пробирок с сусло-агаром или агаром Сабуро с глюкозой, агаром Литмана. Для задержки роста бактериальной микрофлоры в среды добавляют по 50 ЕД/мл пенициллина и 100 мкг/мл стрептомицина. Посевы культивируют при 22—28°С, просматривают через 7—15 дн. При появлении колоний бактериологической петлей снимают кусочек мицелия, переносят в каплю 50%-ного водного раствора глицерина, накрывают покровным стеклом и исследуют.
Диагнозна стригущий лишай считают установленным при наличии клинических признаков болезни и обнаружении возбудителя при микроскопии патологического материала или выделении из материала культуры и определении вида возбудителя.
Дифференциальный диагноз. Исключают микроспороз, паршу, чесотку, экземы и дерматиты неинфекционнсй этиологии.
При микроспорозе зуда не бывает, кожа на пораженных участках гладкая, пятна имеют неправильную форму, волосы обламываются на некотором расстоянии от кожи. При микроскопическом исследовании внутри пораженного волоса обнаруживают только мицелий грибка; мелкие споры (диаметр 2—3 мкм) располагаются мозаично в виде чехла снаружи волоса, у его основания. При люминесцентном исследовании в затемненном помещении под переносной ртутно-кварцевой лампой ПРК.-2 с фильтром Ву-да волосы, пораженные грибком микроспорум, под действием ультрафиолетовых лучей дают ярко-зеленое изумрудное свечение, чего не бывает при трихофитии.
При парше пораженные волосы располагаются группами среди здоровых и не обламываются, а выпадают. Образующиеся на пораженных участках кожи корочки имеют характерный вид «блюдечек» или щитков с углублением в центре.
Чесотка сопровождается сильным зудом; отсутствуют характерные для трихофитии ограниченные округлые пятна; при микроскопии обнаруживают чесоточных клещей. При экземах и дерматитах не* бывает ограниченных пятен, волосы не обламываются. Отрицательны результаты микологического исследования.
Лечение. Больных животных изолируют и лечат вакцинами, которые предварительно разводят согласно наставлению по их применению. Препараты вводят внутримышечно двукратно, с интервалом 10—14 дн, в дозах: лиофили-зированную (сухую) вакцину ЛТФ-130 для профилактики и лечения крупного рогатого скота от трихофитии (стригущего лишая)— телятам до 4 мес — 10 мл, от 4 до 8 мес — 15 мл, старше 8 мес — 20 мл; концентрированную живую сухую вакцину ТФ-130 К для профилактики и лечения трихофитии (стригущего лишая) крупного рогатого скота — телятам от 1 до 5 мес —2 мл, молодняку старше 5 мес и взрослым животным — 4 мл.
Лечебный эффект после введения перечисленных вакцин наступает через 15—30 дн после второго введения и проявляется в утончении и отторжении трихофитийных корок. Для ускорения отторжения корок пораженные участки надо смазать размягчающими средствами — вазелином, рыбьим жиром.
Иммунитет. После переболевания трихофитозом у жи-. вотных формируется длительный, напряженный иммунитет. Для активной иммунизации крупного рогатого скота применяют лиофилизированную (сухую) вакцину ЛТФ-130 для профилактики и лечения крупного рогатого скота от трихофитии (стригущего лишая) и концентрированную живую сухую вакцину ТФ-130 для профилактики и лечения трихофитии (стригущего лишая) крупного рогатого скота; Вакцины вводят внутримышечно двукратно в одно и то же место, с интервалом 10—14 дн. Иммунитет у привитых телят наступает к 21—30 дн после второго введения вакцины и сохраняется не менее 7 лет, у лошадей — через 30 дн и сохраняется п лет, у кроликов и пушных зверей наступает через 20—30 дн и сохраняется не менее 3 лет. Образующуюся на месте введения поверх-костную корочку удалять не следует, так как она к 20—25 дн отторгается самостоятельно.
Лиофилизированная (сухая) вакцина ЛТФ-130 для профилактики и лечения крупного рогатого скота от трихофитии (стригущего лишая) безвредна при применении и не вызывает заболевания у здоровых животных. Введение вакцины зараженным, находящимся в инкубационном периоде животным может привести к ускорению проявления клинической картины стригущего лишая с возникновением множественных трихофитийных очагов поверхностного характера. Таким животным вводят однократную лечебную дозу препарата. Вакцина пригодна для применения в течение 6 мес со дня изготовления при условии хранения в сухом темном помещении при 2—12СС. Перед применением лиофилизированную (сухую) вакцину ЛТФ-130 растворяют физиологическим раствором согласно наставлению по ее применению и вводят телятам от 1 до 4 мес в дозе 5 мл, от 4 до 8 мес б дозе 8 мл, животным старше 8 мес в дозе 10 мл. Разведенная вакцина должна быть использована в течение 2 ч с момента ее приготовления.
Концентрированная живая сухая вакцина ТФ-130(К) для профилактики и лечения трихофитии (стригущего лишая) крупного рогатого скота пригодна для применения при расфасовке по 40 доз в течение 18 мес, по 10 доз—12 мес со дня изготовления, при условии хранения в сухом темном месте при 2—10°С. Перед введением вакцину разводят стерильным физиологическим раствором согласно наставлению по ее применению. С профилактической целью вакцину применяют двукратно с интервалом 10—14 дн в дозах: телятам от 14 дн до 5 мес—1 мл, телятам старше 5 мес и взрослым животным —2 мл. Иммунитет наступает через 1 мес после второй инъекции и сохраняется не менее 7 лет.
Меры профилактики и борьбы.В благополучных и угрожаемых по стригущему лишаю крупного, рогатого скота хозяйствах вакцинируют весь нарождающийся молодняк с месячного возраста, весь молодняк, прибывающий на животноводческие комплексы, весь крупный рогатый скот, поступающий из-за рубежа для племенных и иных целей (иммунизируют независимо от возраста).
При .установлении диагноза хозяйство (ферму, бригаду) объявляют неблагополучным по стригущему лишаю и вводят ограничения.
Запрещают ввод в хозяйство (на ферму) или вывод из него животных, за исключением тех, что предназначены для убоя; перегруппировку внутри хозяйства без ведома ветеринарных специалистов; ввод здоровых животных в помещения, в которых ранее содержались больные животные до проведения очистки, санитарного ремонта и дезинфекции. Всех восприимчивых животных один раз в 10 дн подвергают клиническому осмотру. Больных и подозрительных по заболеванию изолируют и лечат вакцинами. Всех остальных животных вакцинируют.
При вынужденном убое привитых животных в первые 10 дн после вакцинации мясо используют на общих основаниях после иссечения мест инъекции. Через 10 дн после введения вакцины убой животных и использование мяса разрешается без ограничений. Молоко от привитых коров используют в пищу без ограничений.
Навоз подвергают биотермическому обеззараживанию, после чего его используют только для удобрений. Применять навоз после биотермического обеззараживания для других целей (изготовление кизяка и пр.) не разрешается.
Хозяйство считают благополучным по трихофитозу через 2 мес после последнего случая выделения клинически больных животных, а также после проведения заключительной дезинфекции.
Для дезинфекции применяют щелочной раствор формальдегида, содержащий 2% формальдегида и 1% едкого натра; горячий 10%-ный раствор серно-карболовой смеси при двукратном нанесении раствора с часовым интервалом между обработками; горячую формалин-керосиновую эмульсию, состоящую из 10 частей 40%-ного формалина, 10 частей керосина, 5 частей креолина и 75 частей воды. Для заключительной дезинфекции применяют щелочной раствор формальдегида.
Охрана человека от трихофитоза. В качестве профилактики стригущего лишая у человека необходимо при уходе за больными животными тщательно мыть руки горячей водой с мылом, дезинфицировать их 1%-ным раствором хлорамина. После работы спецодежда и обувь должны быть продезинфицированы в пароформалиновой камере.
БАКТЕРИАЛЬНЫЕ ИНФЕКЦИИ СВИНЕЙ
РОЖА СВИНЕЙ
Определение болезни. Рожа - это природноочаговая инфекционная болезнь, преимущественно свиней в возрасте от 3 до 12 месяцев, характеризующаяся при… Историческая справка. Р.Кох (1878) первый обнаружил возбудителя септицемии… Изучением рожи свиней занимались В.Ф.Петров, Д.Д.Бутьянов, А.А.Шпаковский, М.С.Жаков, В.Д.Чернигов, Л.П.Вель и…НЕКРОБАКТЕРИОЗ СВИНЕЙ
Определение болезни. Некробактериоз свиней – это инфекционная болезнь, характеризующаяся развитием гнойно-некротического стоматита, ринита,… Историческая справка. В 60-х г.г. 19 века во Франции и Италии впервые было… Возбудителя некробактериоза впервые выделил R. Koch (1881). Однако долгое время выделенного возбудителя считали…ДИЗЕНТЕРИЯ СВИНЕЙ
Определение. Дизентерия свиней– инфекционная болезнь, характеризующаяся геморрагическим поносом и некротическими поражениями толстых кишок. Эпизоотологические данные. К возбудителю восприимчивы свиньи всех пород и… В свиноводческих хозяйствах Смоленской области в прошлые годы дизентерия свиней регистрировалась в 60 % случаев, а к…ХАРАКТЕРИСТИКА ОСНОВНЫХ ВОЗБУДИТЕЛЕЙ ПАРАЗИТАРНЫХ ЗАБОЛЕВАНИЙ СЕЛЬСКОХОЗЯЙСТВЕННЫХ ЖИВОТНЫХ
Анаплазмоз Анаплазмоз — остро или хронически протекающее заболевание с резко выраженными… Этиология. Возбудитель — облигатный внутриэритроцитарный паразит рода Аnарlаsmа (Тheiler, 1910), у крупного рогатого…АСКАРОПСОЗЫ
Возбудитель- спирурата Ascarops strongylina Rudolphi 1819 и A. den tata Linstow, 1904. Небольшие нематоды (11-22 мм), глотка окружена… Клинические признаки заболевания.Болеют аскороптозом взрослые свиньи в летнее… Диагнозставят на основании исследования фекалий по методу Фюллеборна или Дарлинга на наличие яиц нематоды.БОРРЕЛИОЗ СВИНЕЙ
К борелиям восприимчивы в основном свиньи 2-3 месячного возраста, но могут поражаться животные и старших возрастов. Возбудитель заболевания. Боррелиоз свиней вызывает В. (Trepanema)… Эпизоотологические данные.Болезнь имеет широкое распространение почти повсеместно и наносит большой экономический…БАЛАНТИДИОЗ
Наиболее восприимчивыми являются поросята отъемного возраста, но могут болеть и свиньи других возрастов. Имеются случаи заболевания балантидиозом… Болезнь приносит большие потери из-за снижения упитанности больных и… Возбудителем балантидиоза свиней являются простейшие инфузории балантидии из класса Ciliata - Balantidium coli и…ГЕМОНХОЗ
Определение. Гельминтоз жвачных, которых характеризуется поражение сычуга, поносами и истощением. К нему восприимчивы овцы, козы, крупный рогатый… Возбудителями гемонхоза являются нематоды рода Haemonchus, которые относятся к… Патогенез.Развитие гемонхусов происходит без промежуточных хозяев. Больные животные выделяют во внешнюю среду яйца…ГИПОДЕРМАТОЗ КРУПНОГО РОГАТОГО СКОТА
Возбудители.Гиподерматоз вызывается личинками обыкновенного подкожника, или строки (Hypoderma bovis). Окрыленный обыкновенный подкожник – крупное (до 2 см длины) темного цвета… Биология возбудителей.Самки подкожного овода откладывают от 500 до 800 яиц на волосяной покров конечностей, брюшной…ГНУС
Гнус –кровососущие двукрылые летающие насекомые. К ним относятся комары, мошки, мокрецы, слепни, некоторые кровососущие мухи. Многие виды этих насекомых являются не только опасными эктопаразитами, но и переносчиками многих возбудителей болезней животных, в т. ч. зоонозов.
Для борьбы с гнусом и защиты от него животных следует проводить комплекс общих и специальных мероприятий.
Фермы, летние лагеря и загоны следует располагать вдали от заболоченных лесов, болот, на сухих, хорошо продуваемых ветром участках.
В хозяйствах и населенных пунктах необходимо проводить мероприятия, ограничивающие выплод гнуса путем проведения мелиорации заболоченных участков, регулирование воды в водоемах.
Важным является проведение мелиоративных и гидротехнических работ, устройство плотин и дамб, препятствующих большому разливу рек, очистка берегов и русел рек от кустарников, засыпка мелких водоемов и т.д.
При массовом нападении гнуса на животных их необходимо перевести из заболоченных на сухие, хорошо проветриваемые участки, выпасать животных (для профилактики нападения мошек, мокрецов и комаров) в дневное время, а при нападении слепней – утром и вечером. Иногда практикуют ночную пастьбу животных.
Для укрытия от нападения гнуса животных загоняют под теневые навесы.
При невозможности указанными средствами предупредить массовое нападение гнуса на животных их ставят на стойловое содержание.
Важным мероприятием является обработка волосяного покрова животных репеллентами и инсектицидами для защиты их от нападения гнуса.
Многие инсектициды могут быть опасными для животных и человека, поэтому обращение с ними требует аккуратности, четкости и пунктуальности. Применение их должно проводиться строго по наставлениям. Особенно внимательно следует отнестись к приготовлению рабочих растворов инсектицидов и репеллентов, соблюдению сроков и доз их использования. Особое внимание должно обращаться на соблюдение условий личной гигиены. Необходимо соблюдать сроки использования в пищу молока и мяса при применении животным этих препаратов.
В последнее время для борьбы с гнусом применяются синтетические пиретроиды, среди которых нередко используется ПЕРМЕТРИН. Перметрин содержит смесь цис - и трансизомеров в соотношении 2:3, представляет собой маслянистую жидкость со слабым запахом, хорошо растворяется в органических растворителях. Перметрин относится к умеренно токсичным соединениям: ЛД50 его для крыс составляет 430-4000 мг/кг, для мышей – 540-2690 мг/кг.
Для систематического применения против гнуса перметрин рекомендуется в дозе 0,25 г на одно взрослое животное и по 0,125 г при обработке молодняка методом среднеобъемных опрыскиваний 0,05%-ной водной эмульсией соответственно по 500 и 250 мл и методом малообъемных опрыскиваний 0,25-ной эмульсией по 100 и 50 мл соответственно на одно животное. В указанных режимах применения перметрин нетоксичен, не накапливается в организме и не выделяется с молоком.
СТОМОЗАН – препарат группы пиретроидов, содержит 20% перметрина. Препарат применяют крупному рогатому скоту, свиньям, лошадям. В соответствии с рекомендациями фирм предлагающих его, стомозан безопасен для животных, не остается после обработки в продуктах питания. Выпускается обычно стомозан в виде 20%-ной эмульсии с содержанием 20% перметрина и применяется в 0,1%-ной концентрации.
ПРОТЕИД – препарат содержит 3% альфациперметрина и 30% хлорфенвинфоса. Он малотоксичен. Обработку животных проводят при температуре воздуха не ниже 18ºС в 0,1%-ной концентрации из расчета расхода рабочей эмульсии на взрослое животное 5-10 л. Молоко в пищу разрешается использовать через 6 ч, мясо – через 7 дней после обработки скота.
БУТОКС (дельтаметрин) – синтетический пиретроид, малотоксичен. ЛД50 для белых крыс при оральном введении водной суспензии составляет 5000 мг/кг. Против насекомых бутокс наносят на животное в 0,0025%-ной концентрации. Убой животных на мясо и потребление молока разрешается сразу после применения бутокса.
ЭКТОМИН – синтетический пиретроид, действующим веществом которого является цис-изомерсодержащий циперметрин. Препарат малотоксичен для животных. ЛД50 для крыс при оральном применении составляет 1108 мг/кг, при дермальном применении мышам – 2000 мг/кг.
Крупному рогатому скоту, овцам и свиньям для орошения поверхности тела и для купания в ваннах эктомин – 100 к.э. применяют в 0,1%-ной концентрации. За три дня до убоя животных их не следует обрабатывать эктомином. При применении препарата нет ограничений по использованию в пищу молока.
ЦИПЕРИЛ – синтетический пиретроид, действующим началом которого является циперметрин. Для защиты от гнуса животных опрыскивают 0,0125%-ной эмульсией с интервалом в 2-3 дня, при высокой численности насекомых – ежедневно перед выгоном на пастбище с нормой расхода 250-500 мл на животное. Молоко и мясо при обработке животных используют без ограничений.
НЕОЦИДОЛ – относится к фосфорорганическим соединениям. ЛД50 для белых крыс неоцидола – 600 к.е. при оральном введении составляет
1053 мг/кг, при нанесении на кожу – 3100 мг/кг. Препарат токсичен для пчел, птиц и рыб. При опрыскивании крупного рогатого скота препарат применяют в 0,1%-ной концентрации. Убой животных разрешают через 14 дней после обработки неоцидолом, молоко для пищевых целей можно использовать через 3 дня после обработки.
ЭКТОДИП ФОРТЕ 60%-ный – это концентрированная эмульсия для борьбы с эктопаразитами животных, действующим веществом которой является диазинон (димпилат). Препарат эффективен против мух, комаров, мошек, вшей, клещей и других паразитов животных.
Перед каждой массовой обработкой животных следует провести контрольное применение препарата на небольшой группе животных и провести наблюдение в течение 3 дней.
Для применения Эктодип Форте 60%-ного при эктопаразитах (включая компоненты гнуса) его используют различным животным в количествах, определенных «Ветеринарным законодательством» по применению инсекто-акарицидов животным.
Перед купанием животных следует напоить. Ослабленных животных раствором не обрабатывают.
Эктодип форте 60%-ный безопасен в использовании. Но в случаях отравления рекомендуется использовать атропин, как антидот.
Эктодип форте 60%-ный оказывает отравляющее действие на пчел и рыбу. Поэтому не следует выливать раствор в канализацию, пруды, водоемы, реки озера.
Срок элиминации: мясо – 7 дней, молоко – 72 часа.
Хранение: Эктодип форте 60%-ный огнеопасен. Поэтому храниться должен в прохладном, защищенном от света и жары месте, недоступном для детей. Хранить его необходимо вдали от пищевых складов.
циперметрин 10%-ный является эффективным для борьбы с гнусом. Применяют его из расчета 1-2 л на животное. Эффективность препарата составляет выше 95%.
При необходимости для борьбы с гнусом можно использовать и другие эффективные препараты согласно инструкции по их применению.
Демодекоз
Возбудители.Клещи рода Demodex имеют червеобразную форму, нерасчлененную головогрудь и брюшко. Хоботок хорошо развит, лирообразной формы. Ноги… Биология возбудителей.Чаще всего клещи живут в волосяных фолликулах потовых и… Эпизоотология.Заражение происходит при контакте здоровых животных с больными и через предметы ухода. Более…Диктиокаулезы
Диктиокаулезы — нематодозные заболевания животных, протекающие остро или хронически с признаками снижения аппетита, а также кашля и исхудания. Этиология. Возбудителями болезни являются нематоды из рода диктиокаулюс… Эпизоотология. Инвазионные личинки диктиокаул в холодную и дождливую погоду могут длительное время оставаться живыми…ИЗОСПОРОЗ
Возбудитель болезни - паразитические простейшие Isospora suis, которая относится к р. Isospora, сем. Eimeriidae, кл. Sporozoa. Необходимо отметить,… Эпизоотологические данные.Болезнь имеет широкое распространении. При… В процессе развития болезни значительно снижается содержание сульфгидрильных групп в крови и электрокинетический…ИКСОДОВЫЕ КЛЕЩИ
Биология.У отдельных видов иксодид самки могут отложить от 3 до 15 тыс. яиц, после чего самки погибают. Из яиц вылупляются шестиногие личинки, они… Патогенез.Численность паразитирующих клещей на животных зависит от… Клиническое течение. У животных появляется аллергическое состояние, изменяется общая реактивность организма,…КРИПТОСПОРИДИОЗ
Возбудители криптоспоридиоза относятся к кокцидиям р. Cryptosporidium, сем. Cryptosporidiidae, кл. Sporozoa, т. Apicomplexa. Между видами… Развитие криптоспоридиоза протекает по схеме гомоксенного (однохозяинного)… У телят чаще повреждается подвздошная кишка; у поросят развитие криптоспоридий происходит не только в кишечнике, но и…Инструкция о мероприятиях по борьбе с криптоспоридиозом животных
2. Криптоспоридиозом болеет крупный рогатый скот, овцы, козы, лошади, свиньи, кролики, кошки, птицы, рыбы и другие. Чаще болеют молодые животные.… 3. Криптоспоридии у молодняка сельскохозяйственных животных локализуются на… 4. Развитие криптоспоридий протекает по схеме гомоксенного (однохозяинного) жизненного цикла, то есть завершается от…МАКРАКАНТОРИНХОЗ
У домашних свиней и диких кабанов, изредка и у человека, паразитирует скребень-великан M.hirudinaceus. Это крупные круглые, белые или розоватые… Патогенез.Самки скребня-великана в кишечнике свиней откладывают большое… Жизнеспособность и инвазионные качества акантелл не изменяются в течении всего периода метаморфоза личинок жуков. В…ОСТЕРТАГИОЗЫ
Диагноз.Для уточнения диагноза из яиц выращивают личинки и определяют вид паразита по количеству кишечных клеток. Лечение.Для лечения животных применяют фенотиазин (0,5 г), нилверм (0,015 г) и… Меры борьбы и профилактика.С целью профилактики болезни проводят дегельминтизацию жвачных весной, перед выгоном на…ОЛЛУЛАНОЗ
Возбудители болезни - мелкие нематоды - Ollulanus tricuspis, O.skrjabini, O.andorica, O.suis сем. Ollulanidae. Размеры паразита 0,8-1,5 мм. Тело… Клинические признаки заболевания.У больных наблюдают плохой аппетит,… Диагноз можно поставить только после смерти животного. Желудок убитых или павших свиней разрезают и делают соскобы с…ПАРАМФИСТОМАТОЗЫ
Болезнь поражает крупный рогатый скот, буйволов, овец, коз, северных оленей и других животных. Она распространена во многих странах Европы, Азии,… Возбудителями болезни являются трематоды п/о Paramphistomatata, которые… Половозрелые паразиты выделяют большое количество яиц, которые с фекалиями попадают во внешнюю среду, где через 11-40…ПНЕВМОЦИСТОЗ
Распространение болезни изучено недостаточно. Возбудителемболезни является Pneumocystis carinii (большинство исследователей… Пневмоцисты впервые были обнаружены во Франции у лабораторных животных (мыши, морские свинки, кролики, крысы) в 1912…Псороптоз
Возбудители.Псороптесы поражают овец, крупный рогатый скот, лошадей и других млекопитающих. У каждого вида животных паразитирует свой вид клеща, у… Биология возбудителя.Паразиты локализуются на коже животного. Самки… Эпизоотология.Источником инвазии являются больные животные. Возможна передача инвазии непосредственно от одного…СТРОНГИЛОИДОЗЫ
Возбудитель заболевания. У сельскохозяйственных животных паразитируют следующие виды: Strongyloides ransomi - у свиней, у крупного и мелкого… Патогенез.Паразитируют стронгилоидесы (угрицы) в тонком отделе кишечника.… Второй путь - непрямой: во внешней среде формируются свободно живущие поколения самок и самцов. Самки после…САРКОПТОз
Возбудитель.Клещи рода Sarcoptes (зудни) имеют шаровидное тело длиной 0,25-0,5 мм, ноги короткие и толстые с колокольчатыми присосками на длинных… Биология возбудителей.Зудни паразитируют в эпидермальном слое кожи, где самка… Эпизоотология. Способствующими факторами в распространении инвазии играет скученность животных, повышенная влажность в…Сифункулятозы
Возбудители. Вши обитают на специфических хозяевах: представители сем. Haematopinidae - Haematopinus eurysternus - на крупном рогатом скоте, H.suis… Вши - мелкие бескрылые насекомые. Тело их продолговато-овальное, сплющено в… Биология возбудителя. Вши развиваются путем неполного превращения. Самка откладывает яйца (гниды), приклеивая их к…Трихостронгилидозы
Трихостронгилидозы жвачных — нематодозные заболевания, протекающие чаще в субклинической форме с признаками истощения, анемии, нарушения работы… Этиология. Возбудителями заболеваний являются мелкие нематоды из семейства… Патогенез. Трихостронгилиды нарушают целостность слизистых оболочек, вызывают интоксикацию организма, могут…Инструкция по профилактике и терапии телязиоза крупного рогатого скота
2. Телязиоз вызывается нематодами из рода Телязия. У крупного рогатого скота наиболее часто паразитируют нематоды Телязия родези, находящиеся в… 3. Промежуточными хозяевыми телязий являются мухи из рода Муска. Самки телязий… 4. Заражение телязиями животных в условиях Беларуси происходит обычно с июня месяца, примерно через месяц после начала…ЭЙМЕРИОЗ СВИНЕЙ
Болезнь наносит большой экономический ущерб. Пораженный молодняк отстает в росте и развитии, прирост массы снижается на 30-40%. Нередко наблюдается… Возбудителями болезни являются простейшие организмы микроскопической величины… К настоящему времени описано 13 видов эймерий, однако, сведения о некоторых из них недостаточно достоверны. Н.А.…ЭЙМЕРИОЗ КРУПНОГО РОГАТОГО СКОТА
Могут болеть телята и в возрасте от 3 недель до 2 месяцев, а также молодняк старше 7-месячного возраста. Возбудитель заболевания . К настоящему времени, по данным Pellerdy L. (1974),… Вспышки болезни могут наблюдаться при резкой смене рациона, особенно при скармливании крупностебельчатого корма,…Эффективность иммуномодуляторов при паразитарных болезнях животных
В отличие от вирусных и бактериальных инфекций при паразитозах до настоящего времени разработаны лишь единичные средства специфической профилактики,… Способы и средства повышения уровня иммунитета животных ученые искали с давних… В последние десятилетия наиболее активно и результативно работа по изысканию и определению эффективности…ХАРАКТЕРИСТИКА НЕЗАРАЗНЫХ БОЛЕЗНЕЙ ЖИВОТНЫХ
ДИСПЕПСИЯ
Заболевание по частоте, массовости и величине экономического ущерба занимают лидирующее положение среди незаразной патологии молодняка животных.… Этиология и патогенез. Диспепсия новорожденных животных – заболевание… Предрасполагающие причины развития диспепсии по времени их воздействия или возникновения можно разделить на…ГАСТРОЭНТЕРИТ
У поросят заболевание наиболее часто возникает с началом подкормки, а также в первые 12 –15 дней после передачи на доращивание. На крупных… Этиология и патогенез. В настоящее время гастроэнтерит у молодняка… Болезни, протекающие с диарейным синдромом, по-происхождению могут быть дефицитными, интоксикационными, эндокринными и…ТОКСИЧЕСКИЙ ГЕПАТИТ
Гепатит – воспаление печени, характеризующееся альтеративными (дистрофическими, некротическими и атрофическими) изменениями в паренхиме,… Из гепатита у свиней выделена его аутоиммунная нозологическая форма. Такие… В ряде работ, опубликованных в последние годы в странах СНГ и за рубежом, описывается экспериментальный вирусный…ПАНКРЕАТИТ
Панкреатит– воспаление поджелудочной железы, сопровождающееся нарушением преимущественно экзокринной функции и расстройством пищеварения. По течению… Этиология и патогенез.Развитию панкреатита предшествуют воспалительные… У молодняка заболевание возникает также на иммунной основе вследствие поступления с молозивом от больных матерей…Нитрофуранов
+ действие слабо усиливается; ± наблюдается антагонизм в некоторых случаях; - несовместимое сочетание.Сроки браковки молока от коров, подвергнутых лечению антибиотиками и другими лекарственными препаратами.
Особенности лечения мастита в сухостойный период.Лечение коров, больных… - сухостойные коровы легче поддаются лечению;Патогенетическая терапия. Частые неудачи при лечении маститов объяснятся недооценкой патогенозотического комплекса воспаления, следовательно, и патогенетической терапии. Выключение тем или иным способом путем проведения болевого синдрома со стороны рецепторного аппарата молочной железы в кору головного мозга, превращают перераздражение и изменяет характер воспалительного процесса.
Из средств патогенетической терапии показаны новокаиновые блокады. Новокаин действует непосредственно на сосудистые рецепторы, обеспечивает восстановление возбудимости и проводимости нервов, трофики тканей, активизирует функцию ретикуло-эндотелиальной системы, повышает фагоцитарную активность лейкоцитов, нормализует и уменьшает порозность сосудов.
Короткая новокаиновая блокада нервов вымени по Д.Д. Логвинову. Укол делают сзади вымени в точке пересечения линий идущих на высоте основания вымени и проходящих на расстоянии 1-2 см от средней линии в сторону воспаленной половины или четверти вымени (независимо передняя или задняя). После подготовки места укола иглу вводят на глубину 8-12 см в направлении запястного сустава той же стороны. В надвымянное пространство инъецируют 150-200,0 мл 0,5 % стерильного раствора новокаина. При двустороннем мастите блокаду делают с обеих сторон. Повторные введения через 24-48 час.
Блокада наружного срамного нерва по Б.А. Башкирову.Точку укола находят на месте пересечения двух линий: линии наружного края длиннейшей мышцы спины (отступа 6-7 см от средней линии спины) и линии между 3 и 4 поперечно-реберными отростками поясничных позвонков. Укол делают на глубину 6-9 см с наклоном иглы 50-600 к средней плоскости до упора в позвонок. Оттянув иглу назад на 2-5 см, вводят 80-100 мл 0,5 % раствора новокаина.
Метод внутриаортального введения при маститах по Д.Д. Логвинову.
Пункцию брюшной аорты проводят иглой 18 см с правой стороны между отростками четвертого и пятого поясничных позвонков, отступив на 7-8 см на ширину ладони от средней линии тела животного. Иглу вводят резким толчком под углом 25-300 к сагиттальной плоскости до упора в тело позвонка. Затем конец иглы смещают на 0,5-1 см вправо и продвигают вглубь еще на 4-5 см. После прокола аорты появляется пульсирующая струя крови. К игле присоединяют шприц Жане со стерильным 1 % раствором новокаина из расчета 0,0015-0,002 г сухого вещества на 1 кг живой массы и медленно под давлением шприца вводят в аорты, интервалы между введениями 48 часов.
Метод внутривенного введения. Новокаин в 0,25 % концентрации медленно вводится в яремную вену из расчета 0,5-1 мл на 1 кг массы животного. При использовании 0,5-1 % растворов новокаина дозу их на 1 кг массы животного снижают до 0,25-0,5 мл. При остром течении мастита препарат внутривенно вводят ежедневно в течение 3-4 дней, при подостром течении мастита через 1-2 дня.
Новокаиновая блокада по Г.С. Фатееву. Точкой укола является передневерхние углы хорошо выраженных ямок, расположенных по углам корня хвоста. Спереди и снаружи точки укола ограничены кресцово-седалищной связкой, внутренняя сторона крестцовыми и хвостовыми позвонками. Место инъекции тщательно очищают и дезинфицируют, тонкий слой ткани ямки прокалывают одновременно в одном краниальном направлении. Иглу Боброва вводят в тазовую полость на глубину 3-7 см под углом 30-450 к поверхности ямки. 1 % раствор новокаина инъецируют в межтканевое пространство под средним давлением, в дозе 100 мл. После 1-3 блокад с серозно-катаральным маститом выздоравливают до 98 % животных, 3-5 кратных инъекциях при остром гнойно-катаральном – 93 %, геморрагическом – 86 %, фибринозном – 80 %.Предложен способ лечения больных коров субклиническим маститом инъекциями в брюшину растворов новокаина, целноновокаина и тримекаина. Интерперитониальное введение растворов выполняют в левой головной ямке, отведя ладонь от поперечно-реберных отростков поясничных позвонков. После выстригания шерсти и двукратной обработки настойкой йода кулаком левой руки смещают рубец вниз и внутрь, а правой пунктируют брюшную стенку выше границы рубца и вводят соответствующий раствор в дозе 10 см3 (2 мг/кг сухого вещества анестетика). Введение растворов новокаина, цельно новокаина, тримекаина в высоких концентрациях обладает высокой терапевтической эффективностью, сокращает затраты времени и труда, удобно в условиях производства.
А.Г. Мацхваришвили и др. (1985) показали терапевтическую эффективность при маститах при введении новокаина в правую голодную ямку. Точка инъекции находится на 5-6 см ниже поперечно-реберного отростка поясничного позвонка. После обработки поля прокол иглой брюшной стенки проводят снизу вверх на глубину 5-6 см. 10 % раствор новокаина вводят трехкратно в дозе 10 мл, один раз в день через каждые 48 часов.
Для лечения коров, больных серозной и катаральной формой мастита, эффективно внутривенное введение новокаино-антибиотиновых растворов. Для этого готовят 0,25-0,5-ный раствор новокаина из расчета 0,1-0,2 г сухого вещества на 100 кг массы животного. Затем непосредственно перед введением на каждые 100 мл раствора добавляют 300 000-500 000 ЕД пенициллина, стрептомицина, биомицина или другого совместного с новокаином антибиотика. Новокаино-антибиотиковый раствор подогретый до температуры тела вводят в яремную вену. В случае необходимости внутривенную инъекцию указанных растворов повторяют через 24 или 48 часа. Основным показателем высокой терапевтической эффективности применения новокаина является быстрое восстановление лактации. У всех животных, лечение которых было начато в первые сутки проявление клинических признаков, лактация восстанавливалась в течение 48-72 часов. Если лечение начинали с опозданием, его эффективность снижалась и процесс нормализации был менее полноценным.
Для лечения маститов применяется окситоцин, применяемый в чистом виде или в препарате питуитрина, обладает высоким стимулирующим действием на миоэпителий и гладкую мускулатуру емкостной системы вымени. Под их влиянием при введении в кровь быстро (1-2 мин.) секрет вымени из альвеол и молочных протоков «сбрасывается» в молочные ходы и цистерны. Вследствие этого ликвидируется острый застой молока в емкостной системе, который является одним из важнейших признаков развивающего мастита.
Для освобождения молочной железы от патологического секрета в яремную вену вводят 30-40 ЕД (5-6 ЕД на 100 кг массы животного) окситоцина, питуитрина М или питуитрина Р. Сразу после инъекции выдаивают молоко из пораженной четверти, массируя ее только от основания к соску. Затем выдаивают молоко из здоровых долей.
Окситоцин вводят и подкожно (30-60 ЕД). В этом случае корову выдаивают через 5 минут после инъекции. Введение повторяют через 8-12 часов.
Сочетание лечение мастита новокаином и окситоцином или питуитрином значительно выше, чем каждого в отдельности. Оптимальным является подкожно введение окситоцина или питуитрина в дозе 10 мл/100 кг, а спустя 45-60 сек. 0,5 % раствор новокаина внутривенно в дозе 1-1,5 мг (100-150 мл). Повторно препараты вводят через 24-48 часа.
Хорошие результаты получены от применения окситоцина с другими препаратами при этом окситоцин вводится подкожно в дозе 50 ЕД с обязательным сдаиванием. После сдаивания интерцисцернально вводят антимикробные препараты: мастисан А, мастисан Е и др.
В Белорусском НИИЭВ был испытан как патогенетическое средство комплексный препарат ихглюковит в состав которого входит ихтиол, глюкоза, аскарбиновая кислота, этиловый спирт и дистиллированная вода, препарат вводили внутривенно в дозе 10 мл на 100кг живой массы с интервалом 48 часов. Лечебная эффективнось ихглюковита при субклиническом мастите составила 69,2 %, клиническом мастите в сочетании с противомаститными препаратами 90,4 %.
Кроме проведения специфических мероприятий при лечении коров, больных клиническими маститами, применяют средства, повышающие общую резистентность организма. Используют аутогемотерапию, молозивный иммуноглобулин, иммуноглобулин аллогенный крупного рогатого скота, витамины.
При сочетании антибиотикотерапии и аутогемотерапии эффективность их увеличивается. Антибиотики пролонгируются кровью и задерживаются в организме до трех суток. Повторные инъекции проводят по истечении трех-четырех дней. Кровь, полученная от больного животного и введенная ему же парентерально, равно как и донорская кровь, является одним из активных средств, повышающих общую сопротивляемость организма. Техника антибиотико-аутогемотерапии следующая. В открытые флаконы по 500 тыс. ЕД пенициллина и стрептомицина вносят по 1-2 мл, 2,9 %-го раствора лимонно-кислого натра, растворяют антибиотики и наполняют кровью из яремной вены, размешивают и инъецируют 20-граммовым шприцом в область шеи или крупа.
Физические методы лечения.С лечебной целью при маститах применяют различные средства и методы физиотерапии: охлаждающие и тепловые процедуры, свето-, электро- и ультразвуковую терапию, массаж вымени. Их назначают отдельно или в комплексе с другими лечебными мерами.
Своевременное и правильное применение физиотерапевтических средств нередко оказывается более эффективным.
Лечение холодом используется при остром серозном и катаральном мастите в первые сутки заболевания (до введения лекарственных веществ в молочную железу), а так же при ушибах вымени, при не травмированной кожи. Холод противопоказан при осложненных маститах, гнойных некротических процессах. Под влиянием холода уменьшается приток крови и молочной железе, что препятствует образованию воспалительного экссудата, снижению жара, болезненности, отечности пораженного органа. Холод применяют в течение 3-4 часов. Применяют различные способы лечения холодом: обливание пораженной части вымени холодной водой из шланга, охлаждающие компрессы (ткань, смоченная водой и слегка отжатая), обкладывание жидкой глиной. Для усиления охлаждающего действия при подготовке глины на каждый литр воды вносят 1-3 столовые ложки уксуса. Слой глины поддерживают во влажном состоянии путем регулярного смачивания его водой.
Тепловые процедуры назначают при многих острых формах мастита в стадии ослабления воспалительной реакции, обычно на 3-5 день. Под влиянием тепла повышаются и защитные силы организма, ускоряется рассасывание вредных продуктов клеточного распада, уменьшается боль, активизируются регенеративно-восстановительные процессы. Применяют водные, спиртовые (с 40-500 – этиловым, камфорным или ихтиоловым спиртом), припарки (сенная труха, опилки), парафинотерапию. При парафинотерапии на чистую сухую выбритую пораженную четверть вымени наносят широкой кисточкой расплавленный парафин температурой 450С, затем на это место накладывают более горячий (80-900С). Толщина парафиновой аппликации должна быть около 1 см. Для удержания тепла парафин закрывают полиэтиленовой пленкой, затем ватно-марлевым надвымянником. Длительность процедуры 3-4 часа.
При использовании озокерита нагревают до 100-1100С и разливают в кюветы, на дне которых предварительно расстилают пленку. Из первого кювета размер 46х46х6 см озокерит с температурой 40-450С накладывают на поясницу и крестец, а из второго размер 66х56х6 см озокерит с температурой 45-600С пораженную четверть вымени (предварительно на ней выбривают волосы). Для продолжительного сохранения тепла на озокерит так же накладывают клеенку, а затем ватный надвымянник. Озокеритовые процедуры назначают один или два раза в день. При лечении озокеритом острых форм мастита (серозный, катаральный, фибринозный, гнойно-катаральный) выздоровление наступает после 1-5 аппликаций. Для излечения хронических маститов требуется от 4 до 28 аппликаций.
Лечение сухим теплом выполняют с помощью тиосульфатной грелки, представляющей собой двухслойную полиэтиленовую пленку, между слоями которой равномерно размещен кристаллический тиосульфат натрия. Для создания в грелке температуры до 480С тиосульфат натрия нагревают в горячей воде с температурой 75-800С. Подготовленную грелку прикладывают через марлевую косынку к больному вымени, в снаружи покрывают ватной прокладкой и фиксируют надвымянником. Процедуру выдерживают 1,5-2 часа, повторяют 2 раза в день в течение 2-3 суток.
Ультрафиолетовое облучение проводят стационарной ртутно-кварцевой лампой с горелками ДОТ-200 или ДОТ-400 (ПРК-2, ПРК-4). Облучают вымя с трех сторон (с боков и сзади) на расстоянии 60-100 см в течение 5-20 мин., процедуру повторяют через день. При серозном мастите с 2-3-дневной давностью выздоровление наступает к 5-11 дню лечения. При катаральном, фибриозном и гнойных маститах облучение ртутно-кварцевой лампой рекомендуется применять в комплексе с другими лечебными мерами.
Гальванотерапия (ионофорез, электрофорез). Метод лечения особенно показан при катаральных, фибриозных, гнойных формах мастита. Гальванический ток к пораженной части вымени подводят с помощью электродов, а растворы для ионофореза готовят на дистиллированной воде. Для лечения маститов применяют 1-2 % раствор новокаина, 3-5 % раствор йодистого калия, растворы пенициллина или стрептомицина (200 000-300 000 ЕД на 20-40 мл) физраствора хлорида натрия. Йодистый калий и пенициллин вводят с отрицательного, а новокаин и стрептомицин с положительного полюса. Применяют силу постоянного тока 50-55 мА при плотности тока 0,5 мА на 1 см2 площади электрода. Ионофорез назначают ежедневно или через день.
Для лечения ультразвуком клинически и субклинически протекающих маститах применяют ультразвуковой терапевтический аппарат (ВУТ-1). Под влиянием ультразвука уменьшается болезненность вымени, ускоряется рассасывание воспалительных отсеков и инфильтратов, повышается титр лизоцима в молоке. На пораженной четверти вымени выбривают волосы, кожу протирают 70 %-м спиртом, раствором фурацилина, смазывают 50 %-м водным раствором глицерина. Ультразвуковую головку со скоростью 1-1,5 см в сек., передвигают по поверхности кожи больной четверти. Процедуру начинают с малых доз излучения 0,4-0,6 Вт/см, а затем увеличивают интенсивность до 1,0 Вт/см. Время воздействия 5-15 мин. Ультразвуковые процедуры проводят ежедневно, число сеансов 2-10 зависит от формы мастита.
УВЧ – терапию мастита и послеродовых отсеков вымени проводят с помощью лечебного передвижного доильного аппарата с УВЧ (ЛПДА-1 УВЧ) в процессе машинного доения на доильных площадях или стойлах. Электромагнитное поле УВЧ падают на пораженные четверти вымени путем подсоединения через гибкий провод-фидер выхода генератора УВЧ с электродами, вмонтированными в межстенную камеру доильных стаканов. УВЧ применяют 2 раза в сутки во время доения с длительностью одного сеанса 5 мин.
Высокоэффективное лечение клинически выраженных острых и скрыто протекающих маститов и раздражений вымени с помощью лазерных лучей с использованием приборов «МИЛТА-МВ», «Веге-МВ», «СТП», «Мустанг», СЛ-202 и АЛ-010 (Петролазер)
Лечебный массаж вымени способствует улучшению и усилению кровообращения, обеспечивает более интенсивный отток лимфы и венозной крови, активизирует физиологическую систему соединительной ткани, усиливает окислительные процессы, ускоряет рассасывание воспалительного отека, обеспечивает условия для удаления сгустков скопившегося экссудата из молочных ходов и цистерны.
Массаж проводят через 3-4 дня после заболевания. Назначают массаж при серозном и катаральном маститах в стадии разрешения воспалительного процесса, при субклинически протекающих маститах, а так же маститах развивающихся в период запуска и сухостоя.
Противопоказан массаж при гнойно-катаральном, фибринозном, геморрагическом воспалении, абсцессах и флегмоне вымени. При этих формах мастита массаж может вызвать обострение процесса, распространение инфекционного начала на здоровых участках вымени и появлению метастазов в других органах.
При выполнении массажа сочетают в определенной последовательности различные приемы: поглаживание кожи вымени, легкое покачивание, приподнятие его снизу вверх, разминание и растирание участков уплотнения.
При серозном мастите вымя массируют снизу вверх, перемещая пальцы от основания сосков вымени по направлению к надвымянному лимфатическому узлу, так как преследуется цель улучшения оттока венозной крови и лимфы.
При катаральном мастите главная задача разрушить и удалить образовавшиеся сгустки, камни казеина и восстановить проходимость молочных ходов. Поэтому массаж делают от основания вымени к соскам.
Лечебный массаж назначают продолжительностью 10-15 мин. 2-3 раза в день после доения. Во время массажа через каждые 3-5 мин. повторяют сдаивание секрета из пораженной четверти.
Допускается сочетание массажа с втиранием мазей и линиментов. Для чего используют камфорное масло, камфорную, стрептоцидовую, йодную, ихтиоловую, норсульфазоновую или прополисную мази.
Лечение коров, больных серозным маститом. Животному представляется покой, при необходимости диетотерапия и ограничение водопоя, проводят сдаивание молока через 4-6 часов (исключая ночное время). Холод применяют в первые сутки заболевания. Для полного удаления содержимого из вымени вводят окситоцин, питуитрин, гипотоцин, по 5-6 ЕД на 100 кг живой массы. Для растворения хлопьев казеина вводят 2% раствор гидрокарбоната натрия или 0,5% раствор нашатырного спирта в дозе 50-60 мл с последующим сдаиванием через 15-20 минут. Проводят массаж вымени снизу вверх, по ходу лимфатических сосудов по 10-15 минут 2 раза в день с одновременным втиранием антисептических мазей. При сильно выраженных воспалительных отеках, инфильтратах назначают внутривенное введение 10% раствора хлористого кальция или глюконата кальция в дозе 100-150 мл, совмещая их с 40% раствором глюкозы в дозе 100-150 мл. Из антимикробных средств одного из препаратов внутримышечно: смесь пенициллина (натриевая или калиевая соль) и стрептомицина по 3-5 тыс. на 1 кг массы; окситетрациклингидрохлорид 3-5 тыс. ЕД 3 раза в день в течение 3 суток; гентамицин сульфат внутримышечно по 0,0004-0,0008 гр/кг массы 1 раз в день 3 дня подряд. Норсульфазол натрия 10 % раствор вводят внутривенно в дозе 100 мл 1 раз в день 2-3 дня подряд, коровам во второй половине стельности дозу уменьшают на 50%. Применяют блокады по Д.Логинову, Б.А. Баширову, Г.С.Фатееву. Внутрибрюшинное, внутривенное введение новокаина с добавлением 300-500 тыс ЕД антибиотика. При остром течении мастита кроме антибиотиков вводят внутривымянно 1% раствор стрептоцида, 1-5% раствор норсульфазола, 2-5% раствор ихтиола. Дают стрептоцид или норсульфазол внутрь в дозе 6-8 гр 2-3 раза в день в течение 3 дней. Внутривымянно вводят противомаститные препараты: лизомаст, лидем-2, (10 ЕД) 1-3 раза через 48 часов стрептоэколакт в течение 3-5 дней мастицид 10 мл 4-5 дней. Один из мастисанов А, -Б, -Е – 10 мл , дифурол А 10 мл, 3-6 дней , диоксидин 20 мл, диофур – 10 мл, 3-4 дня. Если заболевание вызвано патогенными грибами применяют нистатиновый препарат. Втирают в кожу вымени ихтиоловую, камфорную, салициловую мази 1-2 раза в сутки в течение 3-4 дней. Воспалительные отеки в молочной железе рассасываются быстрее при применении согревающих повязок, грелок, аппликаций нагретого парафина, озокерита, ультразвуковой терапии. При своевременном и правильном лечении животные выздоравливают через 3-5 дней.
Лечение коров, больных катаральным маститом.Катаральный мастит протекает в целом благоприятно, при правильном лечении через 5-7 дней наступает выздоровление. При заболевании катаральным маститом освобождают пораженную долю молочной железы от воспалительного экссудата. Для этого больную корову 2-3 раза в сутки сдаивают ручным способом, проводя одновременно легкий массаж сверху вниз. Скопившиеся в молочной цистерне сгустки, хлопья казеина разжижают путем введения в ее полость теплого 1-2% раствора гидрокарбоната натрия, соле-содового или 0,5% раствора нашатырного спирта с последующим сдаиванием через 15-20 минут. С целью полного удаления содержимого из пораженной доли вымени за 5-7 минут до доения вводят 25-30 ЕД окситоцина или питуитрина. После сдаивания в пораженную долю вводят лизомаст, лидем-2 (10 ЕД) 1-3 раза через 48 часов, стрептоэколакт в течение 3-5 дней, мастицид 10 мл – 4-5 дней, один из препаратов из группы мастисанов А, -Б,-Е, диофур А 10 мл – 3-6 дней, один из антибиотиков 100-300 тыс ЕД или в сочетании растворенных в 40-50 мл 0,5% раствора новокаина, свежевыдоенного молока из здоровых долей вымени. При необходимости антибиотики заменяют другими антимикробными средствами: фурациллин 1:5000, риванол 1:2000, растворяя их на изотоническом растворе хлорида натрия. Эффективно применение блокад по Д.Логинову, Г.С. Фатееву. Воспалительные процессы быстрее проходят после применения тепла: тепловые укутывания вымени с применением согревающих компрессов, озокерита, втирание камфорного масла ихтиоловой мази антисептической эмульсии.
Лечение коров, больных фибринозным маститом.Фибринозный мастит развивается быстро, протекает остро и в тяжелой форме, нередко принимает фибринозно-гнойный характер. Больному животному представляется покой, уменьшают дачу сочных и концентрированных кормов, проводят частое, осторожное ручное сдаивание секрета. Массаж вымени не допускают во избежание распространения воспаления на здоровые ткани. При лечении рекомендуются средства, снижающие экссудацию и проницаемость сосудов (внутривенно 10 % раствор хлористого кальция, глюконата кальция, 100 мл совмещая их с 40 % раствором глюкозы. Для уменьшения боли и улучшения трофики в тканях применяют блокады в сочетании с антибиотиками. Внутривенное норсульфазола натрия или 10% раствора этазола в дозе 100-150 мл 1 раз в день. В пораженные доли вводят антимикробные средства: один препарат из группы мастисанов, лидем-2 (10 ЕД) 1-3 раза через 48 часов, стрептоэколакт в течение 3-5 дней, мастицид 10 мл 4-5 дней, диафур А 10 мл 3-6 дней. В начале болезни вводят внутримышечно пенициллин, стрептомицин, в дозе 800 тыс. ЕД 4 раза в день 2-3 суток, бициллин-3 в дозе 8 млн. ЕД. Внутрь стрептоцид 3 раза в день первый день по 15 гр., второй – 12 гр., третий – 9 гр. В пораженные доли вводят растворы антибиотиков, фурациллина, риванола. Наружно используют антисептическую эмульсию, мази: валитер, аниксид,ихтиоловая и др. Для повышения защитных свойств организма применяют аутогемо- и тканевую терапии.
Лечение коров, больных гнойным маститом.Гнойный мастит может протекать в трех формах: гнойно-катаральный, абсцесс вымени и флегмона.
Гнойно-катаральный мастит.При остром гнойно-катаральном мастите проводят ручное сдаивание 2-3 раза в день. Сгустки и хлопья казеина скопившиеся в молочной цистерне и препятствующие сдаиванию разжижают путем внутрицистернального введения 1-2% гидрокарбоната натрия, 1-2% солесодового раствора или 0,5% раствором нашатырного спирта за 15-20 минут до доения, затем подкожно или внутримышечно применяют окситоцин или питуитрин. После сдаивания в молочную цистерну 1-2 раза в сутки вводят эмульсии или суспензии на жировой основе: мастисан, мастикур, мастицид,. С этой же целью в вымя вводят раствор пенициллина, стрептомицина, неомицина и их комбинации, а также растворы готовых лекарственных форм других антимикробных средств. При наличии высокой температуры тела и значительном угнетении инъецируют внутримышечно антибиотики в обычных дозах. С положительным эффектом используют внутривенные инъекции 10% раствора норсульфазола в дозах 100-150 мл ежедневно или через день. При тяжелых формах вводят внутривенно раствор: уротропин 15 г, стрептоцид белый – 5 г., кофеин – 2 г., вода дистиллированная до 200 мл на одну инъекцию.
При гнойных процессах вызванных протеем или синегнойной палочкой, антибиотики рекомендуется применять с препаратами, усиливающими их действие (сульфаниламиды, нитрофураны). При лечении гнойно-катарального мастита с целью предотвращения необратимых изменений в тканях молочной железы применяют сочетание интерцистернальных введений антимикробных средств с тепловой терапией, а для ускорения рассасывания инфильтратов применяют ионофорез с 3% раствором калия йодида, применение антисептических мазей. Массаж при гнойно-катаральном мастите противопоказан. При бесперспективном лечении иногда хронический гнойно-катаральный мастит следует обострить путем введения в сосковый канал 50-100 мл 5% спиртового раствора йода или 50 мл смеси равных частей скипидара и растительного масла.
Абсцесс вымени. При абсцессах вымени корове представляют покой, проводят осторожное ручное сдаивание, на вымя тепло, кожу вымени смазывают мазями Вишневского, ихтиоловой, йод глицерином. Внутрь назначают стрептоцид, норсульфазол, сульфадимезин. Внутривенно, ежедневно вливают 100-150 мл 10% норсульфазола, внутримышечно антибиотики широкого спектра действия пенициллин и стрептомицин, бициллин-1, бициллин-3 внутримышечно 10-15 тыс. ЕД на 1 кг массы тела. Поверхностно-расположенные абсцессы вскрывают путем вертикального разреза и промывают растворами риванола, фурацилина и др. Из глубоких содержимое удаляют через иглу и полость заполняют антимикробными средствами. Для повышения общего тонуса организма животному внутривенно вводят 100-150 мл 10% хлористого кальция с 100-150 мл 40% раствора глюкозы, применяют аутогемотерапию, 20 мл крови внутримышечно и другие средства общей терапии.
Флегмона вымени.При флегмоне вымени животному предоставляют покой, из рациона исключают сочные корма, Содержимое из вымени удаляют ручным сдаиванием 2-3 раза в день. Кожу пораженных участков смазывают йод глицерином, камфорным спиртом, 10% спирт-ихтиолом или ихтиоловой мазью. В начальных стадиях показано тепло, при появлении очагов гнойного расплавления тканей применение тепла прекращают, а появляющиеся гнойные полости вскрывают вертикальными разрезами, раны присыпают порошком стрептоцида, норсульфазола или трицилина, втирают жидкие антимикробные эмульсии и мази. Внутривымянно через молочный катетер вводят растворы антибиотиков: пенициллин со стрептомицином, неомицином, неомицин с тетрациклином или олеморфоциклином в дозе 300-500 тыс. ЕД в 50 мл 0,5 % раствора новокаина. Особое внимание заслуживает внутривенное введение антибиотиков в 0,5% растворе новокаина, растворов сульфаниламидных препаратов. Внутримышечно применяют антибиотики 10-15 тыс. ЕД на 1 кг массы тела 4 раза в день, цистернально один из комплексных препаратов: мастицид, мастисан и др.
Лечение коров, больных геморрагическим маститом. Геморрагический мастит развивается в течение 1-2 суток, при своевременном лечении выздоровление наступает на 7-10 день после заболевания. Животному предоставляется покой, из рациона исключаются сочные корма, ограничивается водопой. Для уменьшения проницаемости сосудов применяют внутривенные введения 10% хлористого кальция с 40% глюкозой. Внутрь назначают слабительное – глауберова соль или сернокислый магний по 300-500 гр., а также уротропин по 5 гр. На прием 3 раза в день в течение 3-5 дней, листья толокнянки – по 20 г 2 раза в день в виде отвара в течение 2-3 дней. Внутримышечно пенициллин и стрептомицин 800 тыс. ЕД 4 раза в сутки в течение 2-3 дней. Внутрь – стрептоцид 3 раза в день, первый день по 15 г, второй – 12 г, третий – 9 г. Одновременно с общей стимулирующей терапией пораженной четверти вымени после сдаивания вводят в сосковый канал антимикробные, противомаститные препараты. Для разжижения кровяных сгустков в сосковый канал вводят 100-150 мл 3% содового раствора или 1 г пепсина на 150 мл дистиллированной воды, с последующим сдаиванием через 20-30 минут. Всего делают 2-3 введения, после каждого введения сдаивают секрет. Наружно используют тетрациклиновую мазь, оксикорт, мазь полимиксина, хиносепт, валитер, аниксид, ихтиоловую и синтомициновую и др. Мази наносят на кожу пораженной четверти в количестве 10-15 г ежедневно в течение 3-10 дней в зависимости от тяжести заболевания. Мази следует накладывать только для осторожного смазывания кожи сосков и вымени в целях дезинфекции кожных покровов, предупреждения образования мацерации и трещин. При значительной болезненности вымени и спазмах молочных протоков применяют новокаиновые блокады. В начале заболевания массаж противопоказан. При ослаблении воспалительного процесса назначают массаж с применением камфорного масла, антисептической эмульсии, теплое укутывание, парафинолечение.
Лечение хронических маститов необходимо проводить после предварительного микробиологического исследования и установления антибиотикограммы. Для повышения эффективности следует обострить мастит путем внутривымянного введения одного из раздражающих растворов: 3-5 % раствор хлористого натрия, сульфата натрия, сульфата магния или 0,1 % раствора йода. После применения этих растворов следует назначать антимикробные препараты. При хронических стрептококковых маститах у животных часто наступают необратимые процессы (соединительно-тканные зарощения молочных ходов), таких животных следует выбраковать.
Лечение у коров специфических маститов.Воспаление молочной железы, возникающие при ящуре, туберкулезе, актиномикозе и других заболеваниях называются специфическими. При этих заболеваниях проводят общие противоэпизоотические мероприятия согласно соответствующих инструкций, наставлений, методических указаний.
Ящурный мастит. При заболевании коров ящуром афтозное поражение локализуется и на молочной железе. Чаще всего пузырьки располагаются на коже соска и у оснований сосковой цистерны, затем переходят на слизистую оболочку соскового канала, цистерны, молочных ходов и альвеол. Вследствие чего возникает катаральное или гнойное воспаление с образованием некротических участков. Маститы при ящуре осложняются вторичной инфекцией и протекают по типу тяжелых гнойно-катаральных и гнойно-некротических процессов. При лечение афты, затем язвочки обрабатывают противомикробными эмульсиями или 5 % спиртовым раствором йода. В случае сильной болезненности за 20-30 минут до доения пораженные участки кожи смазывают 3 % раствором новокаина или 3-5 % новокаиновой мазью. В необходимых случаях выведения молока обеспечивается через молочный катетер, предварительно введя корове подкожно 20-25 ЕД окситацина.
При ящурном мастите терапевтические меры принимают как и при других формах мастита.
Актиномикозный мастит. Актиномикоз вымени развивается после внедрения в его ткани лучистого грибка. При лечении актиномикозные очаги и окружающие ткани обкалывают антимикробными (в сочетании – пенициллин, стрептомицин и др.) в обычных терапевтических дозах в течение 3-4 дней. Поверхностные гнойные очаги вскрывают, свищевые ходы и капсулы выскабливают и орошают раствором Люголя или 5 % раствором йода. Внутрь животному вскармливают ежедневно 5-6 г йодистого калия, а с наступлением улучшения дозу препарата уменьшают на 1-2 г.
Кандидомикозный мастит. Кандидомикозный мастит часто является следствием применения антибиотиков. Маститы протекают по типу серозно-катаральных, катаральных и гнойно-катаральных воспалений. При маститах грибкового происхождения ранее рекомендованные лечебные приемы не дают эффекта. При лечение таких маститов используют внутрицистернально 0,5-1 % взвесь нистатина, леворина.
Туберкулез вымени. Туберкулез вымени проявляется образованием одиночных или множественных плотных безболезненных очагов или диффузным уплотнением всей четверти (или половины )вымени. При уточнении диагноза туберкулинизацией и микробиологическим исследованием больных животных, независимо от продуктивной ценности, выбраковывают.
Профилактика маститов. Заболевание коров маститом тесно связано с общим состоянием здоровья животных, которое в свою очередь зависит от многих факторов окружающей среды. При этом наиболее важными факторами, играющими роль в возникновении мастита, является естественная резистентность животного, микробный фактор, а также гигиена содержания, кормления и доения и др.
Многочисленными исследованиями отечественных и зарубежных исследователей, а также исследования, проведенные нами, показывают, что одностороннее ветеринарное обслуживание не может привести к ощутимым результатам в снижение заболеваемости маститом, так как при этом не ликвидируется первопричина, приведшая к возникновению воспаления молочной железы, а также не устраняются факторы, влияющие на состояние организма животного.
В целях успешной профилактики маститов необходимо выполнять определенные организационно-хозяйственные, ветеринарные и зоотехнические мероприятия. Условия кормления и содержания в значительной степени влияют на заболеваемость маститами. Не следует допускать, однообразного силосно-концентрированного кормления животных, скармливания заплесневелых испорченных и мороженых кормов, которые могут вызывать заболевания желудочно-кишечного тракта. Избегать резкого перехода от одного вида кормов к другому, что часто бывает в начале пастбищного периода. Перед выгоном не лагерное содержание или началом использования зеленной массы, животным скармливать по 1-2 кг сена, соломы.
Кормление животных должно проводится в соответствии с нормами и учетом продуктивности, периода лактации, состояния организма. Рацион должен удовлетворять потребность животных в белках, углеводах, минеральных веществах и витаминах.
Установлено, что коровы с низким содержанием витамина А и каротина в крови предрасположены к маститам в большей степени, чем с высоким. При проведении опытов по определению влияния добавок в корм витамина А и В – каротина было выявлено, что у коров с меньшей концентрации витамина А и каротина в крови мастит протекает в более тяжкой форме, часто возникает перед отелом или сразу после отела. При добавлении витаминов повышаются защитные силы организма, и снижается заболеваемость маститами.
Для повышения общей и локальной (вымени) резистентности организма используют подкожное введение селеносодержащего препарата: де полена 2 мл на 100 кг 1 раз на 7-8 месяце стельности. В «БелНИИЭВ им. С.Н. Вышелесского» разработан Комплексный минеральный препарат (КМП) в состав которого входят Fe, J, Mg, Se. Препарат вводят коровам и нетелям в лактационный период и за 25-45 дней до отела в дозе 15-20 мл. При введении у животных повышаются факторы неспецифической резистентности. Применение препарата коровам профилактируют воспалительные процессы в вымени до 90,0 %.
Положительные результаты получены при использовании синергетической смеси (0,5-1 % селенит натрия на 0,5 % растворе новокаина с добавлением 14-16 % формазина) в дозе 5-6 мл трехкратно за 15; 10 и 5 дней до отела.
Для профилактики инфицирования молочной железы микроорганизмами после пробного сдаивания соски вымени обрабатывают асептуром, йодофором 5 % настойкой йода. При профилактике послеродовых отеков мастита первотелах рекомендуется проводить массаж 1-2 раза в день по 5-7 минут. Его проводят специально закрепленные доярки вручную или с помощью пневматического массажера вымени АМП-1. Массаж начинают с 6,5-7 месяцев стельности и заканчивают за 15 дней до отела. Это мероприятие способствует также повышению удоев на 15-20 %.
За две недели перед отелом и после него из рациона коров исключают сочные корма, сокращают или исключают дачу концентратов, заменяя доброкачественным сеном. Исходя из состояния вымени, с 5-7 дня после отела (при отсутствии мастита) постепенно вводят сочные корма и концентраты.
Запуск проводят с учетом молочной продуктивности животного. Если корова перед запуском дает не более 3 литров молока в сутки, то первые 2-3 дня ее доят один раз в день, затем через день, через 2 дня, после этого прекращают доить.
Установлено, что около 70 % заболеваний вымени, возникающих впервые две недели сухостойного периода, зависит от постепенности запускания. Если в последний день лактации удой превышал 3 кг, то маститы впервые две недели сухостойного периода возникли в 2 раза чаще, чем при удое, равном 0-2 кг.
С окончанием запуска обследуют всех коров на наличие у них клинического и скрытого мастита. При отсутствии контроля мастит остается незамеченным, но обнаруживается сразу после родов, и лечить его в этот период трудно. В период сухостоя проверяют состояние вымени 2 раза в месяц, а за неделю до отела через 2-3 дня клиническим обследованием и пробным сдаиванием.
В борьбе с маститом важно проводить изоляцию больных животных, так как прекращение изоляции больных животных приводит к увеличению с 2,7-7,2 до 16,4-34,7 инфицированных животных. Сухостойный период должен продолжиться не менее 50 дней, а для высокопродуктивных молодых и плохой упитанности до 60-75 дней. Большую роль играет представление коровам регулярных прогулок, что является одним из важнейших условий предупреждения послеродовых заболеваний. Нельзя выводить животных на прогулки сразу после доения. Для обеспечения прогулок животным, как при привязном и беспривязном содержании, оборудуются выгульные площадки с твердым покрытием из расчета 8 м2 на каждую голову. Площадки оборудуют из расчета 50-60 коров. Поверхность площадок должна быть влагонепроницаемой, гладкой, не скользкой.
Коров в родильные отделения переводят за 10-12 дней до отела и возвращают через 8-10 дней после отела. Перед переводом их чистят, замывают загрязненные участки кожи, дезинфицируют половые органы раствором марганцево-кислого калия 1:1000.
При пополнении стада формируют отдельные группы из нетелей и первотелок, содержат их в отдельном помещении и приучают к двухразовому доению, при котором коровы реже болеют маститом. Двухразовое доение коров, при правильном кормлении, содержании и доении не снижает продуктивности, а затраты труда уменьшаются на 30 %, упорядочивается рабочий день и время отдыха доярок, а удой практически не уменьшается. Трехразовому доению подвергает только высокомолочных коров с удоем 4 тысячи и более.
В профилактике важными факторами являются: защита вымени от травмирования, переохлаждение, отсутствие скученного содержания коров, поддержания чистоты в скотных дворах, обеспечение чистой подстилкой, регулярная чистка животных, обмывание загрязненных частей тела, регулярное проведение санитарных дней и профилактической дезинфекции. От санитарного состояния помещений и животных зависит распространение в окружающей среде возбудитель мастита. Особое внимание уделяется качеству подстилки и своевременной уборке навоза. Подстилка должна быть влажной, теплой и мягкой. В качестве подстилочного материала используют сухую солому, древесные опилки, стружку, торф. При содержании на торфяной подстилке с добавлением 30 % соломы, толщиной 30-40 см, сменяемой два раза в месяц, заболеваемость маститами значительно ниже, чем при содержании на деревянном полу. В качестве подстилки используют верховой (сфагновый торф), не пригоден низинный с повышенной влажностью. Чтобы не снижалось качество молока, торфяную подстилку лучше применять на фермах, имеющих изолированные площадки, где строго соблюдаются ветеринарно-санитарные правила по уходу за выменем коров, доильной аппаратурой и молочной посудой.
Для поддержания надлежащего санитарного состояния на фермах один раз в неделю проводят санитарный день. Два раза в год весной и осенью делаю профилактическую дезинфекцию коровников. Дезинфекция полов один раз в месяц в местах содержания дойных коров позволяет снизить заболеваемость на 23 %. В родильном отделении еженедельно проводят тщательную механическую очистку и дезинфекцию. Проходы в родильных помещениях регулярно посыпают известью пушенной.
В помещениях, в которых содержатся лактирующие и сухостойные коровы поддерживается требуемый микроклимат. Повышенное содержание в воздухе углекислоты, аммиака, сероводорода и других газов тормозит секрецию молока, способствует уменьшению в нем жира и предупреждает к заболеванию коров маститами. Вентиляцию в коровнике должен обеспечивать воздухообмен не менее 70-85 м3/час на одну корову. В холодное время температура воздуха в коровнике должна быть 8-10 0С, относительная влажность 75%, допустимая концентрация СО2 – 0,25%, NН3 – 20 мг/м3, Н2S – до 10 мг/м3.
Контроль за доением.Для машинного доения наиболее пригодны коровы с ванно-образной и чашеобразной формы, правильно развитыми долями и сосками длиной 5-9 см, цилиндрической формы и диаметром 2,5-3 см, расположенными под прямым углом к вымени.
Доение коров следует проводить по графику в строго определенное время, всегда в той же последовательности. Для этого стада используют только однотипные аппараты в течение всей лактации независимо от местонахождения коров. Нагрузка на одну опытную доярку не более 3-4-х аппаратов.
Важен подбор животных по свойствам молокоотдачи. К ним относятся: соотношение удоев из передних и задних четвертой скорости доения, полнота выдаивания. Разница во времени выдаивания отдельных долей не должна превышать 2 мин. для трехкратных аппаратов, 1 мин. для двухтактных. Скорость выдаивания должна составлять 1 кг/мин. и выше. Время выдаивания 5-6 минут одного животного, а продолжительность разового доения коров на ферме не должна превышать 3 часов, на пастбище 2 часа.
Преддоильную обработку вымени проводят чистой водой (30±50С) в течение 10-15 сек., обсушивают индивидуальной салфеткой или отжатым от воды чистым полотенцем в течение 6-8 сек. И заканчивают массажем в течение 20-25 сек. Общая продолжительность времени на подготовку вымени должна быть не менее 40 и не более 50-60 сек. При удлинении этого срока нарушается рефлекс отдачи молока и получается недодой, который препятствует нормальной секреции молока, кроме того не выдаивание молока приводит к застою и раздражению тканей молочной железы.
При обмывании вымени группы коров из ведра, вода должна меняться через каждые 5-7 животных. Исследования показали, что в несменяемой воде после обмывания вымени одной коровы содержится от 14 до 417 тыс. бактерий в 1 млн., пяти от 560 тыс. до 5 млн., десяти до 20 млн. бактерий.
После подготовки вымени к доению сдаивают в течение 5-6 сек. первые струйки молока из каждой доли только в специальную кружку с черным ситечком для выявления мастита (наличие хлопьев, гноя, сгустков), при не выявлении патологии сразу надевают доильные стаканы. Не допускается сдаивание первых струек молока на пол, в связи с тем, что они содержит высокое содержание микрофлоры, которая может стать источником инфицирования. Они собираются в отдельную емкость и подвергаются после доения кипячению.
После преддоильной обработки вымени надевают на соски доильные стаканы, помытые в горячей воде до температуры 38-400С. Холодные стаканы тормозят рефлекс молокоотдачи, что способствует уменьшению удоя.
Доильные стаканы надевают только на здоровые четверти вымени. Стаканы, соответствующие больным четвертям, закрывают специальными пробками. Больные четверти выдаивают вручную в специальную емкость с последующим уничтожением секрета. Молоко, полученное от животных, которым вводили антибиотики и химиотерапевтические препараты парентерально, запрещается использовать для пищевых целей. Такое молоко используют для кормления молодняка животных после его термической обработки. При интрацистернальном введении препаратов из смежных здоровой четверти используется без ограничения. Сроки браковки молока определяется в соответствии с рекомендациями по применению препаратов.
Доярки постоянно должны следить за положением доильных стаканов во время доения. При обнаружении наползания стаканов на вымя их оттягивают за коллектор вперед и вниз. При спадении стаканов – отключают вакуум, споласкивают загрязненные стаканы в горячем дезрастворе (0,5 % раствор хлорамина, дезмола и др.), ополаскивают горячей водой и только после этого слегка промассажировав вымя и снова надевают на соски.
После завершения процесса молокоотдачи проводят машинное додаивание в течение не более 30 сек., для чего доильные стаканы за коллектор оттягивают вперед и вниз с одновременным контролем, и при необходимости, массажем четвертей вымени. После окончания доения доильные стаканы снимают с вымени, только предварительно отключив вакуум. Снятие стаканов под вакуумом травмируют соски. Ручное доение после машинного доения практиковать не следует, так как это приучает коров к неполной отдаче молока в доильный аппарат. При правильном подборе и приучении животных к машинному доению, строгом выполнении правил доения коровы выдаиваются без ручного додаивания. Доение в холостую (задержка со снятием доильных стаканов по окончанию доения) вызывает обратный ток молока, особенно на доильных установках с высоко установленным молокопроводом, что может способствовать переносу маститогенной микрофлоры от больной маститом коровы к здоровым, вызывает сильное травматическое повреждение, приводящие к раздражению вымени.
При значительном распространении мастита (более 10 %) среди коров проводят промежуточную дезинфекцию доильных аппаратов после выдаивания каждой коровы. Для этого операторам выдается пронумерованных 3 ведра: 1-ое – для подмывания, 2-ое – с раствором гидрохлорида натрия или осветленного раствора хлорной извести с содержанием 0,03 % активного хлора и 3-ее – с чистой водой для отмывания стаканов от дезинфектанта.
Дезинфекцию проводят путем погружения доильных стаканов в дезинфицирующий раствор (ведро 2-ое) с температурой 60±50С на 30 сек., после чего для удаления остатков дезраствора аппараты погружают в горячую воду (ведро 3-ее). После снятия доильных стаканов с сосков на их кончиках имеются остатки молочка, которые могут создавать благоприятные условия для размножения микроорганизмов. Микробы могут проникать по каналу сосков вымя и вызывать мастит. С целью профилактики проводят дезинфекцию сосков вымени асептуром или одним из дезинфицирующих растворов (антисептическая эмульсия, хиносепт, 0,5-1 % раствор однохлористого йода, йодофора и др.). Для выполнения данной операции используют прибор, состоящий из пластмассовой бутылки для дезраствора, емкостью 300 мл и стаканчика для погружения сосков соединенных посредством винтовой резьбы. При обработке сжимают флакон до тех пор пока дезинфицирующая жидкость не потупит через имеющуюся в приборе трубку в верхний стакан. Затем в дезраствор погружают поочередно соски на 1-3 сек., после чего соски не вытирают. Затрата времени на обработку одной коровы 6-8 сек. При отсутствии прибора соски протирают чистой салфеткой или полотенцем, смоченным в одном из перечисленных дезсредств.
В РУП «БелНИИЭВ им. С.Н. Вышелесского» предложили для санации сосков вымени после доения препарат гринтач, действующим началом которого являются комбинация карболовых клеток биологического происхождения. Средство относится к мало опасным соединением (IV класс по Гост 12.1.007-76), неограниченно растворим в воде, рабочие растворы стабильны в течение 3 суток при хранении в закрытых емкостях. Обработку сосков вымени для снижения микрофлоры проводят постоянно после каждого доения путем погружения в стаканчики с 0,3-0,5 % раствором гринтач на 1-3 сек., нанесением раствора ватно-марлевыми тампонами или с помощью распылителей. Бактерицидное действие сохраняется на коже до очередного доения коров. При постоянном применении препарат не оказывает раздражающее действие на кожу, не оказывает аллергическим свойствам. Для ежедневной дезинфекции сосков вымени применяют инкрасепт 10А в 0,3% концентрации.
При наличии трещин, ссадин и ран сосков вымени обрабатывают раствором марганцовокислым калием 1:1000, риванола (1:1000-2000) или раствором перекиси водорода. После этого пораженные участки обрабатывают 5 % раствором настойки йода или 1 % спиртовым раствором пиоктанина. Высоким дезинфицирующим, анестезирирующим, ранозаживляющим, а так же профилактическим эффектом обладают мази валетер и аниксид, прополисная мазь и др.
Контроль за состоянием доильных установок. Перед доением следует проверять исправность каждого доильного аппарата. Необходимо обращать внимание на эластичность сосковой резины, заменять резину с трещинами, шероховатую, жесткую. Сосковая резина защищает поверхность сосков от воздействия напряженного вакуума и массирует ткань во время сжатия, благодаря чему поддерживается циркуляция крови и клеток в соске. При длинной сосковой резине соски сильно вытягиваются. Зазор между соском и резиной должен быть не более 3 мм. Замена сосковой резины должна проходить через каждые 6 месяцев. Запрещается использовать в одном комплекте детали от других марок и модификаций доильных аппаратов, а так же разные марки аппаратов на одной доильной установке, неправильно работающим или имеющие большой износ доильные машины, это приводит к резкому увеличению животных больных маститом. При доении вакуум не должен превышать 380 мм рт.ст. (0,54 кг с/см2 при доении трехкратными и 360 мм рт.ст. (0,49 кг с/см2 при доении двухтактными аппаратами).
Величина вакуума для доильных установок АД-100А, УДС-3А с аппаратом «Волга» должна быть 400 мм р. ст. (0,54 кг с/см2); для ДАС-2, ДАС-2Б с аппаратами АДУ-1, ДА-2-360 (0,49); для АДМ; в молоко проводе – 370 (0,50), в вакуум – проводе 340 (0,46) для УДЕ-2А, УДТ-8, УД-10 345мм рт.ст. (0,47). Для других доильных установок согласно паспорта.
Вакуумные установки имеют градуировку в мм рт.ст., но и единицах Паскаля (КПА-килопаскали). Для пересчета единиц измерения пользуются таблицей, по которой можно сделать перевод из одних единиц в другие (табл. 19).
Таблица 19
Данные перевода показаний вакуумметра при градуировке кг/см2 мм.рт.ст. или кПА (Килопаскали)
| Единицы измерения | |||||
| Кг/см2 | мм рт.ст. | кПА | кг/см2 | мм рт.ст. | кПА |
| 0,40 | 0,50 | ||||
| 0,46 | 0,54 | ||||
| 0,47 | 0,68 | ||||
| 0,49 |
При подготовке доильных аппаратов необходимо проверить частоту работы пульсаторов. Частота пульсаций для трехтактных доильных аппаратов должна составлять 60±5 двойных пульсов в минуту; для двухтактных 70±5, аппараты «Волга» 60±5, АДУ-1 - 65±5. Для других согласно паспортных данных доильной установки.
Для контроля периодически необходимо проверять величину вакуума переносным манометром с резиновой трубкой.
Для создания резерва вакуума (плюс 15 % к норме расхода) на концах вакуумных линий устанавливают рессиверы (емкости) объемом 100-200 л.
Обследование ферм колхозов и совхозов показывает, что обслуживанию доильных установок не везде уделяется должного внимания. Наиболее распространенными нарушениями являются: сверхнормативный износ вакуумных насосов, уменьшение проходного сечения магистральных участков вакуумного трубопровода из-за поставки ненужных вентилей, сплющивания труб на изгибах и соединение их методом сварки, деформации резиновых соединений соединительных муфт, наличие постоянных подъемов молокопровода над центральным переходом в молочное отделение и кормовыми проходами в коровнике; прососы воздуха в соединениях труб молоко провода и отсутствие уклонов в сторону молочной; использование в доильных аппаратах сплющенных молочных шлангов; неисправные манометры, неправильно отрегулированные регуляторы и пульсаторы доильных аппаратов. Эксплуатация резины с неодинаковым износом в одном аппарате.
В настоящее время в принципе плохих машин нет, а имеет место их неудовлетворительного использования. Известно, что результаты профилактики мастита в значительной мере зависят от субъективного фактора – специфических массовых профессий (доярки, слесаря и др.) их квалификации, трудовых навыков и отношению к выполнению своих обязанностей. Именно поэтому имеется разница в степени заболеваемости отдельных групп коров, обслуживаемых разными доярками. При проверках на заболеваемость маститами нами установилось, что на одной и той же ферме количество животных, пораженных маститом, в группах одинакового возраста, но обслуживаемых разными доярками колеблется от 4 до 50 %.
Как правило, техническое обслуживание доильных установок проводит инженерная служба, слесарь-оператор фермы во время работы. Они мало знакомы с физиологическими особенностями молочной железы коров и последствиями, к которым ведет неправильно работающие доильные установки. В связи с этим ветеринарные специалисты с целью выяснения и устранения причин заболевания вымени и получения молока высокого качества должны периодически подвергать контролю правильность работы доильного оборудования. Уметь контролировать правильность работы доильного оборудования – это не значит подменять и выполнять обязанностей инженерной службы. Обладая знаниями и разными приборами, ветеринарные специалисты правильно могут определить причину заболевания вымени и своевременно сигнализировать об ее устранении.
Санитарная обработка. Для профилактики маститов необходимо строго соблюдать режимы по уходу за доильными установками и молочной посуды. Мойка доильного оборудования, снятие молочного камня с молоко проводящих путей проводится согласно «Правил машинного доения» (г. Минск, 1990). Систематически проводят контроль за санитарным состоянием доильных установок, обращая внимание на загрязнение сосковой резины, коллектора молочного шланга, крышек и прокладок доильных ведер, смотровых устройств, труб молокопровода, фильтров, охладителей и молочных насосов, которые больше всего загрязненные в процессе эксплуатации.
«БелНИИЭВ им. С.Н. Вышелесского» предложили для дезинфекции молочного оборудования нового дезинфицирующего средства Инкрасепт-10А. В состав препарата входит 9 % дезинфектанта полигексаметиленгуанидин гидрохлорид, поверхностно активное вещество. Установлено, что препарат в рабочих растворах 0,1 % и 0,5 % водных растворах губительно действует на культуры кишечной палочки, стафилококка золотистого, стрептококка фекального и протея вульгарного при микробной нагрузке 0,5-2 млрд. клеток и экспозиции 7-30 мин. В смывах с молочных проводов доильных аппаратов и молочных токов после мойки дезосредством Инкрасепт-10А в 0,5 % концентрации микробная обсемененность снижается на 99-100 %, в 0,1 % концентрации – на 94,3-100 %.
Ветеринарно-санитарные мероприятия. Ветеринарные мероприятия направляются на контроль за состоянием здоровья животных и вымени при комплектовании ферм и комплексов согласно существующим регламентирующим документам по диагностике и профилактике маститов у коров, санитарным правилам по уходу за молочной аппаратурой, посудой и др.
Вновь поступившие животные для комплектования фермы проходят карантинирование. За время карантина дважды исследуют коров и нетелей (на 8-9 мес. стельности) клиническими методами, а при установлении отклонений физиологической нормы и при помощи БТМ на МПК-2. Для учета физиологического состояния формируются контрольные группы коров (дойное стадо, животные в запуске) и регулярно согласно плана отбираются пробы крови коров для проведения биохимических исследований. С учетом полученных данных проводится коррекция физиологического состояния животных с использованием полисолей, витаминов. Направляются не менее двух раз в год в районную лабораторию пробы молока секрета взятые от коров в лактационный и запускной периоды, для проведения бактериологических исследований и определения чувствительности выделенных микроорганизмов к антимикробным препаратам. В плановом порядке не менее одного раза в месяц проводятся исследования коров стада на скрытые маститы с использованием БМТ (беломастин, димастин и др.). Выявленных в результате исследований животных подвергают лечению. Выздоровление коров контролируется клиническими методами и с помощью быстрых маститных тестов на 7-10 день после окончания лечения. При положительных результатах назначают повторный курс лечения. В лактационный период животным используют этиотропию, патогенетическую, физическую и комплексную терапию, сочетая два или три вида терапии. При лечении субклиническим методом маститов используют антимикробные препараты с малым сроком выделения с молоком. Хронические больные коровы, реагирующие 3-4 месяца подряд на маститный тест, выбраковывают. Перед запуском и сухостоем вводят в больные четверти вымени антимикробные средства значительно действия (орбенин, бицилин-3, бициллин-5,мастирифин, масти сан- Б, - Е. и др.) согласно наставлению. При выявлении в стаде 20 % и более коров больных маститом инфекционной этиологии перед запуском и сухостоем препарат вводят во все четверти вымени. В конце текущего месяца проводится анализ заболеваемости, прогнозирования заболевания. Анализ данных литературы показывает, что для борьбы с маститом коров в многих странах организованы специальные «Служба здоровья вымени». В ФРГ такая служба действует с 1977 года, которая в Нижней Саксонии обслуживает 38 % фермерских хозяйств. Основывалась на ежемесячном определении числа соматических клеток (ЧСК) в сборном молоке, работниками службы выявляют погрешности в использовании доильной аппаратуры, содержания животных, выявляют больных коров, проводят лечение и профилактику мастита.
Во Франции программа борьбы с маститами, разработанная ветеринарной службой сельскохозяйственной палаты. Статус поголовья по маститу оценивается по средним показателям ЧСК в сборном молоке за 6 месяцев. Состояние вымени отдельных коров определяют по ежемесячному исследованию ЧСК в каждой четверти в течение 3 месяцев. Если за этот период содержание ЧСК в молоке не превышало 300 тыс./мл, значит, животных считали здоровыми. Экономически приемлемым для фермы является содержанием в сборном молоке соматических клеток ниже 400 тыс./мл. Для подотчета ЧСК в молоке используют электронные счетчики-автоматы.
В Республике Беларусь исследование на содержание соматических клеток в сборном молоке проводятся на молочных заводах, согласно существующего ГОСТа, 1 раз в 10 дней, на приборах типа «Соматос», с использованием мастоприма. Отдельные Госплемстанции (межрайонная Ивацевичская, районная Любанская и др.) оснащены высокопроизводительными автоматическими анализаторами «Фоссаматик». Статус поголовья на маститную ситуацию оценивается по сборному молоку, полученному во время контрольной дойки 1 раз в месяц в течение года. По результатам исследования в хозяйствах принимаются соответствующие мероприятия по снижению высокого уровня соматических клеток в молоке коров.
Контроль качества заготовляемого молока (определение сортности молока) по количеству содержания в нем соматических клеток должен вестись постоянно путем исследования каждой партии молока, отправляемой на перерабатывающие предприятия исследования проводят на МПК с помощью 20 % растворе сульфата, 2,5 мастапрама, беломастина. В сборном молоке взятых из любых емкостей (цистерн, толков, фляг и др.) узнают от какой группы коров в одном (содержащихся в помещении, обслуживаемых одной дояркой и т.д.). Получено молоко с повышенным содержащим соматических клеток. Затем в их коров данной группы проверяют на заболеваемость маститом путем исследования их молока (пробу из удоя каждой коровы) и у реагирующих положительно исследуют пробы молока, полученной из каждой четверти отдельно, используя БМТ.
Независимо от указанных исследований диагностику начальных стадий маститов и скрытых периодов у всех коров проводят ежемесячно.
С целью снижения содержания соматических клеток в сборном молоке необходимо использовать данные учета клеток в молоке отдельных животных с помощью больной системы. Так при содержании до 0,5 млн./мл. корове присваивается 0 балов, что не ведет за собой никаких последствий, если обнаружено от 0,5-1 млн./мл. – 1 балл, а более 1,0 млн./ мл. –2 балла животные набравшие 1 и 2 балла подвергаются лечению. В случае, когда коровы в течение лактации три и более раз реагирует на 1 балл, то кроме текущего лечения в пораженные четверти в период сухостоя вводят антимикробное средство. Когда животные три и более раз за лактацию реагируют на 2 балла, то его выбраковывают.
Осуществление, таким образом борьба за снижение соматических клеток в молоке приводит к уменьшению числа случаев заболевания коров маститами, причем не только в данном стаде, но и у дочерей этих коров, поскольку в данном случае идет выбраковка предрасположенных к маститу коров.
Маститы коров, не смотря на большое количество исследований по разработке средств диагностики, лечения и профилактики, остаются источниками значительных потерь в молочном скотоводстве во всех высокоразвитых странах. Имеющийся опыт борьбы с маститами коров основанный на проведении отдельных, часто разовых мероприятий по диагностике и профилактике, показал их незначительную эффективность. Поэтому организация плановой системы мероприятий по борьбе с маститами может позволить значительно снизить заболеваемость животных, увеличить производство молока, повысить его пищевые и санитарные качества и снизить себестоимость продукции. Система мероприятий по профилактике маститов должна включать: кормление и содержание животных, отвечающие зоогигиеническим требованиям и исключающие травмирование и инфицирование вымени; подбор коров, пригодных к машинному доению; выявление быков-производителей и семейств, обладающих устойчивостью к заболеванию маститами; соблюдать технологию машинного доения; четкое обслуживание доильной аппаратуры и режимов ее работы (стабильный вакуум, частота пульсаций); регулярно обрабатывать доильную аппаратуру и производить преддоильную обработку вымени с использованием моюще-дезинфицирующих средств, хлорсодержащих препаратов, иодофоров; ежемесячно обследовать коров с использованием быстрых маститных тестов (беломастин, димастин и др.), вести контроль за содержанием соматических клеток в сборном молоке; своевременное лечение лактирующих и сухостойных коров; постоянно контролировать эффективность лечения; своевременно выбраковывать из стада не поддающих лечению и часто болеющих коров; проводить бактериологические исследования в ветеринарных лабораториях с целью выделения патогенных возбудителей и определению их чувствительности к антимикробным средствам и выбора наиболее эффективных препаратов.
ЗАБОЛЕВАНИЯ РЕПРДУКТИВНЫХ ОРГАНОВ КОРОВ И ИХ ПРОФИЛАКТИКА
оРГАНИЗАЦИЯ РАБОТЫ ПО АКУШЕРСТВУ И ГИНЕКОЛОГИИ В животноводстве улучшение организации интенсивного воспроизводства стада на фермах и комплексах предусматривает планомерную…Андрологическая диспансеризация
После регистрации производителя собирают анамнестические данные: время содержания в хозяйстве или на племпредприятии; уход и содержание, рацион… При общем исследовании определяют конституцию, упитанность, темперамент,… У животных с хорошей и высокой воспроизводительной способностью (плодовитостью) мошонка симметрична, безболезненна,…Общие принципы лечения при акушерско-гинекологической
Патологии
Лечебный пункт состоит из манежа, операционной, стационара, аптеки, кабинета врача и подсобных помещений (душевая, стерилизационная, фуражная и… Лечебный пункт обеспечивается всеми необходимыми инструментами, медикаментами… При лечении больных животных перед ветеринарным врачом стоят две задачи — сохранить жизнь, продуктивность самок и…Берменность и болезни беременных животных.
Беременность (Graviditas) — физиологическое состояние организма самки в период плодоношения, т. е. с момента оплодотворения до рождения зрелого… Беременность может быть одноплодной, многоплодной, первичной и повторной. По… Внутриутробное развитие организма животного делят на три стадии: бластулы, эмбриональную и фетальную. Стадия…Ректальный метод диагностики у коров
Рис. 1. Половые органы при одномесячной беременности. Два месяца: шейка матки смещена к входу в таз. Рога матки расслаблены, свисают в брюшную полость, межроговая бороздка…Метод ранней диагностики стельности коров по содержанию прогестерона в молоке
На 19-21-й день после осеменения концентрация прогестерона в молоке и стельность находятся в следующей зависимости: -стельные – 10,1 нг/мл и более; -сомнительные – 6,1-10,0 нг/мл;Признаки беременности у кобыл при ректальном исследовании
Один месяц: беременный рог внизу, около борозды расширяется до величины утиного яйца; борозда между рогами становится неровной, в месте расширения… Два-три месяца: беременный рог у своего основания расширен и отчетливо… Четыре-пять месяцев: яичники не прощупываются; матка лежит по длине живота и пальпируется на уровне четвертого…Диагностика беременности у овец и коз
Метод пальпации живота.Прощупать плод через брюшную стенку удается с 3-го месяца суягности. Животные перед исследованием должны быть выдержаны на… Для облегчения обнаружения плодов рекомендуется несколько сильнее надавливать… Ультразвуковой метод. Для определения беременности у овец и коз, а так же у свиней и сук используют ультразвуковые…Диагностика беременности у свиней
Метод пальпации живота . Применяется с 3-го месяца беременности, но прощупать плоды через брюшную стенку удается лишь у свиноматок ниже средней… Ультразвуковой метод считается одним из наиболее перспективных для… Свиней исследуют как в лежачем, так и в стоячем положении. Ультразвуковую головку прикладывают к брюшной стенке вдоль…Диагностика беременности у собак и кошек
Ультразвуковой метод применяют у сук с 32-35-го дня после оплодотворения. Для регистрации сердцебиений плодов ультразвуковую головку прибора…Диагностика беременности у крольчих
Метод пальпации живота. С 12-го дня после оплодотворения пальпируются ампулы матки величиной с лесной орех или вишню. Крольчиху для пальпации…Продолжительность беременности у животных
Патология беремнностти
Аборт
Аборт (Abortus) - это прерывание беременности с последующим полным или частичным рассасыванием зародыша либо с изгнанием из половых органов мертвого (выкидыша) или незрелого плода (недоноска). Аборты наблюдаются у всех видов сельскохозяйственных животных.
По времени возникновения аборты бывают ранние и поздние.
По клиническому течению все аборты подразделяются на полные, неполные, привычные и скрытые. Полный аборт (Abortus completus) - изгнание из матки недоносков или гибель всех плодов с последующим их рассасыванием, изгнанием, мумификацией, мацерацией или путрификацией. У одноплодных животных полным абортом называют изгнание из матки плода вместе с плодными оболочками. Неполный аборт (Abortus incompletus) - изгнание, рассасывание, мумификация или мацерация одного или нескольких плодов с донашиванием и последующим рождением оставшихся в матке. У одноплодных животных неполный аборт проявляется изгнанием из матки плода и задержкой плодных оболочек. Привычным абортом называют такой аборт, который постоянно повторяется при каждой очередной беременности на одной и той же стадии ее развития. Скрытый аборт (Abortus latentus) - характеризуется гибелью эмбрионов с последующим их рассасыванием без клинически выраженных признаков. Может быть полным или неполным.
Общие симптомы и течение абортов.
Предвестниками позднего аборта могут быть угнетение, снижение аппетита, набухание наружных половых органов, гиперемия слизистой оболочки влагалища,… Иногда мертвый плод не изгоняется, а задерживается в матке и подвергается в… Некоторые аборты имеют свои особенности, поэтому целесообразно эти виды абортов рассмотреть более подробно.Симптоматические аборты
Под скрытым абортом понимают гибель зародышей на ранней стадии развития с последующим их рассасыванием вместе с плодными оболочками. Эта патология… Этиология. Наиболее частой причиной эмбриональной смертности могут быть… Симптомы и течение. Скрытый аборт протекает без явных клинических признаков. При этом каких-либо выделений из половых…Идиопатические аборты
Инфекционные и инвазионные аборты
Аборты при бруцеллезе
Диагноз. Для постановки диагноза проводят бактериологическое, серологическое или аллергическое исследования. Для лабораторных исследований…Аборты при лептоспирозе
Диагноз. Для лабораторных исследований используют: - кровь (на третий - пятый день болезни при повышении температуры тела ),… а) для выявления лептоспир в моче, цитратной крови, тканевой суспензии или в срезах из органов, окрашенных серебром по…Аборты при листериозе у свиней
Диагноз. Для лабораторных исследований направляют: - трупы мелких животных или голову (головной мозг ), паренхиматозные органы,… - сыворотка крови для выявления антител в РН и РСК.Аборты при микоплазмозе свиней
Диагноз. Для лабораторных исследований используют: - бронхиальные лимфоузлы и легкие с очагами серозно-катарального воспаления,… -сыворотка крови от больных и переболевших животных для выявления антител в РДСК в микрообъеме, РА и РНГА.Аборты при хламидиозе
Диагноз. Для лабораторных исследований используют: - абортированные или мертворожденные плоды, плодные оболочки с участками… - от павших животных берут кусочки паренхиматозных органов, лимфатические узлы для обнаружения элементарных телец…Аборты при трансмиссивном гастроэнтерите свиней
Диагноз. Для лабораторных исследований используют: - пробы фекалий, тонкий кишечник с содержимым от поросят в начальной стадии… - сыворотку крови от свиноматок с патологией воспроизводства для выявления антител в РН, РНГА, РТГА;Аборты при энтеровирусной инфекции у свиней
Диагноз. Для лабораторных исследований используют: - фекалии, ректальные смывы или соскобы слизистой оболочки прямой кишки от… - кусочки пораженных участков тощей, подвздошной, ободочной и прямой кишок, а также мезентеральных лимфатических узлов…Аборты при классической чуме свиней
Диагноз. Для лабораторного исследования направляют пробы крови, кусочки миндалин, селезенки, почек, легких, лимфатические узлы, костный мозг грудной…Аборты при Болезни Ауески
Диагноз. Для лабораторных исследований направляют трупы поросят или головной мозг, кусочки паренхиматозных органов (обязательно из легких),… 1. Биопроба на молодых кроликах. В отдельных случаях, при наличии в… 2. Выделение вируса в первичных культурах куриных эмбрионов, почек эмбрионов свиней и первичной культуре СПЭВ с…Аборты при парвовирусной болезни свиней
Диагноз. Лабораторная диагностика парвовирусной болезни основана на обнаружении в сыворотке крови новорожденных поросят до приема молозива или в…Аборт паратифозный у кобыл и овец
При этом заболевании аборт у кобыл возникает на 4 - 5 – ом , а у овец и коз – на последнем месяце беременности. После аборта у кобыл и овец наблюдаются эндометриты и бесплодие.
Диагноз ставится на основании результатов серологического и бактериологического исследований абортированных плодов и органов павших животных.
Аборт при кампилобактериозе
Диагноз на кампилобактериозный аборт ставят на основании анализа клинико-эпизоотологических данных, результатов бактериологического и…Аборты при трихомонозе
У коров наблюдаются преимущественно в начале беременности (1-4 месяца). Протекают трихомонозные аборты незаметно, т. е. без предвестников. После абортов возникают эндометриты и длительное бесплодие.
Диагноз на трихомонозный аборт ставят на основании результатов микроскопического и культурального исследований выделений из влагалища и матки у абортировавших коров, а также содержимого околоплодных оболочек, ротовой полости и желудочно-кишечного тракта абортированных плодов.
Исход абортов
Рассасывание плода (скрытый аборт) (Abortus latentus). Такой аборт обычно протекает без клинических симптомов. Здесь происходит всасывание тканями… Изгнание нежизнеспособного или мертвого плода. Аборт с изгнанием недоноска… Мумификация плода (Mumificatio fetus). Под этим понимают высыхание погибшего плода в матке. Такой процесс может…Токсикозы беременных
В настоящее время токсикозы беременных животных изучены недостаточно. Представляет интерес механизм возникновения токсикоза, влияние его на… Отек беременных (Hydrops gravidarum) Отек беременных характеризуется скоплением в подкожной клетчатке и коже конечностей и нижней брюшной стенки…Предвестники родов
Превращение обычного таза самки в «родовой», заключающееся в отеке и расслаблении его связочного аппарата. Вследствие удлинения широких тазовых и…Анатомо-топографические данные по расположению плода в отношении к родовым путям
Положение (Situs) -отношение продольной оси тела плода к продольной оси тела матери. Оно бывает продольным (правильное), поперечным и вертикальным… Позиция (Positio) — отношение спины плода к брюшным стенкам матери. Позиция… Предлежание(Praesentatio) — отношение анатомической области плода к входу в таз. Различают головное и тазовое…Видовые особенности течения родов и послеродового периода
Роды у коровы (отел).Стадия раскрытия продолжается от 1 до 12 ч, стадия рождения от 20—30 мин до 3—4 ч. При двойнях второй плод выводится через… Роды у овец и коз (ягнение). Стадия раскрытия продолжается от 15 мин до 3 ч.… Роды у свиней (опорос). Стадия раскрытия шейки матки продолжается 2—6 ч. Длительность стадии рождения плодов зависит…Патология родов
Данная патология характеризуется кратковременностью и недостаточной интенсивностью сокращений мышц матки и брюшного пресса. Первичные слабые схватки и потуги являются следствием неудовлетворительного… Вторичные слабые схватки и потуги являются результатом переутомления мышц матки и брюшного пресса после слишком…Акушерская помощь при патологических родах
Клиническое обследование роженицы включает определение общего состояния и исследование всех систем организма животного. При исследовании роженицы… Живой плод реагирует на потягивание его за конечности, надавливание на глазное… После постановки диагноза составляют план акушерской помощи, который должен предусматривать подготовку ослизняющих…Правила оказания акушерской помощи животным
2. Исправление неправильных положений, позиций и члено-расположений плода проводят только в матке, для чего отталкивают плод в полость матки. 3. Перед отталкиванием на все предлежащие части плода накладывают акушерские… 4. Для облегчения отталкивания плода, особенно при сухости родовых путей, обильно смазывают плод стерильным вазелином…Акушерский инструментарий
Акушерская веревка и тесьма применяются для фиксации, исправления положения и извлечения плода. Глазные крючки применяют для исправления расположения головы и извлечения… Петлепроводник Линдгорста представляет собой железное элиптическое кольцо длиной 14 см, шириной 4 см.Акушерская помощь при неправильных расположениях головы плода
Этиология. Недостаточное раскрытие шейке матки, бурные схватки, крупноплодие и слабость плода. Симптомы и течение. В родовых путях обнаруживают передние конечности плода.… Диагноз ставят на основании результатов исследования родовых путей, таза и плода путем пальпации.Акушерская помощь при неправильных расположениях
Грудных и тазовых конечностей
Этиология. Данная патология может быть следствием слабости сокращений матки во время родов, отсутствием реакции плода на родовую деятельность и… Симптомы. Пальпацией в родовых путях находят правильно расположенную голову… Помощь. Правильно расположенную конечность и голову фиксируют акушерскими веревками. Отталкивают плод в матку и в это…Акушерская помощь при неправильных позициях и положениях плода
Симптомы. Введя руку в родовые пути, находят передние конечности, обращенные подошвами вверх или на сторону. Голова плода прощупывается у входа в… Помощь. На передние конечности и голову накладывают акушерские петли. Рукой,… У овец и коз на предлежащие передние конечности и голову плода накладывают веревочные петли и извлекают его наружу…Родовспоможение при двойнях
Симптомы. В тазовой полости находят голову плода и 3—4 конечности. Устанавливают, какие конечности направлены в родовой канал (передние или задние)… Помощь. Сначала фиксируют акушерскими веревками и извлекают верхний плод, а…Особенности акушерской помощи при патологических родах у сук
При кратком описании инструментов, применяемых при родовспоможении у сук, остановимся лишь на наиболее проверенных практикой и оправдавших себя. При извлечении плодов у сук особенно удобными являются петли, изготовленные из… предложено несколько вариантов щипцов, но ни один из них признать универсальным нельзя из-за большой разницы в…Акушерская помощь при уродствах плода
Водянка плода возникает при нарушении крово- и лимфообращения плода вследствие заболевания сердца, печени, почек. Пропитывание тканей плода… Симптомы. В зависимости от предлежания в родовых путях находят голову и… Помощь. На предлежащие конечности и голову плода накладывают акушерские петли и при незначительной водянке плод…Родоразрешающие операции.
Основными родоразрешающими операциями в ветеринарном акушерстве являются фетотомия и кесарево сечение. Такие операции, как рассечение промежности и расширение шейки матки, в практике применяются редко.
Фетотомия (Fetotomia) происходит от латинского fetus— утробный плод и tome — разрез, рассечение, т. е. родоразрешающая операция, которая заключается в рассечении плода и выведении его из родовых путей по частям. Фетотомию выполняют у крупных животных и редко у мелких жвачных при несоответствии просвета таза матери объему плода, невозможности исправления неправильных положений, членорасположений и позиций плода, при уродствах плода. Чаще эту операцию проводят на мертвом плоде и редко на живом; живой плод перед операцией умертвляют, разорвав пуповину, вскрыв сосуды шеи и таза или разрушив головной мозг.
Операция может быть проведена успешно, когда материнский организм не ослаблен, а родовые пути без воспалительных процессов. Акушер должен иметь соответствующий набор инструментов, хорошо владеть приемами фетотомии и строго соблюдать правила асептики и антисептики.
Существует два основных метода фетотомии — открытый, или одномоментный, и закрытый, или двухмоментный (подкожный). При проведении операции открытым методом режущая часть фетотома вводится между поверхностью кожи плода и стенкой матки. В процессе операции легко можно ранить родовые пути роженицы и нанести травму руке акушера. В то же время этот метод более прост для выполнения и может проводиться при отсутствии специальных инструментов — скальпелем, острым ножом и др.
Закрытый метод проводят в два этапа: сначала отпрепаровывают кожу на конечностях или голове плода, а затем при помощи фетотома ампутируют находящиеся в родовых путях конечности плода; режущая часть фетотома закрыта кожей плода.
Для выполнения операции требуются специальные инструменты (кожный нож, шпатель), она является менее опасной для здоровья роженицы. Однако этот метод может быть проведен в тех случаях, когда подлежащая удалению часть плода (конечность, голова) выступает из родовых путей. Так, например, закрытый метод не применим при плечевом, пяточном, бедренном предлежании плода.
Уменьшение головы плода. Операцию проводят при переразвитости головы плода, при ее ущемлении в просвете таза, узости родовых путей, при неправильном членорасположении передних конечностей, водянке головы и других аномалиях.
Сначала голову плода фиксируют глазными крючками с веревками, а затем осуществляют операцию. Общее уменьшение головы плода проводят акушерским долотом. Его вводят в ротовую полость плода и под контролем руки направляют на небные отростки верхней челюсти. Ударяя молотком по ручке долота, разрушают костную ткань. Плоскость долота поворачивают в разных направлениях. После этого голова может быть выведена наружу.
Поперечный диаметр головы уменьшают рассчеплением скуловых дуг. Акушерским долотом, введенным за щеку, скуловые дуги срезают с обеих сторон лицевого черепа. Положение долота контролируют рукой через кожу головы плода. Уменьшение высоты головы плода осуществляют, рассекая костную ткань долотом у основания черепа между глазными орбитами. Прежде всего перстневым или ножом Афанасьева делают полулунный разрез кожи между орбитами, и затем под контролем руки в место разреза устанавливают долото и ударами молотка по нем разрушают кости, которые вдавливаются рукой в мозговое вещество. Высоту головы плода можно уменьшить также за счет разрушения нижней челюсти. Операцию можно проводить двумя способами. В первом случае долотом рассекают тело нижней челюсти между средними резцами. После этого перстневым ножом разрезают щечные и жевательные мышцы в направлении жевательной поверхности коренных зубов. Давлением на ветви нижней челюсти с боков делают вывих каждой ветви в челюстном суставе и поворачивают их в сторону небной кости. Во втором случае долотом, введенным в ротовую полость, рассекают обе ветви нижней челюсти, что приводит к их смещению в сторону хоан и одновременно к уменьшению высоты головы.
Ампутация правильно предлежащей головы. Проводят данную операцию при сгибании обеих передних конечностей в плечевом суставе или при относительно большой голове, когда она расположена на запястных суставах правильно расположенных конечностей.
Операция двухмоментным способом. При сгибании грудных конечностей в плечевом суставе голову фиксируют глазными крючками, крючками Афанасьева или веревочной петлей и выводят из родовых путей за пределы вульвы. Затем анатомическим ножом с обеих сторон головы разрезают кожу от затылка до тела нижней челюсти так, чтобы линия разреза проходила впереди ушей и позади глазниц. В затылочное отверстие вводят глазной крючок, тянут его за веревку и ножом рассекают мышцы, соединяющие голову с шеей. После ампутации головы в кожных лоскутах делают отверстия, через которые пропускают акушерскую веревку и завязывают ее затягивающейся петлей. Затем плод оттесняют в матку, выправляют согнутые грудные конечности и натяжением за них и культю шеи извлекают плод наружу.
Операция открытым способом. При относительно крупной голове плода на правильно расположенные передние конечности накладывают веревочные петли. В родовые пути вводят проволочную пилу смонтированного фетотома, надевают ее на голову плода и смещают на шею. Затем голову фиксируют глазными крючками или двойными крючками Афанасьева и движением проволочной пилы проводят ампутацию. Голову выводят из родовых путей натяжением веревок, присоединенных к крючкам. Плод извлекают из матки за передние конечности и культю шеи, фиксированную двойным крючком.
Ампутация головы при неправильном ее расположении. При безуспешных исправлениях завернутую на сторону, вверх или вниз голову ампутируют. На передние конечности накладывают акушерские петли. Вокруг шеи плода при помощи пилопроводника обводят проволочную петлю и монтируют фетотом. После ампутации голову плода извлекают из родовых путей при помощи крючков Афанасьева, а туловище — за передние конечности и культю шеи, прикрытую марлевой салфеткой.
Ампутация правильно расположенной передней конечности закрытым (двухмоментным) способом. На область пута правильно расположенной конечности накладывают веревочную петлю и максимально выводят конечность из родовых путей. Скальпелем или анатомическим ножом несколько выше путового сустава делают циркулярный разрез кожи на 3/4 окружности конечности (можно пользоваться продольным разрезом длиной 10—15 см) и шпателем отпрепаровывают кожу от тканей на протяжении всей конечности до хряща лопатки. Кожу вдоль конечности разрезают при помощи кожного или перстневого ножа. После этого перерезают оставшуюся на конечности перемычку кожи, на конце кожного лоскута делают отверстие, через которое проводят веревку и таким образом накладывают на кожный лоскут веревочную петлю. Далее перстневым ножом разрезают мышцы, фиксирующие лопатку к туловищу, а для уменьшения нагрузки на таз матери упираются рукой в туловище плода. Конечность отрывают с силой 3—4 человек. При необходимости также удаляют и другую конечность, а плод выводят из родовых путей за голову.
Ампутация правильно расположенной передней конечности открытым (одномоментным) способом. Конечности фиксируют акушерскими веревками. В матку вводят руку и ножом Афанасьева или перстневым ножом разрезают кожу и мышцы вдоль заднего угла лопатки. При помощи пилопроводника в родовые пути вводят проволочную пилу и проводят ее так, чтобы она располагалась между лопаткой и грудной клеткой. Ампутация конечности достигается пилящими движениями проволочной пилы фетотома или при помощи перстневого ножа или ножа Афанасьева. Ножом разрезают кожу и мышцы по переднему и заднему краям лопатки. Разрезы соединяют сверху и под конечностью. Затем силой или экстрактором отделяют конечность от плода.
Ампутация конечности при плечевом предлежании. Голову и правильно расположенную конечность фиксируют акушерскими веревками, а согнутую в плечевом суставе конечность ампутируют открытым методом. Ножом Афанасьева или перстневым ножом рассекают кожу и мышцы у заднего края лопатки. Затем пилопроводником (можно петлепроводником, соединенным с акушерскими веревками) в матку вводят проволочную пилу или цепочный нож и под контролем руки направляют их в разрез под хрящ лопатки. Проволочную пилу проводят в трубки фетотома и движениями пилы отсекают конечность. Ампутированную конечность извлекают наружу двойными или кожными крючками, а плод — натяжением за веревки, фиксированные на голове и правильно расположенной конечности.
Ампутация конечности, согнутой в карпальном суставе. Правильно предлежащую конечность фиксируют акушерской веревкой, а за запястный сустав согнутой конечности проводят проволочную пилу. Затем под контролем руки по середине сустава перепиливают конечность и ампутированную ее часть выводят наружу.
Уменьшение объема грудной клетки. Операцию проводят при переразвитости груди плода, а также для создания доступа к тазовому поясу при его переразвитости. Сначала удаляют переднюю конечность и голову. Далее при помощи шпателя вдоль позвоночника отделяют от ребра мышцы с кожей до последнего ребра. По проделанному между мышцами и ребрами ходу продвигают реберный крючок и, захватив последнее ребро, натяжением крючка на себя перерезают или раздробляют все ребра. Вследствие этого грудная клетка уменьшается в объеме, а оставшаяся кожа и мышцы предохраняют родовые пути от повреждений при извлечении плода. Уменьшение объема грудной клетки можно проводить и при помощи фетотома Афанасьева.
Ампутация грудной клетки.После ампутации головы и передней конечности плод подтягивают к выходу из родовых путей так, чтобы передняя часть грудной клетки вышла за пределы вульвы роженицы. На уровне первых грудных позвонков вокруг грудной части туловища плода разрезают кожу и мышцы. При помощи шпателя или рукой отпрепаровывают кожу и мышцы вокруг грудной клетки. Постепенно вытягивают плод, а кожно-мышечный слой заворачивают в сторону вульвы матери, что предохраняет родовые пути от повреждений. Закончив отделение кожно-мускульного слоя на всей грудной клетке, скрытым ножом или острым крючком рассекают мягкую ткань между первым и вторым поясничными позвонками. В этом же сочленении при помощи реберного крючка с длинной рукояткой разрушают позвоночник плода. В некоторых случаях позвоночник можно рассечь ножом после удаления из брюшной полости внутренних органов. При наличии фетотома Афанасьева ампутацию грудной клетки проводят при помощи проволочной пилы.
Уменьшение тазового пояса при головном предлежании
Ампутация задней конечности при правильном членорасположении. Операцию проводят открытым или закрытым способом при несоответствии размеров тазового… Закрытый способ. Правильно расположенную конечность фиксируют акушерской… Открытый способ. Конечность, подлежащую ампутации, фиксируют веревочной петлей. Сначала перстневым или скрытым ножом…ПАТОЛОГИЯ ПОСЛЕРОДОВОГО ПЕРИОДА
Замедление обратного развития матки отмечают чаще у коров, реже у других животных. Этиология. Субинволюция матки возникает в результате перерастяжения матки при… Различают три формы проявления субинволюции матки: острая — развивается в первые дни после родов и протекает в тяжелой…Болезни матки
Хроническим катаральным эндометритом называют хроническое воспаление слизистой оболочки матки, характеризующееся постоянным выделением из матки… Этиология. Хронический катаральный эндометрит обычно развивается из острого… При хроническом течении катарального эндометрита под влиянием длительного воздействия различных раздражителей…Под скрытым хроническим эндометритом понимают воспалительный процесс эндометрия, протекающий без ясно выраженных клинических признаков и обычно при отсутствии патологических выделений из матки в периоды между течками. Диагностируется он только во время течки по наличию гнойных прожилок и других вкраплений в течковой слизи и является причиной многократных неплодотворных осеменений коров (микробные токсины и другие продукты воспаления губительно действуют на зародыш).
Этиология. Причины развития хронического скрытого эндометрита такие же, как при хроническом катаральном эндометрите.
Симптомы и течение. Воспалительный процесс слизистой оболочки матки при хроническом скрытом эндометрите протекает вначале, как и при катаральном эндометрите. Впоследствии степень воспаления эндометрия уменьшается, и выпот экссудата в матку постепенно прекращается. В связи с этим прекращается и выделение экссудата из матки наружу. Однако изменения в эндометрии, образовавшиеся в начале воспаления, сохраняются. При клиническом исследовании они не обнаруживаются. В итоге явный признак эндометрита (патологические выделения из матки) выпадает, и процесс принимает скрытый характер. При наступлении очередной течки, охоты и овуляции когда, снижается резистентность организма и эндометрия воспалительный процесс в эндометрии обостряется, и вновь начинается выделение экссудата в полость матки и затем наружу.
Хронический скрытый эндометрит характеризуется отсутствием патологических выделений из матки в период от одной течки до другой. При этом клиническим исследованием заметных изменений во влагалище, шейке матки и в самой матке обычно не обнаруживают. Иногда отмечают лишь атонию матки и неравномерное утолщение ее стенок. Ритм половых циклов чаще всего не нарушается. У внешне здоровых коров отмечают многократные безрезультатные осеменения и бесплодие, что нередко и является основанием предполагать о наличии у них данной патологии.
Диагноз. Достоверный диагноз по клиническим признакам поставить затруднительно. Хронический скрытый эндометрит диагностируют по обнаружению во время охоты патологических выделений из матки. Они бывают не прозрачными, как в норме, а мутными с примесью хлопьев гноя и более обильными. Через 1—3 дня после охоты патологические выделения из матки прекращаются и вновь не отмечаются до наступления очередной течки и охоты. Более точно диагностировать хронический скрытый эндометрит, можно только используя один из приведенных ниже лабораторных методов.
Врач-гинеколог может организовать в условиях фермы, пункта искусственного осеменения или ветаптеки проведение лабораторного исследования цервикальной слизи для уточнения диагноза и характера воспалительного процесса у бесплодных животных. Для получения лохий или слизи сначала проводят туалет наружных половых органов, затем руку в полиэтиленовой перчатке вводят во влагалище, берут содержимое около шейки матки и помещают в баночку или пробирку, пишут номер или кличку коровы. Исследование материала проводят сразу, но можно и через 2-3 часа, если хранить в прохладном месте. При необходимости для уточнения причины бесплодия проводят микроскопию мазка шеечно-влагалищной слизи, биопсию эндометрия.
· По И.С Нагорному. В лабораторную пробирку помещают 2 мл лохий и добавляют 2 мл 1%-ного раствора уксусной кислоты или 0,1%-ного раствора этакридина лактата. Если лохии получены от коровы с нормальным течением послеродового периода, то в пробирке образуется сгусток муцина, не разбивающийся при встряхивании; осаждающаяся жидкость остается прозрачной. В случае эндометрита образуется осадок, при легком встряхивании пробирки жидкость мутнеет.
· Проба по В.С. Дюденко. Основана на выявлении в течковой слизи при наличии воспалительного процесса токсических веществ ароматического ряда (индол, скатол и др.). В пробирку берут 2 мл лохий или слизи и добавляют 2 мл 20% раствора трихлоруксуной кислоты. Смесь фильтруют через бумажный фильтр и к 2 мл безбелкового фильтрата добавляют 0,5 мл азотной кислоты. Содержимое кипятят одну минуту. После охлаждения к смеси добавляют 1,5 мл 33%-ного раствора едкого натрия. При положительной реакции раствор желтеет. Желто-зеленый цвет указывает на умеренное катаральное воспаление эндометрия, оранжевый - на гнойно-катаральное воспаление слизистой оболочки матки.
· Проба по Г.М. Калиновскому. Основана на выявлении в слизи серо-содержащих аминокислот, которые отмечаются при воспалении. В пробирку вносят 4 мл 0,5%-ного раствора свинца уксуснокислого, к которому по каплям добавляют 20%-ный раствор едкого натрия до образования осадка (гидрата окиси свинца). Через 15-20 сек. снова добавляют раствор едкого натрия до исчезновения осадка. Затем в пробирку вносят 1,5 – 2,0 мл слизи, взятой у коровы перед осеменением. Содержимое пробирки легко встряхивают и нагревают, не доводя до кипения. При наличии скрытого эндометрита в результате образования сернистого свинца смесь приобретает цвет крепко заваренного чая.
· Проба по В.Г. Гавришу. Основана на выявлении при воспалительных процессах гистамина, продуцируемого тучными клетками эндометрия. В пробирку вносят 2 мл мочи животного и добавляют 1 мл 5%-ного водного раствора ляписа. Кипятят в течение 2 мин. Образование черного осадка указывает на воспаление эндометрия, а коричневого или светлого на нормальное состояние.
· Проба по Л.Л.Смирновой. Основана на адсорбции гнойного содержимого и позволяет проводить диагностику скрытого эндометрита не дожидаясь течки животного. Ватно-марлевый тампон с ниткой пропитывают ивасдэком (смесь, состоящая из вазелина - 72 части, ихтиола - 20 частей, АСД-3 - 8 частей), и с помощью корнцанга вводят во влагалище до шейки матки. Через сутки за нитку извлекают. При наличии эндометрита на тампоне будет белое пятно в виде капли гноя.
Лечение при скрытом эндометрите, прогноз и профилактика такие же, как при хроническом катаральном эндометрите.
1. многократно приходящих в охоту коров осеменяют двукратно с интервалом 10-12 часов и через 8-10 часов внутриматочно вводят 10 мл тилозинокара, метритила или неомицина сульфат, полимиксина сульфат, тилозина тартрат или другие антибиотики в дозе 1г (1млн ЕД), растворенную в 10 млизотонического раствора натрия хлорида.
2. Эти же препараты рекомендуется вводить внутриматочно во время охоты дважды с интервалом 24 часа. Осеменение животных в данном случае не проводят.
Функциональные нарушения яичников коров и телок
Гипофункция яичников характеризуется нарушением развития и созревания фолликулов их овуляции и формирования желтого тела. Данная патология может… Этиология. причинами гипофункции яичников являются снижение синтеза и инкреции… Симптомы и течение. Начальная форма гипофункции яичников, проявляющаяся персистенцией фолликула характеризуется…При полной депрессии функции половых желез, клинически сопровождающейся анафродизией, яичники уменьшены в размере, плотные на ощупь, с гладкой поверхностью, без растущих фолликулов и желтых тел. Рога матки находятся в тазовой полости или свисают за лонный край, слабо ригидны, атоничны.
Лечение и профилактика. Коровам с гипофункцией яичников, проявляющейся задержкой овуляции или ановуляцией, в день проявления феноменов стадии возбуждения полового цикла (перед или после первого осеменения животного) внутримышечно инъецируют сурфагон в дозе 20 - 25 мкг или овогон-ТИО— 1- 1,5тыс.ИЕ.
Животным с ановуляторными половыми циклами назначают также сывороточный гонадотропин, который вводят подкожно за 2 - 3 дня до предполагаемого наступления очередной стадии возбуждения (17 - 19 день после предыдущего полового цикла и осеменения) в дозе 2,5 тыс. м.е. (5 - 6 м.е. на 1 кг массы тела). При ановуляторном половом цикле, сопровождающемся лютеинизацией неовулировавшего фолликула, определяемого в яичнике при ректальном исследовании на 6 - 8 день в виде полостного образования с «тугой» флюктуацией, однократно внутримышечно вводят один из препаратов простагландина Ф 2-альфа (эстуфалан, биоэстрофан, клатрапростин, гравопрост или гравоклатран в дозе 2 мл), а при проявлении стадии возбуждения (при осеменении) — сурфагон — 20 - 25 мкг или овогон-ТИО — 1 – 1,5 тыс. ИЕ.
При гипофункции яичников, сопровождающейся анафродизией, коровам однократно вводят гонадотропин СЖК в дозе 3 – 3,5 тыс. м.е. (6 - 7 м.е/кг массы тела). Для обеспечения нормальной овуляции в день проявления стадии возбуждения полового цикла (при осеменении) инъецируют сурфагон в дозе 20 мкг. Животным, не проявившим стадию возбуждения полового цикла, через 21 - 22 дня после гинекологического исследования и подтверждения первоначального диагноза гонадотропин СЖК вводится повторно в той же дозе.
Животным с недостаточной функцией желтого тела при проявлении очередного цикла в день осеменения однократно подкожно вводят 2,5 тыс. м.е. гонадотропина СЖК (4 - 5 м.е./кг массы тела).
Для лечении животных с депрессией половой функции рекомендуется введение гонадотропных препаратов, которое целесообразно сочетать с применением водных растворов нейротропных препаратов: карбахолина (0,1%) или фурамона (1,0%). Любой из указанных препаратов вводят двукратно с интервалом 24 ч по 2 - 2,5 мл, а через 4 - 5 дней однократно инъецируют гонадотропин СЖК в дозе 1,5 - 2 тыс. м.е.
Кисты яичниковкак функционирующие образования формируются из неовулировавших фолликулов и по функциональному состоянию разделяются на фолликулярные и лютеиновые.
Фолликулярные кисты имеют одну или несколько сферических полостей, стенки которых в начале их образования и функционирования представлены гиперпластически измененной гормонально-активной гранулезой, васкуляризированной текой, гиперпластически измененной наружной соединительнотканной оболочкой и редуцированной гранулезой.
Симптомы и течение. Ректально они определяются в виде одного или нескольких тонкостенных пузырей с нежной флюктуацией, диаметром от 2 до 4 - 6 см и более. Яичники при этом приобретают округлую или шаровидную форму, увеличиваются в размерах до куриного или гусиного яйца. Рога матки несколько увеличены и свисают за край лонных костей. В начале образования и функционирования кист у коров клинически отмечается нимфомания, которая в последующем, с наступлением дегенеративных изменений в стенке кисты, сменяется анафродизией.
Лечение. Для лечения коров с фолликулярными кистами яичников используют разные схемы назначения гормональных препаратов. По одной из них, лечение осуществляют путем однократного введения гонадотропина СЖК в дозе 5 - 6 тыс. м.е. или хорионического гонадотропина — 4 - 5 тыс. ЕД.. Животным, не проявившим стадию возбуждения полового цикла после гинекологического обследования и при выявлении признаков лютеинизации стенок кисты, на 10 - 12 день инъецируют один из вышеуказанных препаратов простагландина в дозе 2 мл. В другом случае для лечения можно использовать гонадотропин-рилизинггормон (сурфагон), который инъецируют по 10 мкг 3 раза с интервалом 24 ч, или лютеинизирующий гормон овогон-ТИО однократно — 3 тыс. ИЕ. При третьей схеме лечения коровам ежедневно в течение 7 - 8 дней парэнтерально вводят по 50 - 75 мг прогестерона с одновременной дачей внутрь по 50 - 100 мг йодистого калия, а через двое-трое суток однократно инъецируют гонадотропин СЖК— 3 - 3,5 тыс. м.е.
Лютеиновые кистыимеют, как правило, одну сферическую полость, стенка которой образована несколькими слоями пролиферирующих клеток соединительнотканной оболочки фолликула.
Симптомы и течение. При данной патологии яичники диагносцируются через прямую кишку в виде шаровидных образований до 6 - 8 см в диаметре с плотной стенкой и слабо выраженной флюктуацией. Наличие таких кист у животных сопровождается анафродизией. Рога матки и кистозно измененные яичники свисают в брюшную полость, матка атонична. В плазме крови выявляются пониженное содержание эстрадиола и высокий уровень прогестерона.
Лечение. Осуществляют путем однократного внутримышечного введения эстуфалана в дозе 500 - 1000 мкг, биоэстрофана 2 мл, или клатрапростина 2 - 4 мл с одновременной подкожной инъекцией 2,5 - 3 тыс. м.е. гонадотропина СЖК. При использовании гравопроста или гравоклатрана в дозе 4 мл гонадотропин СЖК не назначают. При кистах яичников, сопровождающихся атонией и гипотонией матки, в качестве дополнительных лечебных средств можно использовать нейротропные препараты.
Персистентное желтое тело яичника.
Этиология. Чаще всего оно образуется из циклического желтого тела при хронических воспалительных процессах в половых органах, а также после… Симптомы и течение. Концентрация прогестерона в крови при данной патологии… Диагноз. При диагностике персистентного желтого тела необходимо вести точные записи о состоянии яичников и матки при…Профилактика гинекологических болезней коров и телок
Для воспроизводства отбирают клинически здоровых телок с учетом молочной продуктивности и плодовитости их родителей. Ремонтных телок обеспечивают… В период осеменения среднесуточный прирост массы тела должен быть выше 500 г.… Кормление и содержание беременных животных осуществляются в соответствии с нормами и рационами кормления…Специфическая профилактика послеродовых эндометритов и повышения репродуктивной функции у коров.
Для этой цели в 11 хозяйствах, неблагополучных по желудочно-кишечным и респираторным болезням телят вирусной этиологии, клинически выраженному и… При этом установлено, что до применения вакцин заболеваемость телят… В первый год применения вакцины заболеваемость телят пневмоэнтритами сократилась до 82,2%, коров маститом до 41,1% и…Расстройство нейроэндокринной регуляции половой функции у быков-производителей
Этиология. Технологический стресс, вызываемый инъекциями биологически активных препаратов (аллергены, вакцины) и формированием специфического… Климатический стресс, возникающий в результате неблагоприятного воздействия на… Эксплуатационный стресс, наступающий в результате чрезмерного полового использования производителя, влечет за собой…Импотенция у быков-производителей при механических повреждениях, воспалительных процессах и новообразованиях в половых органах
Ушибы первой степени характеризуются повреждением чаще всего концевой части крайней плоти. При этом свисающая часть препуция увеличивается… Ушибы второй степени сопровождаются развитием гематомы крайней плоти, в виде… При ушибах третьей степени повреждаются кожно-фасциальный пласт крайней плоти, концевая часть полового члена с…Профилактика болезней органов размножения и импотенции у быков-производителей
При средней половой нагрузке (одна дуплетная садка в неделю) на каждые 100 кг массы потребность в кормовых единицах составляет 0,9-1,1 и при… В зимний стойловый период в рационы включают (в процентах по общей… Основным кормом должно быть высококачественное сено (8-10 кг) в сочетании с травяной резкой (2 кг) в зимний период и с…Гормональный контроль над воспроизводительной функцией коров и телок
Регулирование воспроизводства крупного рогатого скота с использованием простагландинов и гонадолиберинов. Данная система может быть применена на… Отбор животных предусматривает выявление методом ректальной пальпации здоровых… В день формирования групп для индукции стадии возбуждения животным вводят внутримышечно однократно в дозе 2 мл…Синхронизация половой цикличности и охоты у коров и телок с использованием прогестагенов и гонадотропинов
Отобранные животные подвергаются фронтальной обработке прогестагенами. В течение 6-7 дней им ежедневно инъецируют внутримышечно прогестерон по 50… За животными устанавливают постоянное наблюдение и по мере выявления…Повышение оплодотворяемости, профилактика эмбриональной смертности, перинатальной патологии с использованием гонадотропинов и гонадолиберинов
Коррекция отрицательного воздействия теплового стресса на коров и телок в период осеменения осуществляется путем парэнтеральной однократной… При интенсивной лактации и несбалансированном кормлении, сопровождающихся… Искусственное повышение многоплодия с использованием гонадотропинов применяется в основном в мясном скотоводстве, где…БОЛЕЗНИ МИНЕРАЛЬНОЙ НЕДОСТАТОЧНОСТИ
Алиментарная анемия
Болезнь диагностируется у молодняка всех видов сельскохозяйственных животных, но особенно часто у поросят, беременных и лактирующих самок. Этиология. Основной причиной алиментарной анемии является низкий запас железа… В полноценном молозиве коров содержание железа довольно высокое, а в молоке значительно меньше- 2-4 мг/кг сухого…Беломышечная болезнь
Этиология и патогенез. До сих пор причины болезни окончательно не выяснены, а следовательно не полностью расшифрован и патогенез. В настоящее время… К группе витамина Е относятся метильные производные токола и токотриенола,… Витамин Е входит в состав ферментов, участвующих в окислительно-восстановительных реакциях. Основное его свойство-…Влияние йодселенсодержащих препаратов на показатели крови коров
За 30-35 дней до отела Эритроциты, Т/л 5,64 ± 0,35 5,78 ± 0,34 5,84 ± 0,27 Гемоглобин, ммоль/л 6,26… За 20-25 дней до отела Эритроциты, Т/л 6,46 ± 0,32 6,82… На 1-3 день опыта после отела Эритроциты, Т/л 5,76 ± 0,33 6,04 ± 0,34 4,64 ± 0,28 …Таблица 25
Влияние йодселенсодержащих препаратов на функциональную активность щитовидной железы и минеральный состав крови коров
За 20-25 дней до отела Трийодтиронин (Т3), н/моль 0,54 ± 0,03 0,55 ± 0,03 0,82 ± 0,02 Тироксин (Т4),… На 1-3 день опыта после отела Трийодтиронин (Т3), н/моль 0,64…Показатели гемопоэза и неспецифической резистентности новорожденных телят на фоне применения их матерям йодселенсодержащих препаратов
На 12 - 14-й день жизни Эритроциты, Т/л 5,98 ± 0,15 6,34 ± 0,22 4,66 ± 0,22 Гемоглобин, ммоль/л 6,53… Таблица 27Показатели функциональной активности щитовидной железы и минерального состава крови новорожденных телят на фоне применением их матерям йодселенсодержащих препаратов
| Показатели | Г р у п п ы | ||
На 1-3 день жизни
| Трийодтиронин (Т3), н/моль | 5,98 ± 0,92 | 5,80 ± 0,87 | 7,51 ± 0,71 |
| Тироксин (Т4), н/моль | 286,10 ± 13,0 | 318,50 ± 18,50 | 143,40 ± 20,20 |
| Железо, мкмоль/л | 15,75 ± 0,72 | 16,11 ± 0,73 | 12,53 ± 1,07 |
| Магний, ммоль/л | 0,81 ± 0,05 | 0,82 ± 0,05 | 0,67 ± 0,05 |
| Селен, мкмоль/л | 1,27 ± 0,03 | 1,27 ± 0,04 | 0,88 ± 0,08 |
| БСЙ, нмоль/л | 421,58 ± 20,49 | 425,52 ± 13,40 | 311,26 ± 15,76 |
На 12-14 день жизни
| Трийодтиронин (Т3), н/моль | 2,02 ± 0,13 | 1,92 ± 0,14 | 2,20 ± 0,16 |
| Тироксин (Т4), н/моль | 44,60 ± 2,90 | 46,80 ± 2,20 | 42,90 ± 3,40 |
| Железо, мкмоль/л | 13,96 ± 0,71 | 15,04 ± 0,72 | 11,46 ± 1,07 |
| Магний, ммоль/л | 0,77 ± 0,10 | 0,80 ± 0,06 | 0,66 ± 0,06 |
| Селен, мкмоль/л | 0,92 ± 0,08 | 0,97 ± 0,07 | 0,59 ± 0,06 |
| БСЙ, нмоль/л | 390,06 ± 18,91 | 401,88 ± 20,49 | 244,28 ±11,03 |
Выяснение терапевтической эффективности препарата при беломышечной болезни и энзоотическом зобе телят. С целью определения специфического влияния испытуемого препарата на организм животных были проведены исследования на 25 новорожденных телятах, имевших симптомы йодселеновой недостаточности. Их разделили на 3 группы. Животных 1-й группы обрабатывали КМП в дозе 2,5 мл/10 кг живой массы, 2-й- деструмином в той же дозе, 3-й- 0,1% раствором селенита натрия согласно наставления.
За молодняком в течение 2-х недель вели клиническое наблюдение, учитывали сохранность, заболеваемость и прирост живой массы.
До введения препаратов, а также через 7 и 14дней после обработки брали пробы крови. В крови и сыворотке определяли количество эритроцитов, лейкоцитов, уровень гемоглобина, гематокрит, общий белок, трийодтиронин (Т3), тироксин (Т4), содержание железа, магния, селена, йода (БСЙ), бактерицидную и фагоцитарную активность.
Таблица 28
Влияние йодселенсодержащих препаратов на показатели крови телят
На 15-й день опыта Эритроциты, Т/л 6,35 ± 0,56 6,00 ± 0,39 5,55 ± 0,30 Гемоглобин, ммоль/л 7,20 ±…Таблица 29
Влияние йодселенсодержащих препаратов на минеральный состав крови телят
На 15-й день опыта Железо, мкмоль/л 14,46 ± 1,07 12,89 ± 0,71 11,81 ± 0,72 Магний ммоль/л 1,02 ±… Результаты исследований показали, что парентеральное введение КМП в дозе 2,5… Стимуляция гемопоэза, нормализация минерального состава крови положительно сказалась на росте, развитии, сохранности и…Показатели роста, заболеваемости и сохранности телят
Что касается заболеваемости телят к концу опыта энзоотическим зобом, то в 1-й группе лишь у одного животного (11,1%) методом пальпации… Хорошей лечебно-профилактической эффективностью при беломышечной болезни телят… Это позволило рекомендовать Витамин Е+SE с целью профилактики заболеваний, обусловленных недостаточностью селена и…Энзоотический зоб
Энзоотический зоб (Struma enzootica). Синонимы: эндемический зоб, недостаточность зоба, зобная болезнь. Широко распространенное, хроническое… Территория Республики Беларусь является практически сплошной биогеохимической… Этиология. Основной причиной зоба является дефицит йода во внешней среде. Так как в цепи почва, вода, растения,…Содержание тиреоидных гормонов и СБИ в сыворотке крови телят
| Группа | П О К А З А Т Е Л И | ||
| Тироксин, мг/л | Трийодтиронин, мкг/л | Связанный с белком йод, мг/л | |
| Перед введением препарата | |||
| 27,75±5,37 | 34,39±4,82 | 4,25±0,82 | |
| 25,76±3,53 | 33,71±5,55 | 4,12±0,76 | |
| Через 10 дней после введения препарата | |||
| 11,63±3,11 | 6,62±0,58* | 6,18±0,79* | |
| 7,99±0,97 | 13,10±2,47 | 3,63±0,56 | |
| Через 20 дней после введения препарата | |||
| 4,04±0,97* | 6,42±0,97* | 6,11±0,46* | |
| 7,42±0,97 | 28,50±5,01 | 3,48±0,52 |
Примечание: * - Р<0,05
В начале опыта у телят отмечена низкая концентрация СБИ, но уже на 10 день у телят 1-ой группы его содержание было выше (Р<0,05), чем у контрольных на 70,0% и это различие сохранилось в течении последующих 10 дней. Аналогичная тенденция отмечалась и в отношении тиреоидных гормонов. Исходный уровень тироксина у новорожденных телят обеих групп был сравнительно высоким и в последующем постепенно снижался, причем быстрее у животных 1-ой группы, что указывает, наряду с уменьшением содержания трийодтиронина, на стабилизацию функции щитовидной железы.
В свою очередь восстановление функциональной активности щитовидной железы у телят опытной группы способствовало усилению эритропоэза и синтеза белка (табл.32). Так, количество эритроцитов в крови животных опытной группы уменьшалось значительно медленнее, чем у контрольных и стабилизировалось на более высоком уровне (соответственно 5,66 ± 0,29 и 4,82 ± 0,07), хотя достоверные различия (Р<0,05) установлены только на 10-12 день жизни телят. Отсутствие достоверной разницы в концентрации гемоглобина и общего белка объясняются лишь их значительными колебаниями внутри выборки. Тем не менее, тенденция их изменений хорошо прослеживается на протяжении всего эксперимента.
Таблица 32.
Гематологические показатели телят
Наряду с улучшением гематологических показателей, применение деструмина… Таким образом, проведенный опыт убедительно показал высокую лечебную эффективность деструмина при зобной болезни…Содержание лизоцима, цинка, магния и железа в крови телят.
| Группа | П О К А З А Т Е Л И | ||||
| Лизоцим, % | Цинк, мкмоль/л | Магний, ммоль/л | Железо, ммоль/л | ||
| Перед введением препарата | |||||
| 2,84±0,24 | 32,31±6,36 | 17,34±0,90 | 6,47±0,76 | ||
| 2,98±0,26 | 29,72±2,76 | 17,75±0,49 | 6,22±0,32 | ||
| Через 10 дней после введения препарата | |||||
| 3,61±0,08* | 24,57±1,20 | 16,90±0,45 | 4,86±0,60* | ||
| 3,01±0,07 | 21,41±0,70 | 14,88±0,58 | 2,72±0,19 | ||
| Через 20 дней после первого введения препарата | |||||
| 4,16±0,15* | 26,48±1,35 | 15,75±0,44 | 5,02±0,36 | ||
| 2,85±0,11 | 23,47±1,60 | 14,44±0,54 | 3,73±0,39 |
Дальнейшие исследования препарата, подтвердили его высокую лечебно-профилактическую эффективность при энзоотическом зобе телят, что позволило внедрить его в производство. Уже в течение ряда лет деструмин выпускается Минским заводом ветеринарных препаратов. При внутримышечном введении деструмин восполняет дефицит йода и магния в организме животных, улучшает обмен веществ, способствует ускорению роста и устойчивости молодняка к другим болезням, поэтому его применяют с целью профилактики йодной недостаточности у коров и телят, повышения жизнеспособности новорожденного молодняка. Препарат вводят стельным коровам двукратно, через 1,5-2 месяца после осеменения и за 35-25 дней до отела в дозе 10 мл. Телятам деструмин инъецируют на 1-2 день жизни из расчета 2,5 мл на 10 кг живой массы, и при необходимости повторяют в той же дозе через 7-10 дней. В рекомендуемых дозах препарат не вызывает у животных осложнений и не оказывает побочных действий Противопоказанием к применению деструмина является предварительная парентеральная обработка животных другим. Йодсодержащими препаратами.
Также высокую эффективность показал разработанный в БелНИИЭВ им. С.Н.Вышелесского препарат седифиз.
Эффективность применения седифиза с целью профилактики зоба, беломышечной болезни и гепатодистрофии изучали на комплексе колхоза « Герой труда» Глубокского района Витебской области. По принципу аналогов (живая масса, пол, условия кормления и содержания матерей) были сформированы 4 группы поросят-сосунов таким образом, что под каждой свиноматкой находились животные всех групп. В 2-4 дневном возрасте поросятам 1-2 групп внутримышечно ввели по 1,5 мл , а 3 – 2 мл седифиза. Животным 4 группы инъецировали 3 мл ДИФ –3. В 15-дневном возрасте поросятам 2 группы введение седифиза повторили. До назначения препаратов, в 10 и 25-дневном возрасте у пяти животных каждой группы брали кровь для лабораторных исследований. В крови определяли количество лейкоцитов, эритроцитов, гемоглобина, общего белка и его фракций, содержание селена, железа, меди, цинка, связанного с белком йода, а также выводили лейкоцитарную формулу. В течение всего опыта за поросятами вели ежедневное наблюдение, учитывали заболеваемость, общее состояние животных. В конце опыта определяли среднесуточный прирост живой массы в каждой группе за время эксперимента. Павшие животные вскрывались для определения причин гибели.
Результаты исследований показали, что седифиз позволяет увеличить в крови поросят содержание железа, йода и селена, а также обладает профилактической эффективностью в отношении алиментарной анемии, зоба и гепатодистрофии. Так, при исследовании крови до введения препаратов, содержащие указанных выше элементов в сыворотке крови составляло соответственно 3,64 ± 0,12 мг/л, 41,49 ±1,83 мкг/л и 9,0 ± 0,11 г/л при норме 50-100 мкг/л для селена, 40-60 мкг/л для йода и 2,0-4,0 мг/л для железа.
При исследовании сыворотки крови через 10 и 20 дней после введения препаратов, у поросят 1 группы (1,5 мл седифиза однократно) содержание железа увеличилось соответственно до 4,99 ± 0,63 и 3,66 ± 0,22 г/л; П – (1,5 мл седифиза двукратно, с интервалом 15 дней) - до 5,33± 0,59 и 5,52 ± 0,32 г/л; Ш (2,0 мл седифиза однократно) – до 5,42 ± 0,51 и 4,58 ± 0,22 г/л; 1У (3 мл ДИФ-3 однократно) – 5,05 ± 0,38 и 4,07 ± 0,09 г/л. Увеличение концентрации общего йода в сыворотке крови у поросят в те же сроки характеризовались следующими данными по группам: в 1 – 74,14±1.72 и 44,27 ± 1,20 мкг/л; во П – 73,62 ±1,02 и 68,52 ± 2,31 мкг/л, в Ш – 78,61 ± 1,69 и 45,28 ± 3,53 мкг/л и в 1У – 69,76 ± 2,26 и 39,13 ± 2,61 мкг/л. Таким образом, даже после однократного введения седифиза концентрация общего йода и железа в сыворотке крови остаются в пределах физиологической нормы практически до отъема поросят.
Повышение количества селена в сыворотке крови поросят опытных групп указывают на создание его запасов в организме и подтверждается следующими данными по группам при исследовании через 10 и 20 дней после первого введения препаратов: в 1 – 99,87 ± 2,60 и 52,52 ± 1,50 мкг/л, во П – 100,56 ± 4,23 и 105,59 ± 3,03 мкг/л, в Ш – 115,97 ± 6,26 и 60,78 ± 1,58 мкг/л в 1У – 44,25 ± 1,89 и 36,34 ± 1,83 мкг/л.
Гематологические показатели во всех группах значительных различий между собой не имели, за исключением достоверного повышения количества эритроцитов у поросят 1 и лейкоцитов во П группах на 24 день жизни в сравнении с контролем соответственно на 13,2 и 39,7%, что объясняется в первом случае стимулирующим действием селена на эритропоэз, а во втором- повторным введением препарата. Изменения в лейкограмме в большей степени были обусловлены возрастом животных и не имели существенных различий между группами, хотя у поросят П группы отмечено относительное увеличение количества сегментоядерных нейтрофилов.
При определении соотношения белковых фракций установлено возрастное относительное увеличение альбуминов у поросят всех групп, а также больший уровень -глобулинов и гаптоглобулинов животных 1-Ш групп, т.е обработанных селеносодержащим препаратом, что указывает на усиление белоксинтезирующей функции печени под действием селена.
Наиболее устойчивыми к заболеваниям оказались животные 1 группы (заболеваемость 20%); во II заболеваемость составила 23,8%, в Ш – 25% и в 1У – 28,6%. Соответственно сохранность в 1-1У группах составила 95,0%, 85,7%, 90,0% и 85,7%.
Анализ полученных результатов показал, что однократное применение поросятам седифиза в дозе 1,5 мл на животное позволяет профилактировать болезни, обусловленных дефицитом йода, железа и селена.
Препарат ДИФ-3 является комплексным соединением железа и йода, содержит 48,0-50 мг/мл железа и 4,8-5,6 мг/мл йода.
Представляет собой стерильную, нелетучую непрозрачную жидкость темно-коричневого цвета с легким специфическим запахом, хорошо смешивается с водой. Возможно наличие небольшого количества осадка.
ДИФ-3 способствует нормализации обмена веществ, восполняет дефицит железа и йода в организме, стимулирует эритропоэз, воспроизводительную способность свиноматок и коров, повышает устойчивость животных к заболеваниям, способствует ускорению роста.
ДИФ-3 применяется для профилактики недостаточности йода (зобной болезни) железодефицитной анемии молодняка сельскохозяйственных животных, повышения воспроизводительной способности свиноматок и коров, а также жизнеспособности новорожденных поросят и телят, профилактики послеродовых заболеваний (задержания последов, эндометриты).
Препарат вводят внутримышечно в область бедра или шеи свиньям и крупа- телятам и коровам в дозах:
· Поросятам –2,0-3,0 мл на голову на 3-5 день жизни; при необходимости инъекцию повторяют через 7-10 дней в той же дозе;
· Свиноматкам – за 8-12 дней до осеменения и за 20-30 дней до опороса по 8-10 мл на голову;
· Телятам- на 1-2 день жизни по 5 мл на голову однократно;
· Коровам- за 35-25 дней до отела в дозе 7-10 мл на голову однократно;
Противопоказаний к применению препарата не установлено.
Продукция животноводства после применения ДИФ-3 используется без ограничений, однако, следует иметь в виду, что окрашивание тканей в месте инъекции сохраняется до 30 дней.
ДИАГНОСТИКА ИНФЕКЦИОННЫХ И ИНВАЗИОННЫХ БОЛЕЗНЕЙ СЕЛЬСКОХОЗЯЙСТВЕННЫХ ЖИВОТНЫХ
ЛАБОРАТОРНАЯ ДИАГНОСТИКА ВИРУСНЫХ ПНЕВМОЭНТЕРИТОВ КРУПНОГО РОГАТОГО СКОТА И СВИНЕЙ Общие принципы лабораторной диагностики вирусных респираторных и…КРАТКАЯ ХАРАКТРИСТИКА МЕТОДОВ, ИСПОЛЬЗУЕМЫХ ПРИ ДИАГНОСТИКЕ ПНЕВМОЭНТЕРИТОВ ТЕЛЯТ И ПОРОСЯТ
Для выделения вирусов-возбудителей пневмоэнтеритов телят (инфекционного… Вируссодержащий материал (слизистая оболочка носа, пораженного кишечника, преджелудков, селезенки, легких, трахеи),…Реакция иммунной флуоресценции
Реакция иммунофлуоресценции основана на обнаружении иммунного комплекса, образованного путем взаимодействия антигена и антитела, меченного… Непрямой вариант РИФ может быть использован при индикации антигенов… Для диагностики респираторных инфекций используют мазки-отпечатки из пораженных органов дыхания. Для диагностики…Диагностика трихомоноза
Для исследования в ветеринарную лабораторию направляют абортированный плод (до 4-месячной стельности) вместе с плодовыми оболочками или часть… Согласно «Методическим указаниям по лабораторной диагностике трихомоноза… Перед взятием диагностического материала у животного половые органы моют теплой водой с мылом и вытирают полотенцем. …Количественное определение балантидий в 1 мл материала
ДИАГНОСТИКА ГЕЛЬМИНТОЗОВ ЖИВОТНЫХ Диагноз на гельминтозы ставят на основании комплекса исследований — эпизоотологических, клинических,…Обследование животных с целью обнаружения паразитических клещей
Отряд паразитиформных клещей включает надсемейство Ixodoidea—иксодоидных клещей и надсемейство Gamasoidea — гамазоидных клещей. Иксодоидные клещи… Отряд акариформных клещей объединяет 2/3 всех известных клещей и представлен… Подотряд Trombidiformes включает клещей семейства Demodecidae рода Dеmodex, вызывающих демодекозы животных (см. табл.…Сбор и исследование живых чесоточных клещей.
Метод А. В. Алфимовой. Соскобы кожи помещают в чашку Петри и ставят в термостат при температуре 37—40°С. Через 5 минут чашку Петри из термостата… Метод Н. Ф. Родиной. Аппарат Бермана заполняют подогретой до 42—43°С водой и в… Метод М. Г. Хатина. В пробирку помещают мелко расщепленный соскоб кожи, заливают его подогретым до 30°С физраствором и…Сбор и исследование паразитических насекомых
Насекомые с полным превращением представляют отряд Dipterа, который включает подотряд короткоусых — Вrасhycera и длинноусых — Nеmatocera. Подотряд короткоусых насекомых состоит из ряда семейств: оводы подкожные —… Подотряд длинноусых насекомых состоит из семейств: комары — Сulicidae, мокрецы — Сеratopogonidае, мошки — Simuliidае и…Обследование пастбищ и водоемов при биогельминтозах
Заражение животных на пастбищах, в местах прогона и из водоемов биогельминтами зависит исключительно от наличия там промежуточных хозяев, а также… В европейской части нашей страны промежуточным хозяином для фасциол служит… Малый прудовик откладывает яйца на остатках растительности, на кусках дерева, на камнях или просто на влажной почве,…Показатели клеточного иммунитета у телят различного клинического состояния при пневмоэнтеритах
Такое положение обусловлено тем, что вирусы-возбудители пневмоэнтеритов в процессе своей репродукции способствуют угнетению основных звеньев… Наряду с изменениями в клеточном звене иммунитета, при вирусных респираторных… В табл. 35 и на рис. 3, 4, 5, 6 представлены результаты исследований гуморального иммунитета у телят различного…Иммунопатология при паразитарных заболеваниях
Внедрение инвазионного начала вызывает в организме хозяина многогранные изменения со стороны органов и систем. Характер этих изменений зависит от… Нами (1987-1999 гг.) подробно изучено влияние некоторых паразитов на организм… Установлено, что инвазирование свиней кишечными нематодами приводит к нарушению гомеостаза организма, проявляющегося…Состояния иммунитета и обменных процессов при гинекологических болезнях коров
Объектом исследования служили 20 коров возрастом 4-6 лет, которых разделили на 2 группы по 10 голов в группе. Коровы опытной группы № 1 –… В крови животных определяли 17 основных биохимических показателей. В таблице 9.22. и на рис 9.20-9.24 представлены результаты биохимических исследований крови у коров с различным…Абсолютное и относительное количество Т- и В-лимфоцитов в крови коров здоровых и группы риска.
Количество В-лимфоцитов в крови коров первой и второй групп во все сроки исследований достоверно не отличалось (Р>0,05), однако наблюдался… Во все сроки исследований количество «нулевых» лимфоцитов было достоверно выше… При изучении содержания иммуноглобулинов в крови установлено, что титр G и М-классов иммуноглобулинов в сыворотке…Титр иммуноглобулинов в маточном секрете коров подопытной и контрольной групп (log 2).
Таблица 9.7.Бактерицидная активность маточного секрета и количество лизоцима
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА РЕСПИРАТОРНЫХ И ЖЕЛУДОЧНО-КИШЕЧНЫХ ИНФЕКЦИЙ КРУПНОГО РОГАТОГО СКОТА И СВИНЕЙ
Дифференциальная диагностика респираторных инфекций
По клиническим и патологоанатомическим признакам
Инфекционный ринотрахеит необходимо отличать от парагриппа-3, вирусной диареи, ящура, злокачественной катаральной горячки, хламидиоза,… При вирусной диарее необходимо исключить чуму, злокачественную катаральную… Парагрипп-3 следует отличать от инфекционного ринотрахеита, вирусной диареи, аденовирусной инфекции, пастереллеза,…Дифференциальный диагноз желудочно-кишечных заболеваний телят по клиническим и патологоанатомическим признакам
Ротавирусная инфекция дифференцируется от коронавирусной, вирусной диареи, колибактериоза, стрептококкоза, энтеротоксемии. Коронавирусная инфекция дифференцируется от ротавирусной инфекции, вирусной… Парвовирусная инфекция дифференцируется от ротавирусной и коронавирусной инфекций, вирусной диареи, колибактериоза,…Дифференциальная диагностика желудочно-кишечных инфекций свиней по клиническим признакам и патологоанатомическим изменениям
Трансмиссивный гастроэнтерит необходимо отличать от рота- и энтеровирусных инфекций, эпизоотической диареи свиней, анаэробной энтеротоксемии… Ротавирусную инфекцию свиней необходимо дифференцировать от трансмиссивного… Энтеровирусную инфекцию свиней необходимо дифференцировать от трансмиссивного гастроэнтерита, энзоотической диареи,…Критерии, характеризующие окончательное установление диагноза на пневмоэнТЕРИТЫ ТЕЛЯТ И ПОРОСЯТ ВИРУСНОЙ И БАКТЕРИАЛЬНОЙ ЭТИОЛОГИИ
Вирусовыделение проводят в основном на первично-трипсинизированных культурах клеток почки эмбриона коровы, тестикул бычка, трахеи. легких.… Парагрипп-3. Лабораторный диагноз устанавливается по реакциям:… Вирусовыделение проводят в основном на первично-трипсинизированных культурах клеток почки эмбриона коровы, тестикул…ПАТОМОРФОЛОГИЧЕСКАЯ ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ СЕЛЬСКОХОЗЯЙСТВЕННЫХ ЖИВОТНЫХ
БОЛЕЗНИ, ПРОТЕКАЮЩИЕ С НЕРВНЫМИ ЯВЛЕНИЯМИ
Листериоз
1. Кровоизлияния под эпи- и эндокардом, в плевре, слизистой оболочке трахеи и бронхов. 2. Увеличение селезенки и милиарные некрозы в ней. 3. Серозное воспаление брыжеечных лимфоузлов.Классическая чума свиней
Септическая форма 1. Геморрагический диатез. 2. Геморрагический лимфаденит с рисунком мраморности на разрезе лимфоузлов.БОЛЕЗНИ, ПРОТЕКАЮЩИЕ С УРОГЕНИТАЛЬНОЙ
ПАТОЛОГИЕЙ
Хламидиоз
У абортировавшей коровы: 1. Катарально-гнойный или ихорозный эндометрит, цервицит и вагинит. 2. Кровоизлияния и очаговые некрозы в плаценте.Репродуктивно-респираторный синдром свиней
Патологоанатомический диагноз
У абортированных плодов
2. Серозные отеки в перитрахеальной и паховой областях. 3. Зернистая дистрофия печени, почек и миокарда. Милиарные и субмилиарные… 4. Небольшое увеличение селезенки.Парвовирусная инфекция свиней
Патологоанатомический диагноз
У абортированных плодов
1. Серозный отек подкожной и межмышечной клетчатки.
2. Кровоизлияния в мышцах, слизистых и серозных оболочках и т. д.
3. Асцит, гидроторакс, гидроперикард.
4. Отставание в развитии (врожденная гипотрофия), иногда мумификация плодов, их уродство, экзофтальм, отсутствие волосяного покрова.
5. Гисто: некрозы в различных органах и тканях, негнойный лимфоцитарный энцефалит.
Реовирусная инфекция телят
Патологоанатомический диагноз
1. Серозно-катаральный конъюнктивит.
2. Острый катаральный ринит и трахеит.
3. Острая катаральная бронхопневмония.
4. Острый катаральный энтерит.
5. Серозное воспаление бронхиальных лимфоузлов.
Парвовирусная инфекция телят
Патологоанатомический диагноз
2. Серозное воспаление брыжеечных лимфоузлов. 3. Зернистая или токсическая дистрофия печени, некрозы в ней. 4. Общая венозная гиперемия.СПЕЦИФИЧЕСКАЯ ПРОФИЛАКТИКА РЕСПИРАТОРНЫХ И ЖЕЛУДОЧНО-КИШЕЧНЫХ ИНФЕКЦИЙ ТЕЛЯТ И ПОРОСЯТ
Занос инфекционных болезней на крупные специализированные животноводческие и свиноводческие фермы можно предупредить, если профилактические… Достигнуть успехов в борьбе с болезнями можно при выполнении следующих… Для того, чтобы исключить из эпизоотического процесса восприимчивых животных, необходимо создать у них специфическую…Моновакцины для профилактики вирусных инфекций телят
- живая культуральная вирус-вакцина ТК-А (ВИЭВ). Используется для иммунизации бычков на откорме. Разработана во Всероссийском НИИ экспериментальной… -живая культуральная вирус-вакцина против инфекционного ринотрахеита “Монорин”… -живая культуральная вирус-вакцина против инфекционного ринотрахеита. Разработана в Белорусском НИИ экспериментальной…Ассоциированные вакцины для профилактики вирусных инфекций телят
- бивалентная живая культуральная вирус-вакцина“Бивак” против инфекционного ринотрахеита и парагриппа-3. Применяется для иммунизации бычков на… - бивалентная живая культуральная вирус-вакцина против инфекционного… -трехвалентная живая культуральная вирус-вакцина против инфекционного ринотрахеита, парагриппа-3 и вирусной диареи…Вакцины против бактериальных инфекций крупного рогатого скота и свиней.
-вакцина поливалентная эмульгированная против пастереллеза свиней. Выпускается Щелковским биокомбинатом (Россия). Применяется для иммунизации… -формолвакцина против пастереллеза крупного рогатого скота и буйволов.… -инактивированная вакцина против легочного пастереллеза свиней. Разработана и выпускается в Белорусском НИИЭВ им.…ВЕТЕРИНАРНО-САНТИТАРНЫЕ ТРЕБОВАНИЯ И КОМПЛЕКС МЕРОПРИЯТИЙ ПРИ РЕСПИРАТОРНЫХ И ЖЕЛУДОЧНО-КИШЕЧНЫХ ЗАБОЛЕВАНИЯХ ТЕЛЯТ И
ПОРОСЯТ
Выращивание здорового молодняка сельскохозяйственных животных – важная задача не только ветеринарных специалистов животноводческих и свиноводческих хозяйств, ферм и комплексов.
Все проводимые мероприятия должны проводиться комплексно, с учетом формы хозяйствования, эпизоотического состояния хозяйства и местности и т.д.
В табл. 41 представлена схема комплекса мер борьбы с респираторными и желудочно-кишечными заболеваниями телят.
ОБЩЕХОЗЯЙСТВЕННЫЕ И ВЕТЕРИНАРНО-САНИТАРНЫЕ МЕРОПРИЯТИЯ ПРИ ЗАБОЛЕВАНИЯХ ПНЕВМОЭНТЕРИТАМИ У КРУПНОГО РОГАТОГО СКОТА
- Вход на территорию осуществляетсмя через санитарный пропускник с обязательной заменой верхней одежды и обуви на спецодежду и спецобувь. - Специальные транспортные средства на территорию комплексов и ферм пропускают… Таблица 41КОМПЛЕКС МЕР БОРЬБЫ С РЕСПИРАТОРНЫМИ И ЖЕЛУДОЧНО-КИШЕЧНЫМИ ЗАБОЛЕВАНИЯМИ ТЕЛЯТ
- На животноводческих фермах и комплексах (в коровниках, профилакториях, прифермских территориях, выгульных площадках) осуществлять проведение… - На территориях ферм и комплексов запрещается содержать собак (кроме… - У входа в каждое производственное помещение устанавливаются постоянно действиующие дезбарьеры (дезванны,…Требования к содержанию сухостойных коров и нетелей и по их подготовке к отелу
- Запуск коров осуществляют за 60 дней до отела в течение 5-6 дней. - С прекращением лактации проверяют молочную железу на скрытую форму мастита с… - Сухостойных коров и нетелей размещают в отдельном помещении или секции (цех сухостойных коров с формированием групп…Требования к содержанию здоровых новорожденных телят в профилактории с первого дня до 20-дневного возраста
а) Прием новорожденного теленка, дезинфекция пуповины (5%-ным раствором йода, 1%-ным раствором марганцевокислого калия, лизола и т.д.), обтирание и… б) В первый день рождения выпаивание молозива (5% от живого веса теленка)… в) В течение первых 7 дней выпаивание молозива при температуре 37-38°С.Мероприятия при выращивании телят старше 20 дневного возраста на комплексах и фермах
Перед транспортировкой каждому теленку проводят выпаивание 120 г глюкозы или сахарозы, растворенной в 1-2 л воды, очистку кожного покрова,… При поступлении на новые фермы или комплексы телята подвергаются чиске кожного… Аэрозольная обработка каждой партии вновь поступивших телят одним из нижеследующих препаратов:Лечение новорожденных телят при вирусных энтеритах
В целях обеспечения тканей организма энергетическим материалом необходимо вводить новорожденным телятам по 50—80 г глюкозы с первой выпойкой… При появлении первых клинических признаков заболевания с поражением… При переболевании телят рота-, корона- и парвовирусной инфекциями отмечается А-витаминная недостаточность. В этом…Лечение телят при вирусных респираторных инфекциях
В первые 2—3 дня у животных наблюдают вирусную фазу течения респираторного заболевания. Лечебные мероприятия в это время необходимо направлять на… Рекомендуются следующие схемы лечения телят, больных респираторными… В период вирусной фазы всех телят в помещении, где диагностировано заболевание, обрабатывают пассивно сывороточными…МЕРЫ БОРЬБЫ С ТРАНСМИССИВНЫХ ГАСТРОЭНТЕРИТОМ, РОТА- И ЭНТЕРОВИРУСНЫМИ ИНФЕКЦИЯМИ СВИНЕЙ
При подтверждении лабораторного диагноза на ТГС и другие вирусные гастроэнтериты свиней хозяйство объявляют неблагополучным. Проводят… Для профилактики ТГС и других вирусных гастроэнтеритов свиней и борьбы с ними… Для дезинфекции рекомендуется применять следующие дезосредства (П.И. Притулин, 1975)( Табл. 42):Перечень дезосредств для уничтожения вируса ТГС и других вирусных гастроэнтеритов свиней во внешней среде
Рекомендуется не менее 2 раз в сутки на участках опороса проводить дезинфекцию помещений в присутствии животных 0,6%-ным раствором марганцовокислого… В последующем в неблагополучном по ТГС хозяйстве проводится ежедневная… Общие профилактические мероприятия при ротавирусной болезни поросят сводятся к тому, чтобы не допустить заноса…Меры борьбы с респираторно-репродуктивным синдромом свиней РРСС
ввоз и вывоз свиней за пределы очага (за исключением животных на убой); убой и пергруппировку свиней внутри хозяйства без разрешения ветеринарных… вывоз спермы хряков за пределы очага;Меры борьбы с пастереллезом
При установлении пастереллеза среди свиней, крупного и мелкого рогатого скота в хозяйстве вводят ограничения. Все поголовье неблагополучной группы… Ограничения с хозяйства снимают через 14 дней после поголовной вакцинации… При вспышке пастереллеза среди птиц ферму или хозяйство объявляют неблагополучным и вводят ограничение. Больную и…Профилактика, лечение и меры борьбы с дизентерией свиней.
Рекомендуется организовать в хозяйстве туровые или уплотненные опоросы. Помещения, предназначенные для опоросов должны быть тщательно очищены и… Предметы ухода после каждой уборки навоза подлежат дезинфекции путем… За свиноматками устанавливают тщательное ветеринарное наблюдение и в случае заболевания их перед опоросом немедленно…ПРОФИЛАКТИКА вирусно-бактериальных энтеритов НОВОРОЖДЕННЫХ ТЕЛЯТ ТЕХНОЛОГИЧЕСКИМИ МЕТОДОМИ
- телята, как правило, рождаются не зараженными возбудителями энтеритов; - телята заражаются в первые часы и дни жизни непосредственно от больных… - возбудители заболевания находятся в фекалиях больных энтеритами телят;ПРОФИЛАКТИКА РЕСПИРАТОРНЫХ ИНФЕКЦИЙ ТЕЛЯТ ТЕХНОЛОГИЧЕСКИМ МЕТОДОМ
Респираторные болезни телят в хозяйствах, стационарно неблагополучных по этим заболеваниям, вызывают вирусы (инфекционного ринотрахеита,… Технологические приемы недопущения образования эпизоотологической цепи строят… -телята, как правило, рождаются не зараженными возбудителями заболевания;ОСОБЕННОСТИ ВЕТЕРИНАРНО-САНИТАРНЫХ МЕРОПРИЯТИЙ ПРИ ВЫРАЩИВАНИИ ТЕЛЯТ, закупленных у НАСЕЛЕНИЯ
Особенностями выращивания телят, закупленных у населения, является их неприспособленность к выращиванию в условиях животноводческих ферм и… В этой связи при выращивании таких телят необходимо проведение следующих… -Обязательные антистрессовые обработки с использованием транквилизаторов, иммуностимуляторов, антибиотиков…СРЕДСТВА ЛЕЧЕНИЯ И БОРЬБЫ С БОЛЕЗНЯМИ КРУПНОГО РОГАТОГО СКОТА И СВИНЕЙ
Химиотерапевтические средства
Химиотерапевтические средства могут применяться для лечения больного животного (химиотерапия), а также для предупреждения клинического проявления…Сульфаниламидные препараты
Первые сообщения о СА, а точнее о производных сульфаниловой кислоты были сделаны в 1908 г в Германии немецким ученым Гельно. В 1932 г химики Митчел… Все сульфаниламиды - белые или слегка желтоватые порошки. Большинство из них… Механизм бактериостатического действия сульфаниламидов обусловлен конкурентным отношением между сульфаниламидом и…Стрептоцид ( стрептоцид белый, пронтозил, амбезид и др) - Streptocidum.
Белый кристаллический порошок, без вкуса, плохо растворим в воде (1:170), хорошо в кипящей воде, трудно в спирте (1:35), хорошо растворим в растворах едких щелочей. Растворы стойкие при хранении.
Форма выпуска. Порошок; таблетки по 0,3 и 0,5 г; 10% мазь и 5% линимент.
Стрептоцид растворимый - Streptocidum solubile.
Форма выпуска. Порошок; линимент 5% в тубах по 30 г. Хранение. По списку “Б”. Срок хранения 10 лет. Действие. Бактериостатическое на кокковые формы (кроме стафилококков), кишечную палочку, возбудителя газовой гангрены…Норсульфазол (амидотиазол, полисептил, сульфатазол) - Norsulfasolum.
Белый или белый со слегка желтоватым оттенком кристаллический порошок без запаха. Очень мало растворим в воде, мало в спирте, растворим в разведенных минеральных кислотах и растворах едких и углекислых щелочей.
Форма выпуска. Порошок, таблетки по 0,25-0,5 г.
Норсульфазол натрий (растворимый норсульфазол) - Norsulfasolum natrium.
Хранение. По списку “Б”. В сухом, защищенном от света месте. Срок хранения: нерастовримого - 5 лет; растворимого - 3 года. Действие. Высокоактивен в отношении гемолитического стрептококка,… Применение. При бронхопневмониях, плевритах, стрептококковых сепсисах, эндометритах, маститах, гастроэнтеритах,…Этазол (глобуцид,сетадил и др)- Aethazolum.
Белый или белый со слегка желтоватым оттенком порошок. Практически нерастворим в воде, трудно растворим в спирте, легко в растворах щелочей.
Форма выпуска. Порошок, таблетки по 0,25 и 0,5 г.
Этазол натрий (растворимый этазол) - Aethazolum natrium.
Форма выпуска. Порошок, раствор 10% и 20% в ампулах по 5 и 10 мл. Хрнение. По списку “Б”. Порошок в хорошо закрытой посуде, в защищенном от… Действие. Антимикробное в отношении стрептококков, пневмококков, менингококков, кишечной и дизентерийной палочек,…Сульфадимезин (диметразил, сульфамезатил, суперсептил) - Sulfadimesinum.
Форма выпуска. Порошок, таблетки по 0,25-0,5 г. Хранение. По списку “Б”. В хорошо закрытой посуде, защищенном от света месте.… Действие. Широкий антимикробный спектр. К препарату чувствительны пневмококки, стафилококки, кишечная палочка,…Сульфапиридазин (квинтосептил, микроцид, деповермил) - Sulfapyridasinum.
Белый со слегка желтоватым оттенком кристаллический порошок, без запаха, горьковатый на вкус. Практически не растворим в воде, мало растворим в спирте, легко в разведенных кислотах и щелочах.
Форма выпуска. Порошок, таблетки по 0,5 г.
Сульфапиридазин натрий - Sulfapyridasinum natrium.
Хранение. По списку “Б”. В сухом, защищенном от света месте. Срок хранения - 2 года. Действие. Бактериостатическое в отношении большинства кокковых… Применение. При пневмониях, бронхитах, фарингитах, микоплазмозе, энтероколитах, дизентерии, сальмонеллезах,…Сульфадиметоксин (депосул, мадроксин, мадрибон) - Sulfadimetoxinum.
Форма выпуска. Порошок, таблетки по 0,2 и 0,5 г. Хранение. По списку “Б”. В защищенном от света месте. Срок хранения 4 года. … Действие. Широкий спектр антимикробного действия в отношении грамположительных и грамотрицательных микроорганизмов,…Сульфамонометоксин (диаметон, дуфадин и др.) - Sulfamonometoxinum.
Форма выпуска. Порошок, таблетки по 0,5. Хранение. По списку “Б”. В защищенном от света месте. Срок хранения - 2… Действие. По спектру действия близок к сульфапиридазину. Хорошо всасывается. Терапевтическая концентрация в крови и…Сульфален (келфизин, далисеп, полицидал и др.) - Sulfalenum.
Форма выпуска. Таблетки по 0,2 и 0,5 г; растворимая форма сульфален-метгемоглобин - 10% раствор в ампулах по 2 и 5 мл. Хранение. По списку “Б”. Срок годности - 5 лет. Действие. По антимикробному действию близок к другим сульфаниламидам. Отличается сверхдлительным сроком действия.…Сульфацил-натрий (альбуцид, собизон, офтальмид) - Sulfacilum natrium.
Форма выпуска. Порошок; раствор 30% в ампулах по 5 мл; раствор 30% во флаконах по 5 и 10 мл; раствор 20% в тюбиках капельницах по 1,5 мл; раствор… Хранение. По списку “Б”. В прохладном, защищенном от света месте. Срок… Действие. Антимикробное при стафилококковых, стрептококковых, пневмококковых, колибациллярных и сальмонелезных…Мафенид - Maphenidum.
Сульфаниламидный препарат для наружного применения.
Форма выпуска. Мазь 10% в банках оранжевого стекла по 50 г и 2 кг.
Действие и применение. Широкий спектр действия. Наружно для лечения инфицированных ран, ожогов, пролежней и др.
Фталазол (талидин, талисульфазол, талазол и др) - Phtalazolum.
Форма выпуска. Порошок, таблетки по 0,5 г. Хранение. По списку “Б”. Срок хранения -10 лет. Действие. Антимикробное в отношении кишечной группы патогенных микроорганизмов и некоторых грамотрицательных. Очень…Сульгин (гуаницил, гуамид, гуасепт и др.) - Sulginum.
Форма выпуска. Порошок, таблетки. Хранение. По списку “Б”. В хорошо укупоренной посуде. Срок хранения - 5 лет. … Действие. Как фталазол, слабо чувствительны к нему сальмонеллы.Фтазин - Phtazinum.
Форма выпуска. Порошок, таблетки по 0,5 г. Хранение. По списку “Б”. В сухом защищенном от света месте. Срок хранения - 2… Действие. Спектр антимикробного действия как у сульфапиридазина. В кишечнике постепенно распадается до…Салазопиридазин - Salazopyridasinum.
Форма выпуска. Порошок, таблетки по 0,5; суспензия 5% во флаконах по 250 мл; свечи по 0,5 г. Хранение. По списку “Б”. В прохладном, защищенном от света месте. Срок… Действие. Антимикробное, противовоспалительное. В кишечнике препарат распадается с высвобождением сульфапиридазина,…Салазодиметоксин - Salazodimetoxinum.
Порошок оранжевого цвета. Без запаха, практически не растворим в воде и спирте.
Форма выпуска. По списку “Б”. Срок хранения - 2 года.
Действие и применение. Аналогично салазопиридазину.
Комбинированные препараты с триметопримом
Ко-тримоксазол (бактрим, бисептол, ориприм и др.) - Co-Trimoxasole.
Форма выпуска. Таблетки содержащие 400 мг сульфаметоксазола и 80 мг триметоприма; таблетки содержащие соответственно по 100 и 20 мг каждого. Хранение. По списку “Б”. В защищенном от света месте. Действие. Бактерицидное в отношении грамположительных и грамотрицательных микроорганизмов, в том числе бактерий,…Тримеразин - Trimerazinum.
Форма выпуска. Порошок в пакетах по 300 и 100 г; таблетки. Хранение. По списку “Б”. В защищенном от света месте. Действие. Широкий спектр противомикробного действия.Нитрофураны
Механизм противомикробного действия состоит в блокировании внутриклеточного дыхания. Являясь акцептором ионов водорода, они конкурируют с… Нитрофураны высокоэффективны к антибиотико- и сульфаниламидоустойчивым… Различные виды животных имеют неодинаковую чувствительность к нитрофуранам. Наиболее чувствительны телята, птица и…Фурацилин (мастофуран, фуразин, вабрацид и др.)- Furacilinum.
Форма выпуска. Порошок, таблетки по 0,02 и 0,1 г., мазь 0,2%. Хранение. По списку “Б”. В защищенном от света месте. Действие. Антимикробное в отношении возбудителей анаэробных инфекций, грамположительных и грамотрицательных…Фурапласт - Furaplastum.
Форма выпуска. Жидкость во флаконах из оранжевого стекла по 50 мл. Хранение. По списку “Б”. В защищенном от света и огня месте. Действие. Антисептическое. На поверхности образует защитную пленочку.Мазь фастин - Unguentum Fastinum.
Мазь желтоватого цвета. Содержит фурацилин -2%, синтомицин -1,6%, анестезин -3%, ланолин, стеарин и воду до 100%.
Форма выпуска. Мазь в баночках из оранжевого стекла по 25 г.
Хранение. По списку “Б”. В защищенном от света месте, при температуре не выше +100С.
Действие. Противомикробное, местноанестезирующее, противовоспалительное.
Применение. Для лечения гнойных ран, ожогов, пролежней. Назначают наружно.
Лифузоль - Lifusolum.
Форма выпуска. Жидкость в аэрозольных алюминиевых банках по 94 и 200 мл с распылителем. Хранение. По списку “Б”. В дали от отопительных приборов. Действие. При нанесении на поверхности образует антисептическую защитную пленку, прочно удерживающуюся на поверхности…Фурадонин (урофуран, инфур, нифурантин и др.) - Furadoninum.
Форма выпуска. Таблетки по 0,05, таблетки растворимые в кишечнике по 0,1 и 0,03 г. Хранение. По списку “Б”. В сухом защищенном от света месте. Действие. Антимикробно в отношении большинства грамположительных и грамотрицательных микроорганизмов. Антимикробная…Фуразолин (алтафур, фуралтадон, виофурал и др.) - Furazolinum.
Форма выпуска. Порошок, таблетки по 0,05 г. Хранение. По списку “Б”. В хорошо закрытой посуде. Срок хранения 3 года. Действие. Бактериостатическое и бактерицидное в отношении большинства грамположительных и грамотрицательных…Фуразонал - Furazonalum.
Форма выпуска. Таблетки по 0,1 г. Хранение. По списку “Б”. В хорошо закрытой посуде из темного стекла. Действие. Антимикробное. Более выражено в отношении эшерихий, сальмонелл.Фурагин (фуразидин) - Furaginum.
Форма выпуска. Порошок, таблетки по 0,05. Хранение. По списку “Б”. В защищенном от света месте. Действие. Антимикробное, по типу фурадонина, но слабее на грамотрицательные микроорганизмы. Не теряет своей активности…Фурагин растворимый (солафур, фуромаг и др.) - Furaginum solubile.
Форма выпуска. Порошок в банках по 100 г; капсулы по 0,05 г. Хранение. По списку “Б”. Действие. Аналогично фурагину. Высокая растворимость препарата позволяет вводить его внутривенно и создавать быстро…Фуразолидон (фураксон, лефтин, диафурон и др.) - Furazolidonum.
Форма выпуска. Порошок; таблетки по 0,05; пенообразующие свечи (по 4-5 мг препарата). Хранение. По списку “Б”. В защищенном от света месте при комнатной… Действие. Антимикробное в отношении грамположительных и грамотрицательных микроорганизмов, трипоносом, трихомонад,…Фуракрилин - Furacrilinum.
Форма выпуска. Порошок; таблетки по 0,05; мазь гидрокортизон-фуракрилиновая. Хранение. По списку “Б”. В защищенном от света месте. Действие. Антимикробное подобно фуразолидону, но по силе в 10 раз сильнее. Эффективность снижается в присутствии крови…Нитрофурилен - Nitrofurilenum.
Форма выпуска. Раствор спиртовой 0,05%; мазь 0,05% и 0,1%. Хранение. По списку “Б”. В посуде из темного стекла, в защищенном от света… Действие. Фунгистатическое в отношении различных дерматофитов ( микроспории, трихофитон, аспергиллюсы),…Производные 8-оксихинолина
Синтетические препараты на основе оксихинолина. Обладают в различной степени антимикробным, противопаразитарным и противогрибковым действием.
Хинозол - Chinosolum (8-оксихинолина сульфат, идрил, криптонал и др.).
Форма выпуска. Порошок. Хранение. Список “Б”. В хорошо закупоренных банках. Действие. Антимикробное, нарушает синтез нуклеиновых кислот, белка и цитоплазматических мембран. Способствует…Энтеросептол - Enterosrptolum (хиноформ, энтерусан, энтероквинол и др.).
Форма выпуска. Порошок, таблетки по 0,1 г. Хранение. Список “Б”. В сухом, защищенном от света месте. Действие. Бактериостатическое в отношении эшерихий, сальмонелл, кокков, амеб, трихомонад и дрожжеподобных грибов. Из…Нитроксолин - Nitroxolinum (5-нок, никонол, уритрол и др.).
Форма выпуска. Таблетки по 0,05 г. Хранение. Список “Б”. В сухом темном месте. Действие. Антимикробное в отношении грамположительных и грамотрицательных бактерий и некоторых грибов рода Сandida.…Интетрикс - Intetrix.
Комплексный препарат.
Форма выпуска. Таблетки.
Хранение. Список “Б”.
Действие. Антимикробное в отношении грамположительных и грамотрицательных бактерий. Подавляет развитие амеб и дрожжеподобных грибов.
Применение. При диспепсии, энтероколитах, дизентерии и др. Назначают энтерально 3 раза в сутки из расчета: телятам по 3 таблетки; поросятам и ягнятам по 1 таблетке; собакам 1-2 таблетки.
Производные хиноксалина
Синтетические препараты, которые высокоэффективны при острых бактериальных инфекциях, в том числе и при инфекциях, трудно поддающихся лечению другими антимикробными средствами.
Хиноксидин - Сhinoxydinum.
Форма выпуска. Таблетки по 0,25 г. Хранение. Список “Б”. Действие. Противомикробное, широкий спектр. К нему высокочувствительны эшерихии, сальмонеллы, шигелы, протей,…Диоксидин - Dioxydinum.
Форма выпуска. 1% раствор в ампулах по 10 мл (для местного применения); 0,5% раствор в ампулах по 10 и 20 мл (для внутривенного и внутриполостного… Хранение. Список “Б”. В защищенном от света месте. Действие. тимикробное, широкий спектр.Диоксиколь - Dioxycolum.
Комплексный препарат включающий диоксидин, тримекаин, метилурацил и полиэтиленоксид.
Форма выпуска. Мазь в банках из оранжевого стекла по 30 и 100 г.
Хранение. Список “Б”.
Применение. При гнойных ранах наносят на пораженные участки 1 раз в сутки.
Производные нафтиридина
Хинолоны. Фторхинолоны.
Производные нафтиридина, это синтетические соединения родственные оксихинолинам. На основе нафтиридинов синтезирована новая группа химических соединений - производные 4-хинолона. Особенно активны препараты, которые в 6-м положении содержат фтор. Эти препараты названы фторхинолонами. В настоящее время в практике ветеринарной медицины широко применяются препараты нафтиридина и фторхинолона.
Кислота налидиксовая - Acidum nalidixicum (невиграмон, невиграм, поликсидин и др.).
Форма выпуска. Капсулы и таблетки по 0,5 г. Хранение. Список “Б”. Действие. Бактерицидное и бактериостатическое в отношении грамотрицательных бактерий, кишечной, дизентерийной и…Кислота оксолиниевая - Acidum oxolinicum (грамурин, урбид, уриграм и др.).
Форма выпуска. Таблетки по 0,25 г. Хранение. Список “Б”. Действие. Широкий спектр. Более сильно влияет на грамотрицательные бактерии. По активности в 3-4 раза сильнее…Пефлоксацин - Pefloxacinum (пефлобид, абактал, пефлацин и др.).
Форма выпуска. Таблетки по 0,4 г; 8% раствор в ампулах по 5 мл (0,4 г препарата в ампуле). Хранение. Список “Б”. Действие. Широкий спектр с более выраженной активностью в отношении грамотрицательных микроорганизмов. Эффективен при…Норфлоксацин - Norfloxacin (норфлокс, нолицин, норбактини др.).
Белый порошок с желтоватым оттенком.
Форма выпуска. Таблетки по 0,2 и 0,4 г.
Хранение. Список “Б”.
Действие и применение. Аналогично пефлоксацину.
Офлоксацин - Ofloxacin (флобоцин, таривид, уросин и др.).
Форма выпуска. Таблетки по 0,2 г. Хранение. Список “Б”. Действие. Бактерицидное, преимущественно к грамотрицательным бактериям. Подавляет развитие всех микроорганизмов…Ципрофлоксацин - Cyprofloxacin (ципробай, ципролет, ципродар и др.).
Форма выпуска. Таблетки по 0,25; 0,5 и 0,75 г; 0,2% раствор во флаконах по 50 и 100 мл; 1% раствор в ампулах по 10 мл (подлежит разведению). Хранение. Список “Б”. Действие. Бактерицидное. Широкий спектр. Быстро всасывается из желудочно-кишечного тракта. Хорошо проникает во все…Байтрил - Baytril.
Форма выпуска. Раствор 2,5% во флаконах по 50 мл; 5% - во флаконах по 100 мл и 10% во флаконах по 100 мл ( в 1 мл раствора содержится соответственно… Хранение. Список “Б”. Во флаконах из оранжевого стекла. В сухом темном месте… Действие. Широкий спектр. Энрофлоксацин, входящий в состав байтрила подавляет развитие большинства грамположительных и…Энротим - Enrottim.
Форма выпуска. Энротим 5% порошок (в 100 мл 5 г энрофлоксацина), энротим 10% порошок (в 100 мл 10 г энрофлоксацина), энротим 10% оральный раствор (в… Действие и применение. Аналогично байтрилу. Примерно аналогичные препараты выпускаются под названием энроксил, энробиозол, энрозолол, флубактин и др.Антибиотики
Еще И.И. Мечников (1845-1916) предложил использовать молочнокислые бактерии для подавления жизнедеятельности патогенной микрофлоры… В настоящее время получено примерно 35 тысяч антибиотиков и их аналогов,… Получают антибиотики биосинтетическим (при культивировании различных продуцентов), синтетическим и полусинтетическим…Сроки
Запрета убоя животных, использования яиц и молока в пищу после последнего применения наиболее часто используемых антибиотиков
Несмотря на незначительную токсичность антибиотиков для макроорганизмов - антибиотикотерапия может сопровождаться побочными реакциями или… 1. Привыкание и развитие устойчивости у патогенной микрофлоры к различным… 2. Развитие аллергической реакции, которая сопровождается крапивницей, кожным зудом, сыпью, отеками и даже…Пенициллины
Бензилпенициллин - нестойкая одноосновная кислота, которая быстро разрушается, поэтому применяют ее различные соли (калиевая, натриевая,… Природные пенициллины, это антибиотики узкого спектра де йствия. Они оказывают… Механизм действия препаратов бензилпенициллина сводится к тому, что они подавляют синтез клеточной стенки…Биосинтетические пенициллины
Бензилпенициллина натриевая и калиевая соли - Benzilpenicillinum natrium et kalium (Penicillin - II, Penicillin G).
Форма выпуска. Герметически закрытые резиновыми пробками с металлическими колпачками флаконы по 125000, 250000, 500000 и 1 000000 ЕД. Хранение. По списку “Б”. В сухом месте при комнатной температуре. Срок… Применение. Перед введением препараты растворяют в стерильном изотоническом растворе натрия хлорида, дистиллированной…Бензилпенициллина новокаиновая соль - Benzilpenicillinum novocainum. (Новоциллин, проциллин).
Форма выпуска. Флаконы по 300000, 600000 ЕД. Хранение. По списку “Б”. В сухом месте при комнатной температуре. Срок… Применение. Перед применением растворяют путем введения во флакон 2-4 мл стерильного изотонического раствора натрия…Феноксиметилпенициллин - Phenoxymethylpenicillinum (Фенациллин, феноксипен).
Белый кристаллический порошок, плохо растворим в воде. Кислотоустойчив, применяется энтерально.
Форма выпуска. Таблетки по 0,1 и 0,25 г (100000 и 250000 ЕД).
Хранение. По списку “Б”. В сухом месте при комнатной температуре. Срок хранения 4 года.
Применение. Назначают как и другие бензилпенициллины внутрь из расчета на 1 кг массы животного: КРС 4000-10000 ЕД, МРС 10000-20000, свиньям и собакам 10000-15000, курам 100000-200000 ЕД.
Бициллин - Bicillinum (Бензатинпенициллин, дуропенин, пенодур).
Форма выпуска. Флаконы (бициллин-1 по 300000, 600000, 1200000 и 2400000 ЕД; бициллин-3 - 300000, 600000 и 1200000 и бициллин-5 - 1500000 ЕД). Хранение. По списку “Б”. В сухом месте при комнатной температуре. Применение. Препараты назначают только внутримышечно. Суспензию готовят непосредственно перед применением. Бициллин…Полусинтетические пенициллины
Метициллина натриевая соль - Methicillinum natrium (белфациллин, целбенин, димоциллин, стафциллин, синтициллин и др.).
Форма выпуска. Флаконы по 1 г. Хранение. По списку “Б”. В сухом месте при комнатной температуре. Применение. Перед применением асептически растворяют в 2 мл дистиллированной воды. Метициллин высокоэффективен против…Оксациллина натриевая соль - Oxacillinum natrium (кристоциллин, микропенин, бактоцилл, простафилин и др.).
Форма выпуска. Таблетки по 0,25 и 0,5 г., капсулы по 0,25 г, флаконы по 0,25 г активного вещества. Хранение. По списку “Б”. В сухом темном месте, при комнатной температуре. Срок… Действие и применение. Спектр антимикробного действия оксациллина аналогичен пенициллину. Основным отличием является…Диклоксациллина натриевая соль - Dicloxacilinum natrium (бриспен, констрофил, динапен, ноксабен и др.).
Форма выпуска. Капсулы по 0,125 и 0,25 г и флаконы по 0,125 и 0,25 г. Хранение. Список “Б”. В темном месте при комнатной температуре. Срок хранения… Действие и применение. Антимикробный спектр диклоксациллина аналогичен оксациллину, но он более полно и быстро…Ампициллин - Ampicillinum (бритапен, пентрексил, пенбритин, полициллин м др.).
Форма выпуска. Выпускают для внутреннего применения в форме тригидрата (Ampicillinum trihydras). Форма выпуска - таблетки и капсулы по 0,25 г. Для… Хранение. По списку “Б”. В посуде из оранжевого стекла, при комнатной… Действие и применение. Это антибиотик широкого спектра действия, активен в отношении многих грамположительных и…Карбенициллина динатриевая соль - Carbenicillinum dinatricum (карбецин, карбипен, геопен, пиопен и др.).
Форма выпуска. Флаконы по 1 г. Хранение. Список “Б”. В темном месте при температуре +50С. Срок хранения 1,5… Действие и применение. Это антибиотик широкого спектра действия. Активен в отношении многих грамположительных и…Микроцид - Microcidum.
Стерильная жидкость желтоватого цвета.
Форма выпуска. Флаконы по 50 и 100 мл.
Хранение. Список “Б”. При температуре не выше +200С.
Действие и применение. Действует на большинство грамположительных и грамотрицательных микроорганизмов. Применяют наружно для лечения инфицированных ран, ожогов, язв, экзем и др.
Карфециллин - Carfecillin (карфексил, пурапен, утициллин и др.).
Форма выпуска. Капсулы по 0,25 г. Хранение. Список “Б”. В сухом месте. Действие. Бактерицидное в отношении большинства грамположительных и грамотрицательных микроорганизмов, за исключением…Амоксиклав порошок - Pulvis Amoxsiklav.
Форма выпуска. Порошок по 500 г в упаковке. Хранение. По списку “Б”. В сухом затемненном месте при температуре от 0 до… Действие. Широкий спектр действия. К препарату чувствительны большинство грамположительных и грамотрицательных…Амоксициллин 15% - Amoxicillin 15%.
Форма выпуска. Флаконы по 100 мл. Хранение. Список “Б”. В защищенном от света месте при температуре 15-180С. Действие. Широкий спектр антимикробного действия. Высокочувствительны к препарату эшерихии, сальмонеллы, пастереллы,…Цефалоспорины
Цефалотина натриевая соль - Cephalotinum natrium (кефлин, цефалотин, цепорацин и др.).
Форма выпуска. В герметически закрытых флаконах по 0,5; 1 и 2 г. Хранение. Список “Б”. В сухом затемненном месте при комнатной температуре. Действие. К цефалотину чувствительны большинство грамположительных и грамотрицательных микроорганизмов. Устойчив к…Цефалексин -Сephalexinum (цепорекс, цефаксин,цефлон, кефлекс и др.).
Форма выпуска. Капсулы по 0,25 г ; по 35 г в банках из оранжевого стекла емкостью 150 мл. В каждой банке содержится 1,5 г активного вещества. Хранение. Список “Б”. В сухом темном месте при комнатной температуре.… Действие. Широкий спектр действия. Оказывает бактерицидное действие на грамположительные и грамотрицательные…Цефалоридин - Cephaloridinum (цепорин, цефлорин и др.).
Форма выпуска. Порошок во флаконах по 0,25; 0,5 и 1 г. Хранение. Список “Б”. В темном месте при температуре не выше +100С. Действие. Бактерицидно на кокковые формы микрорганизмов (стафилококки, пневмококки, стрептококки, менингококки,…Кобактан 2,5% - Cobactan 2,5%.
Форма выпуска. Флаконы по 50 мл. Хранение. Список “Б”. В сухом темном месте при температуре от +2 до +250С.… Действие. Кобактан проявляет широкий спектр действия как на грамположительные, так и на грамотрицательные бактерии, в…Цефотaксим - Сefоtaxim (кофоран, цефотакс, хемцеф).
Форма выпуска. Порошок во флаконах по 0,5; 1 и 2 г. Хранение. Список “Б”. В сухом темном месте. Действие. Бактерицидное на грамположительные и гармотрицательные микроорганизмы. Хорошо всасывается при внутримышечном…Аминогликозиды
Стрептомицина сульфат - Streptomycini sulfas (эндострепт, диплостреп, стрепсульфат и др.).
Форма выпуска. Герметично закрытые флаконы по 0,25; 0,5 и 1 г (250000; 500000 и 1000000 ЕД). Под названием стрептоветин (стрептомицин… Хранение. Список “Б”. При температуре не выше +250С. Действие. Широкий спектр антимикробного действия. Особенно чувствительны эшерихии, бруцеллы, возбудители дизентерии,…Страептомицин-хлоркальциевый комплекс - Streptomycini et calcii chloridum.
Форма выпуска. В герметически закрытых флаконах по 0,1; 0,2 и 0,5 г. Хранение. Список “Б”. В сухом месте при комнатной температуре. Действие. Как стрептомицина сульфат. Более эффективен при введении в спинномозговой канал (эндолюмбально).Неомицина сульфат - Neomycini sulfas (колимицин, мицерин, фрамцетин и др.).
Форма выпуска. Герметически закрытые флаконы по 0,5 г, таблетки по 0,1 и 0,2 г и мазь 0,5 и 2%. Хранение. Список “Б”. Действие. Широкий спектр антимикробного действия. Особенно эффективно на грамположительные (стафилококки и…Канамицин - Kanamycinum (кантрех, капоксим, канамтрекс и др.).
Это продукт жизнедеятельности гриба Streptomyces kanamyceticus. Антибиотик широкого спектра действия. Обладает высокой активностью в отношении грамположительных, гармотрицательных и кислотоустойчивых микроорганизмов. Выпускается две лекарственные формы канамицина.
Канамицина сульфат - Kanamycini sulfas.
Форма выпуска. В герметически закрытых флаконах по 0,5 и 1 г. Хранение. Список “Б”. В сухом затемненном месте. Действие.Бактерицидно действует на большинство грамположительных и грамотрицательных микроорганизмов, а также…Канамицина моносульфат - Kanamycini monosulfas.
Форма выпуска. Таблетки и капсулы по 0,125 и 0,25. Под названием веткан во флаконах по 0,1; 2; 100; 200 и 500 г. Хранение. Список “Б”. В сухом месте при комнатной температуре. Действие. При энтеральном введении из желудочно-кишечного тракта практически не всасывается. Действует бактерицидно на…Гентамицина сульфат - Gentamycini sulfas (генцин, гарамицин, гентоцин и др.).
Форма выпуска. ампулы по 1; 2; 5 и 10 мл 4% раствора. Флаконы - порошок по 0,08 г. Мазь 0,1% и глазные капли 0,3%. Хранение. Список “Б”. В сухом месте при комнатной температуре. Действие. Широкий спектр противомикробного действия. Особенно высокоактивен в отношении эшерихий, стафилококков и…Тобрамицина сульфат - Tobramycini sulfas (обрацин, торбекс, бруламицин и др.).
Форма выпуска. Порошок во флаконах по 40; 50; 75 и 80 мг. Хранение. Список “Б”. В защищенном от света месте при температуре +40С. Действие. Широкий спектр антимикробного действия. Эффективен в отношении грамположительных и грамотрицательных…Апрамицина сульфат - Apramycini sulfas.
Форма выпуска. Порошок в целлофановых пакетах по 100 и 200 г. Хранение. Список “Б”. В сухом защищенном от света месте при температуре от +16… Действие. Широкий спектр антимикробного действия. Не эффективен в отношении возбудителей анаэробных инфекций и…Сизомицина сульфат - Sisomycini sulfas (сисомин, экстрамицин, матомицин и др.).
Форма выпуска. 5% раствор в ампулах по 1; 1,5 и 2 мл; 1% раствор в ампулах по 2 мл. Хранение. Список “Б”. В защищенном от света месте при комнатной температуре. … Действие. По спектру действия близок к гентамицину. Более эффективен в отношении энтеробактерий, протея и синегнойной…Амикацина сульфат - Amikacinum sulfas (амикан, амикозит, селемицин и др.).
Форма выпуска. Порошок во флаконах по 0,1; 0,25 и 0,5 г. Растворы 5%; 12,5% и 25% в ампулах по 2 мл (соответственно 100; 250 и 500 мг в ампуле). Хранение. Список “Б”. В сухом защищенном от света месте при комнатной… Действие. Один из наиболее активных аминогликозидов. Эффективен в отношении грамположительных и грамотрицательных…Тетрациклины
Антимикробное действие тетрациклинов обусловлено нарушением синтеза белка вследствие блокады функции рибосом. При неправильном, длительном…Тетрациклин - Tetracyclinum (ахромицин, цикломицин, панмицин и др.).
Форма выпуска. Порошок, таблетки по 0,05; 0,1 и 0,25, капсулы по 100000 и 200000 ЕД, мазь глазная 1%, мазь дитетрациклиновая, таблетки тетрациклина… Хранение. Список “Б”. В темном месте при комнатной температуре. Действие Обладает широким спектром противомикробного действия. К нему чувствительны грамположительные и…Тетрациклина гидрохлорид - Tetracyclini hydroсhloridum (амбрамицин, амрацин, польфамицин и др.).
Форма выпуска. Порошок во флаконах по 0,1; таблетки по 0,1 и 0,25 г. Хранение. Список “Б”. В сухом темном месте. Действие. Аналогично тетрациклину.Окситетрациклина дигидрат - Oxytetracyclini dihydras (тархоцин, тетран, окситикоин и др.).
Форма выпуска. Таблетки по 0,25 г. Мазь “Оксизон” содержит 3% окситетрациклина дигидрата и 1% гидрокортизона ацетата в тубах по 10,0. Хранение. Список “Б”. В темном сухом месте. Действие и применение. Аналогично тетрациклину. Назначают энтерально 2 раза в сутки в дозах (мг/кг): лошадям и КРС -…Окситетрациклина гидрохлорид - Оxytetracyclini hydraсhloridum (геомицин).
Форма выпуска. Порошок во флаконах по 0,25 и 0,5 г. Мазь “Гиоксизон” по 10 г. Аэрозоль “Оксицихлозоль” в баллонах по 70 г и аэрозоль “Оксикорт” в… Применение. При колибактериозе, сальмонеллезе, пастереллезе, роже свиней,…Нитокс-200 - Nitox-200.
Форма выпуска. Флаконы 50 мл. Хранение. Список “Б”. В темном месте при температуре от 0 до +200С. Действие. Широкий спектр антимикробного действия. При внутримышечном введении хорошо всасывается. Терапевтическая…Оксивет - Oxyvet.
Форма выпуска. Стерильная жидкость во флаконах по 50 и 100 мл. Хранение. Список “Б”. В темном сухом месте при температуре от 0 до + 250С. Действие. Широкий спектр антимикробного действия. Хорошо всасывается при внутримышечном введении. Терапевтическая…Эгоцин 20 - Egocin 20.
Форма выпуска. Пакеты по 1 кг. Хранение. Список “Б”. В плотно укупоренной таре, в сухом защищенном от света… Действие. Высокоэффективен в отношении большинства грамположительных и грамотрицательных микроорганизмов, а также…Биовит - Biovitum.
Форма выпуска. Биовит-40; Биовит-80; Биовит-120 в пакетах по 25; 50; 100 и 200 г. Бумажных мешках по 5; 10; 15; 20 и 25 кг. Действие. Широкий спектр антимикробного действия. К препарату… Применение. Для профилактики и лечения пастереллеза, колибактериоза, сальмонеллеза, сибирской язвы, лептоспироза,…Морфоциклин - Morphocyclinum.
Форма выпуска. Во флаконах по 0,1 и 0,15 г морфоциклина. Хранение. Список “Б”. В сухом защищенном от света месте при температуре не… Действие. Широкий спектр антимикробного действия. При внутривенном введении сразу создает высокую концентрацию…Метациклина гидрохлорид - Metacyclini hydrochloridum (адрамицин, рондомицин, бревициллин и др.).
Форма выпуска. Капсулы по 150 и 300 мг. Хранение. Список “Б”. В сухом, защищенном от света месте при комнатной… Действие. Широкий спектр антимикробного действия. Более эффективен по сравнению с биосинтетическими препаратами,…Доксициклина гидрохлорид - Doxycyclini hydrpchloridum (доксидар, вибрамицин, биоциклин).
Форма выпуска. Капсулы по 50 и 100 мг; таблетки по 0,1 г. Хранение. Как и метациклина гидрохлорид. Действие. По спектру действия близок к другим тетрациклинам. При энтеральном введении быстро всасывается и в…Макролиды
Эритромицин - Erytromycinum (эритран, эрик, илозин, эритропед и др.).
Форма выпуска. Таблетки по 0,1 и 0,25 г. Мазь 1% в тубах по 3; 7; 10; 15 и 30 г. Хранение. Список “Б”. В сухом, защищенном от света месте при комнатной… Действие. Бактериостатическое в отношении грамположительных микроорганизмов. При энтеральном введнии быстро…Эритромицина фосфат - Erytromycini phosphas.
Форма выпуска. Порошок в герметически закрытых флаконах по 0,05; 0,1 и 0,2 г. Хранение. Список “Б”. В сухом, затемненном месте при комнатной температуре. … Действие и применение. Аналогично эритромицину. Назначается внутривенно 2 раза в сутки на изотоническом растворе…Олеандомицина фосфат - Oleandomycini phosphas (цикламицин, амицин, матромицин и др.).
Форма выпуска. Таблетки по 0,125 г; порошок во флаконах по 0,1; 0,25 и 0,5 г. Хранеие. Список “Б”. В защищенном от света месте при комнатной температуре. … Действие. Бактериостатическое в отношении грамположительной микрофлоры, особенно стафило-, стрепто- и пневмококков в…Олететрин - Oletetrinum.
Форма выпуска. Таблетки по 0,125 и 0,25. Капсулы по 0,25 г. Хранение Список “Б”. В защищенном от света месте. Действие. Широкий спектр. К олететрину чувствительны грамположительные (стафило-, стрепто- и пневмококки),…Тетраолеан - Tetraoleanum (сигмамицин).
Комбинированный антибиотик такого же состава как и олететрин.
Форма выпуска. Капсулы по 0,25. Порошок во флаконах по 0,25 и 0,5.
Хранеие. Список “Б”. В сухом защищенном от света месте.
Действие и применение. Аналогично олететрину. Назначают внутримышечно (реже внутривенно) 3-4 раза в сутки в дозах (мг/кг): лошадям и КРС - 5-10; мелкому рогатому скоту и свиньям - 8-15; собакам - 10-20 мг/кг.
Тилозина тартрат - Tylosini tartras.
Форма выпуска. Порошок в банках по 700 г и бочках по 25 кг. Хранеие. Список “Б”. В сухом, защищенном от света месте при температуре от 0… Действие. Широкий спектр. Действует бактериостатически в отношении грамположительных (кокков, коринебактерий,…Тиловет 10%; 25% - Tylovet 10%; 25%.
Форма выпуска.Порошок в пакетах по 500 г и мешках по 20 кг. Хранеие. Список “Б”. В сухом защищенном от света месте при температуре от 0 до… Действие и применение.Аналогично тилозина тартрату. Назначают энтерально с кормом в течение 14 суток свиньям массой до…Тилозин 50; 200 - Tylosinum 50; 200.
Форма выпуска. Жидкость во флаконах по 50 мл. Хранеие. Список “Б”. В сухом защищенном от света месте при температуре от +10… Действие.Высокоактивен в отношении большинства грамположительных и некоторых грамотрицательных бактерий, в том числе…Тилар 50% порошок - Pulvis Tylarum 50%.
Форма выпуска. Порошок в полиэтиленовых банках и пакетах по 100 и 200 г. Хранение. Список “Б”. В сухом, защищенном от света месте при температуре не… Действие. Действует губительно на микоплазм, хламидий, пастерелл, клостридий, риккетсий, некоторые виды стрептококков,…Фармазин - Pharmasinum.
Форма выпуска. Порошок в пластиковых пакетах или банках по 200 г. В 1 г препарата содержится 500 мг тилозина тартрата и наполнитель. Фармазин 50 и… Хранеие. Список “Б”. В сухом, защищенном от света месте при температуре от +5… Действие и применение. Аналогично тилару. Фармазин порошок назначают энтерально с водой или кормом птице - 0,5 г на 1…Фрадизин-50 - Fradisin-50.
Форма выпуска. Порошок в полимерных банках по 80 г и пакетах различной массы (1; 2; 5 и 10 кг). Хранение. Список “Б”. В сухом, защищенном от света месте при температуре не… Действие. Антимикробное - аналогично тилозина тартрату. Оказывает иммуно- и ростостимулирующее действие.Полимиксины (полипептиды).
Полимиксина М сульфат - Polymyxinum M sulfas.
Форма выпуска. Порошок в герметически закрытых флаконах по 300000 и 1000000 ЕД. Таблетки по 500000 ЕД. Мазь в тубах по 30 г (1 г мази содержит 20000… Хранение. Список “Б”. В сухом, защищенном от света месте. Действие. Задерживает рост кишечной и дизентерийной палочек, сальмонелл, синегнойной палочки. Обладает фунгицидным…Полимиксина В сульфат - Polymyxinum В sulfas (бациллоспорин, аэроспорин, полимикс).
Форма выпуска. Порошок во флаконах по 250000 ЕД (25 мг) и 500000 ЕД ( 50 мг). Хранение. Список “Б”. В сухом, защищенном от света месте при комнатной… Действие. Высокоэффективен в отношении грамотрицательных микроорганизмов, особенно с синегнойной палочке. При…Поливетин - Polyvetinum.
Форма выпуска. Порошок во флаконах по 5 и 10 г. Таблетки. Хранение. Список “Б”. В сухом, защищенном от света месте. Действие и применение. Аналогично полимиксина М сульфату. Назначают энтерально 2-3 раза в сутки в форме растворов. В…Бацилихин - Bacillichinum.
Форма выпуска.Бацилихин 30; бацилихин 60; бацилихин 90; бацилихин 120 с содержанием в 1 кг препарата соответственно 30; 60; 90 и 120 г бацитрацина.… Хранение. Список “Б”. В сухом, темном помещении при температуре от -20 до… Действие.Бацитрацин подавляет развитие грамположительной микрофлоры, в том числе стрепто-, стафилококков, клостридий,…Нубатрин 10; 15 - Nubatrin 10%; 15%.
Форма выпуска. Порошок в мешках по 25 кг. Хранение. Список “Б”. В упаковке изготовителя в сухом, темном месте при… Действие. Способствует инактивации патогенной и условно-патогенной микрофлоры в желудочно-кишечном тракте, стимулирует…Колистин - Colistin.
Форма выпуска. Порошок в мешках по 1 и 20 кг. Хранение. Список “Б”. В сухом темном месте в герметически закрытых мешках при… Действие. Колистин действует бактерицидно на грамотрицательные микроорганизмы в том числе пастереллы, бордетеллы,…Рифамицины
Природные антибиотики продуцируемые грибом Streptomyces. Активен в основном против грамположительных микроорганизмов и туберкулезных микобактерий.
Механизм действия рифамицинов заключается в нарушении синтеза РНК.
Рифамицин - Rifamycinum.
Форма выпуска.В ампулах по 1,5 и 3 мл с содержанием 125 и 250 мг препарата для внутримышечного применения и в ампулах по 10 мл (500 мг) для… Хранение. Список “Б”. В сухом темном месте. Действие. Бактерицидное в отношении грамположительных бактерий устойчивых к другим антибиотикам, а также в отношении…Рифампицин - Rifampicinum (римпацин, рифадин, рифамор и др.).
Форма выпуска. В капсулах по 0,05 и 0,15 г. Рифавет - препарат для ветеринарии. Маслянистая суспензия, содержащая в 1 мл 50 мг рифампицина. Хранение. Список “Б”. В сухом, темном месте. Рифавет при температуре не выше… Действие. Отличается от рифамицина более широким спектром действия. Эффективен в отношении микобактерий туберкулеза,…Противогрибковые антибиотики
Гризеофульвин - Griseofulvinum (фульцин, грицин, фунгивин и др.).
Белый кристаллический порошок, горький на вкус, плохо растворимый в воде. Форма выпуска. Таблетки по 0,125 г; 10% суспензия во флаконах по 100 мл; 2,5%… Хранение. Список “Б”. В сухом месте при комнатной температуре.Нистатин - Nistatinum (фунгицидин, фунгистатин, микостатин и др.).
Светло-желтый порошок со специфическим запахом, горький на вкус. Практически не растворим в воде, гигроскопичен, светочувствителен. Легко… Форма выпуска.Таблетки по 250000 и 500000 ЕД. Суппозитории по 250000 и 500000… Хранение. Список “Б”. В сухом защищенном от света месте при температуре не выше +50С.Леворин - Levorinum (леворидон).
Темно-желтый порошок, без запаха и вкуса. Практически не растворим в воде и спирте. Гигроскопичен, светочувствителен. Разрушается под действием… Форма выпуска. Порошок, таблетки по 500000 ЕД; мазь содержащая в 1 г 500000 ЕД… Хранение.Список “Б”. В сухом, темном месте при температуре не выше +40С.Леворина натриевая соль - Levorinum natrium.
Форма выпуска. Во флаконах по 200000 ЕД. Хранение. Список “Б”. В защищенном от света месте при темепратуре +40С. Действие. Аналогично леворину.Амфотерицин В - Amfotericinum B (фунгизон, амфоцил, амфостат и др.).
Порошок желтого или желто-оранжевого цвета. Практически не растворим в воде. Разрушается при высокой температуре. Форма выпуска.Порошок во флаконах по 50000 ЕД с приложением растворителя (для… Хранение. Список “Б”. В сухом, защищенном от света месте при температуре не выше +40С.Амфоглюкамин - Amphoglucaminum.
Аморфный порошок желтого цвета, растворим в воде. Гигроскопичен, светочувствителен, разрушается при высокой температуре. Форма выпуска. Таблетки по 100000 ЕД. Хранение. Список “Б”. В сухом, защащенном от света месте при температуре не выше +40С.Микогептин - Mycoheptinum.
Порошок темно-желтого цвета без запаха и вкуса. Практически не растворим в воде и очень мало в спирте. Светочувствителен, разрушается при повышенной… Форма выпуска. Таблетки по 500000 ЕД (50 мг) и мазь с содержанием в 1 г 15000… Хранение. Список “Б”. В сухом, защищенном от света месте при температуре не выше +40С.Антибиотики разных групп
Линкомицина гидрохлорид - Lincomycini hydrochloridum (линкоцин, линосин, нелорен и др.).
Белый кристаллический порошок, горький на вкус, легко растворимый в воде. Форма выпуска. Капсулы по 0,25; 30% раствор в в ампулах по 1 и 2 мл., мазь… Хранение. Список “Б”. В сухом защищенном от света месте, при комнатной температуре.Ристомицина сульфат - Ristomycini sulfas (ристоцетин, споитин и др.).
Порошок или кремовая масса без запаха. Растворим в воде. Форма выпуска. Порошок во флаконах по 100000 и 500000 ЕД. Хранение. Список “Б”. В защищенном от света месте, при температуре не выше +200С.Фузидин натрий - Fusidinum natrium (рамицин, фузидин, фунциддин и др.).
Белый с желтоватым оттенком кристаллический порошок, растворим в воде и спирте. Форма выпуска. Таблетки по 0,125 и 0,25 г. Хранение. Список “Б”. В сухом защищенном от света месте.Диэтаноламина фузидат - Diaetanolamini fusidas.
Форма выпуска. Порошок в герметически закрытых флаконах по 0,25 и 0,5 г с приложением растворителя ( по 2 мл во флаконе). Хранение. Список “Б”. В сухом защищенном от света месте, при температуре не… Действие и применение. Аналогично фузидину натрия. Назначают, при тяжелых инфекционно-воспалительных заболеваниях…Гель фузидин 2% - Gelium “Fusidinum” 2%.
Сложный гель в состав которого входит фузидиевая кислота.
Форма выпуска. Тубы по 15 г.
Хранение. Список “Б”.
Применение. При ожогах, глубоких ранах, фурункулезе, пиодермии и др. Гель наносят на пораженные поверхности 2 раза в сутки.
Грамицидин - Gramicidinum.
Жидкость светло-желтого цвета. Форма выпуска. 2% стерильный спиртовой раствор, грамицидиновая паста в тубах… Хранение. Список “Б”. В прохладном, защищенном от света месте.Гелиомицин - Heliomycinum.
Форма выпуска. 4% мазь в тубах по 10 г. Хранение. Список “Б”. В прохладном месте. Действие. Бактриостатическое или бактерицидное в отношении грамположительных и некоторых грамотрицательных…Спектиномицин - Spectinomycinum.
Белый порошок хорошо растворимый в воде. Форма выпуска. Порошок под названием “Спектам В”, в котором содержится 50%… Хранение. Список “Б”. В защищенном от света, прохладном месте.Фумагиллин - Fumagillinum.
Бесцветные кристаллы, почти нерастворим в воде, светочувствителен, разрушается при температуре выше +400С. Форма выпуска. Флаконы из темного стекла по 20 г. Хранение. Список “Б”. В сухом прохладном, защищенном от света месте.Комплексные антибиотики
Биофарм 120 - Biopharm 120.
Форма выпуска. В бумажных или полиэтиленовых мешках по 15 или 20 кг. Хранение. Список “Б”. В сухом месте при температуре не выше +200С. Действие. Подавляет развитие микоплазм, эшерихий, пастерелл, сальмонелл, балантидий, криптоспоридий и др.Дорин - Dorynum.
Форма выпуска. Порошок в ампулах по 60 мг, флаконах по 300 мг; 500 мг; 1000 и 2000 мг. Дорин П (Dorynum Р) - порошок белого цвета в пакетах по 50,… Хранение. Список “Б”. В защищенном от света месте при температуре от -40 до… Действие. Антимикробное в отношении большинства грамположительных и грамотрицательных микроорганизмов, в том числе…Лекомицин А - Lecomicin A.
Форма выпуска. Жидкость в пластмассовых флаконах по 140 и 980 мл. Хранение. Список “Б”. В сухом, защищенном от света месте при температуре от +4… Действие. Бактерицидное в отношении большинства грамположительных и гармотрицательных микроорганизмов. Особенно…Меклосин - Meclosinum.
Форма выпуска. Порошок в ампулах по 3 мл (40 мг). Хранение. Список “Б”. В защищенном от света месте при температуре от -20 до… Действие. Бактерицидное в отношении большинства грамположительных и грамотрицательных микроорганизмов, в том числе…Оксикан - Oxicanum.
Форма выпуска. Пакеты по 50; 100 и 500 г. Хранение. Список “Б”. В сухом, защищенном от света месте при температуре не… Действие. Широкий спектр антимикробного действия. Окситетрациклин хорошо всасывается, а канамицин почти не всасывается…Подоцин - Podocinum.
Форма выпуска. Порошок в ампулах по 3 и 5 мл и флаконах по 10 мл, соответственно (40, 80 и 160 мг препарата). Хранение. Список “Б”. В защищенном от света месте при температуре от -20 до… Действие. Высокоактивен в отношении синегнойной палочки, эшерихий, сальмонелл, шигелл, большинства грамположительных…Ривициклин - Ryvicyclinum.
Форма выпуска. Порошок в полиэтиленовых пакетах по 1000 г. Хранение. Список “Б”. В защищенном от света месте при температуре не выше… Действие. Подавляет развитие эшерихий, сальмонелл, стафилококков, стрептококков и других грамотрицательных и…Рифан - Rifanum.
Форма выпуска. Пакеты по 500 и 1000 г. Хранение. Список “Б”. В сухом, защищенном от света месте при температуре от… Действие. Бактериостатическое к большинству гармположительных и гармотрицательных микроорганизмов (стрепто-, стафило-,…Рифапол - Rifapolum.
Форма выпуска. Флаконы по 500 мл. Хранение. Список “Б”. В защищенном от света месте при температуре от +5 до… Действие. Полимиксин высокоэффективен в отношении грамотрицательных бактерий: сальмонелл, шигелл, пастерелл,…Рифациклин - Rifaciclinum.
Содержит тетрациклин и рифампицин. Форма выпуска. Флаконы по 500 мл. Хранение. Список “Б”. В защищенном от света месте при температуре от +5 до +200С.Препараты
Все антипротозойные средства подразделяют на несколько групп. Средства, которые применяются для уничтожения простейших паразитирующих в крови, называют противопироплазмидозными. Препараты, которые применяются для профилактики и лечения трихомоноза - противотрихомонозными и средства, применяемые для химиопрофилактики и химиотерапии при кокцидиозах - противококцидиозными.
Азидин - Azidinum (беренил, батризин и др.).
Форма выпуска. Порошок. Хранение. Список “Б”. В хорошо закупоренной посуде, в банках из темного… Действие. Трипаноцидное, пироплазмидозное.Аминоакрихин - Aminoacrichinum.
Форма выпуска. Порошок, таблетки по 0,1 и 0,3 г. Хранение. Список “Б”. В хорошо закрытых банках из темного стекла. Действие. Антипротозойное, трихомонадоцидное. Останавливает размножение простейших и гельминтов. Раздражает ткани.Бигумаль - Bigumalum (прогванил, палудрин и др.).
Форма выпуска. Порошок, таблетки по 0,05 и 0,1 г. Хранение. Список “Б”. В хорошо закупоренных банках из темного стекла, в… Действие.Протозооцидное. Хорошо всасывается из желудочно-кишечного тракта и в терапевтической концентрации сохраняется…Гемоспоридин - Haemosporidinum (ЛП-2, герамин и др.).
Форма выпуска. Порошок. Хранение. Список “Б”. В хорошо закупоренных банках, в защищенном от света… Действие. Антипротозойное.Диамидин - Diamidinum (имидозолин, имидокарб и др.).
Форма выпуска. Порошок в полиэтиленовых пакетах по 0,5 кг., Хранение. Список “Б”. В хорошо закупоренных банках при температуре от -10 до… Действие.Пироплазмоцидное. Действует губительно на пироплазм, нутталий, бабезий и франсиелл. Возможна повышенная…Имизол - Imisolum.
Форма выпуска. Жидкость во флаконах из оранжевого стекла по 100 мл. Хранение. Список “Б”. В защищенном от света месте при температуре от +2 до… Действие.Протозооцидное в отношении пироплазм, бабезий, франсиелл, нутталий.Пироплазмин - Piroplasminum.
Форма выпуска. Порошок. Хранение. Список “Б”. В стеклянных банках из темного стекла, в защищенном от… Действие .Антипротозойное и антимикробное. 1% раствор пироплазмина убивает вегетативные формы микрорганизмов за 30…Трихомонацид - Trichomonacidum.
Желтый кристаллический порошок, хорошо растворимый в воде. Термостабилен.
Форма выпуска. Порошок, таблетки по 0,025; 0,05 и 0,1 г.
Хранение. Список “Б”.
Действие. Трихомоноцидное и слабое антимикробное.
Применение. При трихомонозе животных. Назначают энтерально в течение 3-5 дней в дозе 0,6-1,2 г на животное. Одновременно в уретру и шейку матки вводят 0,5-1% раствора на 10-15 минут.
Метронидозол - Metronidosolum (трихопол, клион, орвагил и др.).
Форма выпуска. Таблетки по 0,25 и 0,5 г; суппозитории по 0,5 г. Хранение. Список “Б”. Действие. Антипротозойное и противомикробное. К препарату высокочувствительны трихомонады, балантидии, амебы, лямблии,…Нитазол - Nitаsolum (трихоцид, трихорал, трихолавал и др.).
Желтый с зеленоватым оттенком кристаллический порошок, практически нерастворим в спирте.
Форма выпуска. Таблетки по 0,1; суппозитории по 0,12 г; суспензия 2,5% во флаконах по 100 мл.
Действие.Подавляет развитие большинства простейших и особенно трихомонад.
Применение. При остром и хроническом трихомонозе. Назначают в основном интравагинально.
Наганин - Naganinum (антрипол, супамин, нагапол и др.).
Форма выпуска.Порошок для лошадей; порошок для верблюдов. Хранение. Список “Б”. В хорошо закрытых банках из темного стекла, в защищенном… Действие. Трипаноцидное и пироплазмоцидное.Tрипансинь - Trypanum coeruleum.
Форма выпуска. Порошок. Хранение. Список “Б”. В хорошо закрытых банках, в защищенном от света месте. … Действие.Противопироплазмидозные.Сакокс
Сакокс-120 микрогранулят - кокцидиостатик для бройлеров и кур несушек. Кормовой антибиотик ионоформного действия и кокцидиостатик для свиней. Активно подавляет все значимые виды.
Применяется для профилактики дизентерии (500 г сакокса на 1 т корма), некротического энтерита и Clostridium perfringens у бройлеров.
Сакокс-120 микрогранулят применяют в дозировке: бройлерам – 420 г/т корма; несушкам – 330 г/т корма; свиньям – 125 г/т корма; поросятам – 333 г/т корма; для профилактики дизентерии – 500 г/т корма.
Байкокс
Перед употреблением байкокс смешивают с питьевой водой и осторожно перемешивают. Рекомендуемая доза - 7 мл толтразурила на 1 кг живой массы в… Байкокс обладает хорошей переносимостью даже при 10-кратном превышении дозы. … Убивать на мясо птицу после применения байкокса можно через 8 дней.Практическое применение суспензии фазинекса жвачным
Ацемидофен Ацемидофен — в химическом отношении представляет бис [b- (4-ацетил-аминофенофенилокси) этиловый] эфир. Это мелкий,…Политрем
При пероральном введении политрема белым мышам ЛД50 составляет 12 г/кг живой массы. Препарат не обладает эмбриотоксическим, тератогенным и… Политрем применяют против половозрелых фасциол жвачным животным в смеси с… Для терапии парамфистоматидозов политрем применяют в дозе 0,5 г/кг живой массы с концентрированными кормами.Наставленние по применению тимбендазола 22%-ного
Гранулята для терапии и профилактики гельминтозов животных.
Общие сведения
1.1. Тимбендазол 22%-ный гранулят (Timbendazolum) готовый к применению гранулированный антгельминтик, содержащий 22% фенбендазола и наполнители (лактоза, кормовой мел, осажденный мел или другие инертные вещества).
1.2. Препарат представляет собой гранулы светло-серого цвета, со слабым специфическим запахом, хорошо распадающиеся во влажном корме. Препарат высокоустойчив при хранении. Фенбендазол разлагается при температуре 226-2300С.
1.3. Тимбендазол 22%-ный гранулят выпускается в готовом к применению виде в двойных полиэтиленовых пакетах массой 0,1-5,0 кг и в полимерных емкостях по 0,5-10,0 кг.
1.4. Срок хранения 3 года. Хранить препарат следует в заводской упаковке в темном сухом месте при температуре от +40 до + 250С.
Механизм действия
2.2. Тимбендазол 22%-ный гранулят плохо всасывается из пищеварительного тракта животных. Из их организма он выделяется в виде метаболитов и только… 2.3. Тимбендазол 22%-ный гранулят малотоксиный препарат. Максимально… 2.4. Антгельминтик широкого спектар действия против нематод и цестод.Порядок применения
3.1. Тимбендазол 22%-ный гранулят применяют свиньям, крупному рогатому скоту, овцам, лошадям, пушным зверям и собакам при желудочно-кишечных и легочных нематодозах (желудочно-кишечные стронгилятозы, аскаридоз, трихоцефалез, эзофагостомоз, стронгилоидоз, диктиокаулез, паскаридоз, токсаскаридоз, токсокароз, унцинариоз и др.), мониезиозе овец, цестодозах собак.
3.2. Тимбендазол 22%-ный гранулят применяют однократно групповым способом с кормом без предварительной голодной диеты.
Дозы применения тимбендазола 22%-ного гранулята
3.2. Убой животных на мясо разрешается не ранее, чем через 7 дней после применения препарата.Меры личной профилактики
4.2. После окончания работы необходимо тщательно вымыть руки и лицо теплой водой с мылом. Наставление по применению тимбендазола 22%-ного гранулята разработано… Утверждено Начальником Главного управления ветеринарии с Государственной ветеринарной инспекцией Минсельхозпрода…Тиабендазол
Тиабендазол относится к малотоксичным препаратам. ЛД50 для овец составляет 2000 мг/кг живой массы. Препарат с широким спектром действия в отношении… Наиболее высокая эффективность тиабендазола при большинстве нематодозов…Албендазол
Албендазол выпускается для перорального применения в виде суспензии, содержащей 2,5 % или 10 % препарата, в виде 10%-ного гранулята. При фасциолезе и мониезиозе овец албендазол применяют в дозе 10 мг/кг живой… МебендазолФлубендазол
Флубендазол является противопаразитарным средством из группы бензимидазолов, который в отличие от остальных бензимидазолов оказывает воздействие на… При введении орально практически не адсорбируется на уровне… Показание и назначение. Домашняя птица, свиньи: профилактика и лечение гельминтозов, вызванных различными формами…Наставление по применению тимтетразола 20%-ного
Гранулята для терапии и профилактики нематодозов животных
Общие сведения.
1.1. Тимтетразол 20%-ный гранулят (Timtetrazolum) готовый к применению гранулированный антгельминтик, содержащий 20% действующего вещества тетрамизола и наполнители (лактоза, кормовой мел, осажденный мел или другие инертные вещества).
1.2. Препарат представляет собой гранулы белого или слегка кремового цвета, со слабым специфическим запахом, хорошо распадающиеся во влажном корме. Препарат устойчив при хранении. Тетрамизол разлагается при температуре 264-2670С. Препарат в организме не накапливается.
1.3. Тимтетразол 20%-ный гранулят выпускается в готовом к применению виде в двойных полиэтиленовых пакетах массой 0,1-5,0 кг и в полимерных емкостях по 0,5-10,0 кг.
1.4. Срок хранения 3 года. Хранить препарат следует в заводской упаковке в темном сухом месте при температуре +4-+250С.
Механизм действия
2.2. Тимтетразол 20%-ный гранулят хорошо всасывается из пищеварительного тракта животных. 2.3. Тимтетразол 20%-ный гранулят малотоксичный препарат. Максимально… 2.4. Препарат не обладает эмбриотоксическим, сенсибилизирующим, тератогенным и кумулятивными свойствами, не раздражает…Порядок применения
3.1. Тимтетразол 20%-ный гранулят применяют свиньям, крупному рогатому скоту, лошадям, пушным зверям и собакам при желудочно-кишечных нематодозах (желудочно-кишечные стронгилятозы, аскаридоз, трихоцефалез, эзофагостомоз, стронгилоидоз, параскаридоз, оксиуроз, токсаскаридоз, токсокароз, унцинариоз и др).
Тимтетразол 20%-ный гранулят применяют двукратно свиньям, крупному рогатому скоту, лошадям, собакам и однократно – пушным зверям групповым способом с кормом.
Дозы применения тимтетразола 20%-ного гранулята
6.2. Убивать животных на мясо разрешается через 7 дней, употреблять в пищу…Меры личной профилактики
4.2. После окончания работы необходимо тщательно вымыть руки и лицо теплой водой с мылом. Наставление по применению тимтетразола 20%-ного гранулята разработали…Левамизол
Левамизол применяют при инвазии животных и птиц желудочно-кишечными и легочными нематодами. Не назначают его животным, находящимся в последнюю треть… Дозировка: при внутреннеи применении: крупному рогатому скоту – 0,0075-0,008… При передозировании препарата наблюдается саливация, тремор, дефекация, повышенное отделение мочи, возбуждение,…Перметрин
В последние 30-40 лет было обращено пристальное внимание на природные пиретрины, а затем и на их синтетические аналоги - пиретроиды. Исследователей… Перметрин, содержащий смесь цис- и трансизомеров в соотношении 2:3,… Работы по изучению перметриновпротив насекомых многочисленны. Так была установлена эффективность анометрина-Н (аналог…Протеид
Препарат обладает пролонгированным действием, т.е. защищает животных в течение 42-56 дней от чесоточных клещей, в течение 12 недель - от иксодовых…Мустанг
Исследования показали, что ЛД50 для белых мышей составила 315 мг/кг, что относит его к третьему классу опасности. СК50 для I.ricinus составила… При обработке препаратом коров в концентрации 0,0124% (которая на порядок выше… На основании проведенных исследований определилась эффективная доза мустанга-0,3 мл на животное или 0,006% водной…Эктомин
Эмпирическая формула эктомина С22Н19С2О3, молекулярная масса 416,3. Препарат представляет собой вязкую желто-коричневую полужидкую массу с… При изучении острой токсичности для крыс установлено, что ЛД50 составляет у… Действующее вещество и 10%-ный концентрат эмульсии эктомина малотоксичны для млекопитающих. Активное вещество…Эктопор
Эктопор - малотоксичное вещество, не раздражает кожу животных, но раздражает глаза кроликов. Циперметрин с высоким содержанием цис-изомеров… Эктопор рекомендуется для борьбы с иксодовыми клещами, вшами, овечьими… Готовый эктопор наносят на поверхность кожи спины животных в виде струи непосредственно из флаконов, при этом…Неоцидол
ЛД50 для белых крыс неоцидола-600 к.э. при оральном введении составляет 1053 мг/кг, при нанесении на кожу - более 3100 мг/кг. Препарат токсичен для… Неоцидол применяется при заражении домашних животных чесоточными и иксодовыми… Для опрыскивания крупного рогатого скота неоцидол-600 к.э. применяется в 0,1%-ной концентрации, свиней – 0,04%-ной.…Бутокс
Бутокс (дельтаметрин) относится к группе синтетических пиретроидов с эмпирической формулов С22 Н19 Вr2 N О3 и молекулярной массой 505,2. Температура плавления 98-1010 С. Как и другие синтетические пиретроиды, бутокс растворяется в минеральных и растительных маслах и практически не растворяется в воде. В связи с этим при введении его в организм в масляных растворах он токсичен, а при применении водных суспензий нетоксичен. Например, при оральном введении его белым крысам в виде масляных растворов ЛД50 составляет 135 мг/кг, а при введении в виде водной суспензии – более 5000 мг/кг.
Бутокс эффективен против иксодовых и чесоточных клещей, вшей, мух, овечьих кровососок и др. Животных опрыскивают суспензией препарата, можно купать в ваннах, распыливать порошок бутокса.
Против иксодовых клещей животных обрабатывают бутоксом в 0,0025%-ной концентрации. Против чесоточных клещей препарат применяется с целью профилактики однократно в 0,003%-ной концентрации, а леченая обработка животных бутоксом проводится 0,005%-ным препаратом два раза с интервалом 8-10 дней. Против вшей, мух и других насекомых бутокс наносят в 0,0025%-ной концентрации. При попадании животных под дождь эффективность препарата не снижается.
Убой животных на мясо и потребление молока разрешается сразу после применения бутокса. При работе с препаратом следует соблюдать меры личной профилактики.
Стомозан
Альфакрон
Для опрыскивания 500 г альфакрона-10 тщательно смешивают с 4 л теплой воды и обрабатывают против мух 100 м2 напольной или 200 м 2 настенной… Для намазывания берут 250 г альфакрона-10 и смешивают с 250 мл воды.…Тифатол
После обработки животных тифатолом убой их разрешается через 3 дня, молоко используется без ограничений. Следует избегать попадания препарта на кожу…Непорекс
Непорекс ингибирует рост личинок мух в жидком навозе и в ферментирующих остатках кормов. Препарат можно применять в форме порошка или водного… При дезинфекции непорексом помещений, где содержатся телята и молодняк… В помещении, где содержатся свиньи, проводят две обработки с интервалом 14 дней. Для этого 250 г гранулята необходимо…Циперил
Циперил – желтоватого цвета жидкость с ароматическим запахом, содержащая 5% циперметрина, хорошо эмульгирующаяся в воде. Циперил обладает широким спектром действия на насекомых и клещей, вызывает их…Дозировка и применение
Коров и молодняк крупного рогатого скота против мух-жигалок и полевых мух, переносчиков возбудителей телязиоза, опрыскивают 0,0125% эмульсией… Для защиты от гнуса (комаров, мух, слепней, мошек, мокрецов) животных… Овец против псороптоза, овечьих рунцов и вшей тщательно опрыскивают или купают в 0,005%-ной водной эмульсии циперила…Акаромектин
Акаромектин – противопаразитарный препарат, действующим началом которого является ивермектин (22, 23-дигидроавермектин В1).
Это – бесцветная прозрачная жидкость со слабым запахом, представляющая собой раствор ивермектина в органических растворителях.
Дозировка и применение.
При саркоптозе и демодокозе собак, нотоэдрозе кошек и собак акаромектином смачивают пораженные клещами и соседние участки тела. Против вшей, власоедов и блох акаромектин наносят небольшими участками на… При демодекозе животных обрабатывают акаромектином 4-5 раз с интервалом 8-10 дней, против остальных эктопаразитов –…Отодектин
Дозировка и применение. Отодектин применяют собакам, кошкам, песцам, лисицам, другим плотоядным, больным ушной чесоткой, саркоптозом, нотоэдрозом,… Препарат вводят под кожу в область предплечья или позади плечевого суства с… Обработку против гельминтов проводят однократно, против эктопаразитов – дважды с интервалом в 8-10 дней.Аэрол-2
В виде термомеханических аэрозолей препарат используют для борьбы с мухами и иксодовыми клещами в помещениях. Аэрол-2 высокотоксичен для человека и… Аналогичным образом обрабатывают помещения для крупного рогатого скота против… К работе с генератором допускаются рабочие, знакомые с инструкцией по эксплуатации его, при условии соблюдения всех…Негувон
Состав: 100 мл негувона содержат 10 г действующего вещества – метрифоната. Негувон предназначен для борьбы с мигрирующими личинками подкожных оводов. Негувон-раствор N представляет собой готовый раствор, который наносят однократно при помощи дозирующего устройства…Себацил
Препарат малотоксичен для животных. Его применяют при псороптозе овец в виде водных эмульсий с содержанием 0,05-0,1 % АДВ. Овец купают однократно с… При псороптозе крупный рогатый скот обрабатывают 0,1%-ной эмульсией себацила… После обработки себацилом убой овец на мясо разрешается через 25 дней, крупного рогатого скота — через 22 дня.ПРОБИОТИКИ В ПРОФИЛАКТИКЕ И ТЕРАПИИ ЗАБОЛЕВАНИЙ ЖИВОТНЫХ
Биологические препараты, содержащие живые или убитые микроорганизмы и продукты их ферментации, называют пробиотиками. В состав большинства… Нормальная микрофлора животного организма - совокупность множества… К резидентной микрофлоре желудочно-кишечного тракта относятся главным образом бифидобактерии, лактобактерии,…Механизм воздействия на иммунную систему животных пробиотиков / на примере бифидумбактерина /.
В последние годы получили широкое применение для усиления резистентности и профилактики желудочно-кишечных заболеваний препараты из живых микроорганизмов нормальной микрофлоры кишечника.
В настоящее время все большое значение приобретает проблема использования препаратов, представляющих собой биологические вещества из стабилизированных культур симбионтных микроорганизмов или продуктов их ферментации. Такого рода препараты являются физиологическими и не обладают побочным действием.
В.Д.Соколовым / 1990/, Н.Л.Андреевой / 1993 / была предложена новая классификация арготропиков, включающая в себя три группы кишечные стабилизаторы, регуляторы обмена веществ и препараты разных групп. Пробиотики входят в группы кишечных стабилизаторов. По механизму действия пробиотики подразделяются на две группы: препараты с прямым типом действия, состоящие из симбионтных микроорганизмов и препараты непрямого действия, состоящие продуктов метаболизма данных микроорганизмов, богатых аминокислотами, ферментами и другими биологическими веществами /Т.Rlise, 1982 /. Они обладают разносторонним фармокологическим действием. Положительный эффект пробиотиков обусловлен их участием в процессах пищеварения и метаболизма организма-хозяина, биосинтезом и усвоением белка и многих других биологически активных веществ. Участие симбионтных микроорганизмов в азотистом / белковом / питании является одной из основных функций. В результате сложных биохимических процессов, протекающих в желудочно-кишечном тракте хозяина, микроорганизмы, усваивая поступающие питательные вещества, размножаются и быстро увеличивают свою биомассу. Отмирая, они перевариваются и усваиваются организмом.
Благодаря ферментативной активности / амилолитической, протеолитической, целлюлозолитической и др. /, симбионтная микрофлора способна синтезировать многие биологические активные вещества: органические кислоты, спирты, липиды, витамины, особенно группы В. Органические кислоты усиливают перистальтику и секрецию кишечника, чем способствуют перевариванию корма и повышают резорбцию кальция и железа.
Симбионты способны синтезировать метаболиты, обладающие антитоксическим действием, проявляющимися в инактивации избытка некоторых пищеварительных ферментов, детоксикации отдельных эндогенных и экзогенных веществ.
Нормальная кишечная микрофлора играет защитную роль, которая обеспечивается разными механизмами. Неспецифическую защиту кишечника от патогенных бактерий и вирусов, обладающих генетически детерминированными свойствами, местная микрофлора выполняет путем создания антагонистического барьера, так называемой колонизационной резистентности кишечника.
Симбионты обладают антибактериальной активностью, способны продуцировать перекись водорода, молочную кислоту,уксусную и другие органические кислоты, синтезировать лизоцим и антибиотики широкого спектра действия / лактомин, лизин, ацидофилин, лактозу и др. /. Они могут угнетать рост других видов за счет высокого биологического потенциала, быстрого размножения и достижения М-концентрации, более короткой log – фазы, изменения рН или окислительно-востановительного потенциала среды / R.Fester, 1974; В.В.Тараканов, 1987 /. Благодаря тому, что симбионтные серотипы кишечной палочки обладают перекрестными антигенными свойствами с патогенными микроорганизмами, вырабатываются иммуноглобулины по отношению к первым и возникает механизм защиты к патогенным серотипам, хотя организм с ним никогда не контактировался.
Кроме того, пробиотики активизируют ферменты поджелудочной железы, а также секрецию желез кишечника, деконъюгацию солей желчных кислот, повышают резистентность организма животных, активно участвуют в обменных процессах и строительстве пластического материала.
Основой всех этих биологических препаратов являются бифидумбактерии. Преимущество этих препаратов перед другими состоит в том, что бифидмбактерии являются симбионтами организма млекопитающих с первых дней жизни. Они относятся к кислотоустойчивым, что обеспечивает их выживаемость при пероральном применении.
Действие сухого бифидумбактерина на микробный пейзаж кишечника Т.Н.Грязнева, Л.Я.Старцова / 1981 /, В.В.Пинегин соавтор. / 1984/ объясняют тем, что, продуцируя уксусную и молочную кислоты бифидумбактерии создают в кишечнике кислую среду и тем самым подавляют патогенную и гнилостную микрофлору.
Бифидумбактерии из препарата бифидумбактерина, являясь обитателями желудочно-кишечного тракта, обеспечивают стабильные процессы пищеварения, а также являются антагонистами микробов: сальмонелл, стафилококков. Бифидумбактерин оказывает лечебно-профилактические действия при желудочно-кишечных заболеваниях животных и птиц.Однако лучший эффект был отмечен с применением бифидумбактерина, приготовленного из местных штаммов. По данным И.К.Зитаре / 1983/, назначение бульонной культуры бифидумбактерина для лечения больных телят в дозе 150 мл на прием / ежедневно, однократно per os / весьма эффективно в сочетании с другими антимикробными средствами.
Особенно эффективно использование бифидумбактерина в том числе, если в процессе применения произойдет прижевляемость их в кишечнике.
В медицинской практике для борьбы с диарейными болезнями, связанные с развитием дисбактериоза, наиболее часто применяют бифидумбактерин.
Он представляет собой лиофилизированную культуру бифидумбактерии. Одна доза сухого бифидумбактерина содержит 108 – 109 живых бактерий.
Количество работ по применению этого препарата в ветеринарной практике весьма ограничено. На эффективность бифидумбактерина при диарейных болезнях молодняка указывают М.Т.Коняев, Н.И.Кузнецов / 1974/, И.К.Зитаре /1983/; А.Ф.Пилуй, З.И.Кислякова /1988/. М.А.Тимошенко /1990/ и др.
Учитывая, что производство бифидумбактерина ограничено и препарат в ветеринарную практику не поступает, Витебской государственной академии ветеринарной медицины совместно с институтом микробиологии АН РБ разработан, испытан и фармсоветом утвержден новый биологический препарат энтеробифидин, включающий полезные бифидумбактерии,общие для человека и животных.
Энтеробифидин обладает иммуностимулирующим свойством, препятствует развитию энтеробактерий и спорообразующих анаэробных бацилл, нормализует пищеварение, улучшает резорбцию жиров, кальция и солей железа. Снижает содержание нитратов в организме,предотвращает токсическое действие продуктов их метаболизма.
Результаты экспериментальных и производственных исследований по изучению действия энтеробифидина на организм телят показали, что профилактический эффект от энтерального применения препарата телятам при диарейных болезнях, дисбактериозной, колибактериальной и ротавирусной этиологии составляет 76-84%.
У подопытных телят, получавших с первого дня после рождения в течение 3-5 суток энтеробифидин по 100 мл, в крови достоверно увеличивалось количество лейкоцитов за счет лимфоцитов, особенно Т- и в меньшей степени В- клеток, а также усиливалась фагоцитарная активность микрофагов. Одновременно в крови возрастало содержание иммуноглобулинов, гемоглобулина и сахара. Имелась тенденция к увеличению уровня кальция и фосфара. В слизистом слое, покрывающим энтероциты, в значительном количестве появляется иммуноглобулин А.
В критические иммунологические периоды жизни молодняка для стимуляции местной и общей защиты и профилактики развития дисбактериоза препарат назначают ежедневно в течение 3-5 суток в дозе 3-4 мл/кг массы животных.
Молочно – кислые бактерии
Многочисленные исследования показали, что перспективными для профилактики желудочно-кишечных заболеваний и стимуляции роста молодняка являются… В практической ветеринарной медицине были успешно испытаны препараты из… Препарат АБК представляет собой культуру ацидофильной палочки в бульоне. Ацидофильная палочка – постоянный обитатель…Пропионово-кислые бактерии
На основе пропионово-кислых бактерий и ацидофильной бульонной культуры / ацидофильная палочка в бульоне / создан биологический препарат –… В ПАБК содержится комплекс витаминов В – В1,В12, пантотеновая и никотиновая… Механизм действия препарата заключается в нормализации микробного состава кишечника, нейтрализации токсинов, улучшения…НОРМАЛИЗАЦИЯ СОСТАВА МИКРОФЛОРЫ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА ПРИ БОЛЕЗНЯХ МОЛОДНЯКА С ДИАРЕЙНЫМ СИНДРОМОМ.
Микрофлора кишечника, сложившаяся в процессе эволюции животных, выполняет в организме защитную функцию (антагонистическую, ферментативную,… Полезная микрофлора хорошо приспособлена к условиям существования в кишечнике… Нормальная кишечная микрофлора обеспечивает неспецифическую защиту кишечника от патогенных бактерий и вирусов, которая…Ветеринарно-санитарные мероприятия
ДЕЗИНФЕКЦИЯ
Существенно возрастает роль дезинфекции в условиях промышленного животноводства, когда на ограниченных площадях содержится значительная концентрация… Возбудитель инфекции от зараженного животного здоровому может передаваться… Роль и значение каждого мероприятия при дезинфекции определяется эпизоотологическими особенностями конкретной…ВИДЫ И МЕТОДЫ ДЕЗИНФЕКЦИИ
С учетом эпизоотологического значения различают дезинфекцию профилактическуюи вынужденную. Последнюю, в свою очередь, разделяют на текущую и… Профилактическую проводят в благополучных по инфекционным болезням животных… В практике животноводства профилактическую дезинфекцию подразделяют на предпусковую и технологическую — в процессе…Методы дезинфекции
Влажный метод дезинфекции наиболее распространен. При данном методе раствор к объекту дезинфекции подается сильной бьющей струей или мелко… Аэрозольный методдезинфекции широко применяется в основном на крупных… Для получения дезинфекционных аэрозолей используют пневматические, дисковые и термомеханические генераторы аэрозолей.…Устойчивость возбудителей болезней к дезинфицирующим средствам
К малоустойчивым (первая группа) относятся возбудители лейкоза, бруцеллеза, колибактериоза, лептоспироза, листериоза, болезни Ауески, пастереллеза,… К устойчивым (вторая группа) относятся возбудители аденовирусных инфекций,… Дезинфекцию проводят по режимам второй группы возбудителей также при болезнях, вызываемых неклассифицированными…ДЕЗИНФИЦИРУЮЩИЕ СРЕДСТВА, ПРИМЕНЯЕМЫЕ
В ЖИВОТНОВОДСТВЕ
Для санации внешней среды и дезинфекции объектов животноводства используют химические, физические и биологические средства.
Химические средства
При выборе дезинфицирующего средства к нему предъявляют ряд требований: оно должно обладать достаточной бактерицидностью, не портить оборудование,… Химические средства дезинфекции делятся на несколько групп: щелочи, кислоты,…ЩЕЛОЧИ
Щелочи — хорошо растворимые в воде основания, создающие в водном растворе большую концентрацию гидроксильных ионов.
Действие щелочей на микробную клетку зависит от концентрации ионов гидроксила, обусловливающих бактерицидность препарата. Чем выше концентрация, тем сильнее обеззараживающее действие щелочи.
Проникновение щелочей в микробную клетку приводит к повышению в ней рН и вызывает коагуляцию (сгущение) ее протоплазмы, омыление, жиров. Происходит также гидролиз и расщепление углеводов. Эти явления нарушают нормальную жизнедеятельность микробной клетки и приводят ее к гибели.
Натрия гидроокись (каустическая сода — NaOH) получают путем электролиза водного раствора поваренной соли. В продажу натрия гидроокись поступает в виде натрового щелока (жидкий препарат), который содержит не менее 42% NaOH, или в твердом виде которая содержит 92—95% NaOH, остальное — примеси (поваренная соль и сода).
Каустическая сода – бесцветное, очень гигроскопичное кристаллическое вещество, легко поглащающее влагу воздуха и поэтому расплавляющееся, хорошо растворима в воде. Для дезинфекции применяют техническую неочищенную гидроокись натрия.
Натрия гидроокись применяются в виде 2-3%-ного горячего (70°С) раствора, при неспоровых и вирусных инфекциях и 10%-ного раствора — при споровых инфекциях.
Калия гидроокись (КОН) используется в тех же случаях, что и натрия гидроокись, но из-за ее высокой стоимости в ветеринарной практике применяется редко.
Негашеная известь (СаО) получается путем обжига известняка. Сначала получается негашеная известь — не бактерицидная; бактерицидность она приобретает только после гашения. Различают чистую и техническую известь. Чистая известь – белое тугоплавкое вещество с плотностью 3,4, обладающее свойством энергично присоединять воду с образованием кальция гидрокиси Са(ОН)2. Техническая известь – пористое серо-белое, иногда желтоватое вещество. Используется только для дезинфекции стен и потолка путем их побелки.
Гашеная известь (Са(ОН)2, пушонка)— готовится из негашеной извести путем гашения ее водой. Представляет собой рыхлый, белый порошок, очень плохо растворимый в воде.
При неспоровых инфекциях применяется 10- и 20%-ная взвесь (известковое молоко). Взвесь готовят перед использованием для побелки стен, потолков, станков, деревянных полов, корыт, кормушек. В виде пушонки применяют для посыпки проходов.
При туберкулезе для дезинфекции помещений используют 20%-ную взвесь. Известь гасят равным по объему или половинным по весу количеством воды. В емкость наливают вначале немного воды, затем кладут отвешенное количество жженой извести и доливают воду в количестве, необходимом для гашения. Известь, впитывая воду, превращается в белый сухой пушистый порошок. При гашении следует соблюдать осторожность, чтобы частицы извести не попали в лицо или на руки. Для дезинфекции применяют взвесь свежегашеной извести путем трехкратной побелки с интервалом в 1 час. После выдержанной экспозиции все обрабатываемые поверхности (кроме стен) промывают водой и помещение проветривают.
Сода.Различают кальцинированную соду (углекислую) — Nа2СО3; двууглекислую (питьевую соду — NaHCO4) и кристаллическую — Na2CO3.10H2O и Na2CO3.H2O. Для дезинфекции применяют 5%-ные растворы кальцинированной соды. Она обладает слабой дезинфицирующей способностью, но как дешевое средство незаменима для отмывания жирных поверхностей, халатов, брезентовой одежды. Горячими растворами дезинфицируют помещения.
Каспос (каустифицированная содопоташная смесь) — жидкость, содержащая 40–42 % едких щелочей, неядовитая, хорошо растворяется в воде. Для дезинфекции животноводческих помещений, инвентаря применяется водный раствор основного препарата каспос, который содержит не менее 40% едких щелочей, в тех же случаях, что и натрия гидроокись, но в концентрации в 1,5 раза больше.
Демп (дезинфицирующий моющий препарат) — белый порошок, хорошо растворяется в воде. Состоит из кальцинированной соды, тринатрийфосфата, сульфанола и каспоса. Препарат не имеет запаха, не вызывает коррозию металлов, хорошо растворяется в воде. Широко применяется для мойки и профилактической дезинфекции животноводческих помещений в виде 65-70оС 4%-ного водного раствора из расчета 1 л/м2. После 45-минутной экспозиции помещение, оборудование, инвентарь промывают горячей водой для удаления остатков препарата.
Компоцид — сыпучий белый порошок без запаха, хорошо растворим в воде. В его состав входит каустическая сода, тринатрийфосфат с сульфеном или алкилсульфат. Применяется как моющее и дезинфицирующее средство для помещений и оборудования предприятий мясной и молочной промышленности, животноводческих ферм, железнодорожных вагонов. 3%-ный раствор применяют при бруцеллезе, ящуре; 5 %-ный — при сальмонеллезе, экспозиция 3 час.
Витмол – представляет собой вязкую жидкость со светло-коричневым оттенком, хорошо смешивающуюся с водой и дающую в рабочих разведениях раствор с рН не ниже 12, состоит из натрия гидроокиси, кальцинированной соды, синтанола и натрия карбоксиметилцеллюлозы.
Витмол применяют для дезинфекции и мойки животноводческих помещений в концентрации 2% при температуре раствора 50-600С. Расход раствора 1 л/м2 при обработке поверхностей и 0,3-0,5 л/м2 при дезинфекции решеток и сеток с экспозицией не менее 1ч. Для дезинфекции при туберкулезе Витмол применяют в концентрации 1% л/м2 для предварительного увлажнения и механической очистки поверхностей с нормой расхода 0,5 л/м2, а также для дезинфекции методом полива в 2%-ной концентрации в смеси с 3%-ным раствором формальдегида с нормой расхода 0,75-1 л/м2 поверхности с экспозицией не менее 3 ч. После обработки Витмолом поверхности промывают водой.
ХЛОРСОДЕРЖАЩИЕ ПРЕПАРАТЫ
Хлор в газообразном состоянии как окислитель действует в основном на органические вещества, в частности — на белок микробной клетки. При… Хлорная известь. Получают путем пропускания газообразного хлора через сухую… Взвесь хлорной извести. Для дезинфекции при неспорообразующих и вирусных инфекциях используют взвесь, содержащую не…ГРУППА ФОРМАЛЬДЕГИДОВ
Формальдегид — газ, неудобен в обращении, поэтому поставляется в виде водного раствора формальдегида (формалина). В случае применения для дезинфекции помещений газообразного формальдегида его… Формалин (35–40%-ный водный раствор формальдегида) — это прозрачная, бесцветная жидкость, с резким, раздражающим…КИСЛОТЫ
Соляную кислоту (НС1) используют для дезинфекции воды, мочи и сточных вод. Наиболее широко применяется при дезинфекции кожевенного сырья от… Серная кислота (H2SO4) в чистом виде применяется редко. Чаще используется для… Из органических кислот применяются молочная, муравьиная, уксусная и щавелевая кислоты, а также надуксусная кислота и…ФЕНОЛЫ
Из фенолов чаще применяется карболовая кристаллическая кислота (фенол). Она обладает неприятным запахом. Раздражает кожу и слизистую оболочку, легко всасывается через них, может вызвать отравление. 0,5–2 %-ные растворы используют для дезинфекции мест введения лекарственных средств и вакцин.
КРЕЗОЛЫ
Феносмолин — смесь фенольной смолы, этанола технического и водного раствора натрия гидроокиси. По внешнему виду представляет собой жидкость… При бактериальных и вирусных инфекциях его чаще применяют в виде 3%-ной… Керол и гудронол (керосиновый и газойлевый гудроны) – образуются в процессе сульфирования нефтяных дистиллятов…СОЛИ ТЯЖЕЛЫХ МЕТАЛЛОВ
ОРГАНИЧЕСКИЕ ДЕЗИНФЕКТАНТЫ
Бромистый метил. При температуре до 4°С бесцветная, прозрачная жидкость. Кипит при 3,6°С, при этом образуется газ, который в 3,25 раза тяжелее… ОКЭБМ (смесь окиси этилена и бромистого метила). Эта смесь состоит из 1… Альдофор. Содержит 5% формальдегида. При дезинфекции альдофором руководствуются теми же правилами, что и при…СРЕДСТВА НА ОСНОВЕ ГЛУТАРОВОГО АЛЬДЕГИДА
Глутаровый альдегид – это жидкость желтоватого или коричневатого цвета со слабым характерным запахом, по химической природе – это диальдегид,… Корзолин ФФ. Представляет собой бесцветную прозрачную жидкость с ароматическим… Для дезинфекции помещений при туберкулезе животных препарат применяют в концентрации 3% с расходом 1 л/м2 и экспозиции…СРЕДСТВА НА ОСНОВЕ ПОЛИГЕКСАМЕТИЛЕНГУАНИДИНА ГИДРОХЛОРИДА
Белопаг. По химической природе представляет собой стабилизированный 20%-ный раствор полигексаметиленгуанидина гидрохлорида, является… Препарат не вызывает коррозии, не обесцвечивает ткани, не раздражает кожу и… Для дезинфекции помещений методом полива при бактериальных и вирусных инфекциях применяют 1%-ные (при туберкулезе…СРЕДСТВА, ИСПОЛЬЗУЕМЫЕ ДЛЯ ДЕЗИНФЕКЦИИ ПОМЕЩЕНИЙ В ПРИСУТСТВИИ ЖИВОТНЫХ
Перекись водорода 3%-ная — готовят из 30%-ного пергидроля. Для стабилизации его добавляют молочную или уксусную кислоту из расчета 0,5% кислоты к… Пемос-1 – дезинфицирующее средство, в состав которого входят перекись водорода… Для приготовления препарата в чистую емкость наливают необходимое количество перекиси водорода и молочной кислоты,…ФИЗИЧЕСКИЕ СРЕДСТВА
Механическая очистка позволяет удалить возбудителя инфекционных болезней с навозом, пылью, остатками корма, подстилкой и т. д., с помощью вентиляции… Лучистая энергия. Из естественных источников лучистой энергии наиболее… Для дезинфекции помещений широко используются искусственные источники ультрафиолетового излучения. Наибольшей…БИОЛОГИЧЕСКИЕ СРЕДСТВА
Промышленность выпускает более 20 действенных препаратов бактериальной природы. Но в ветеринарии этот метод не получил широкого распространения.…ОРГАНИЗАЦИЯ И ТЕХНИКА ПРОВЕДЕНИЯ
ДЕЗИНФЕКЦИИ РАЗЛИЧНЫХ ОБЪЕКТОВ
Механическая очистка помещений включает в себя удаление навоза, грязи, мусора из помещений и с окружающей территории. Для этого используют лопаты,… 1) навоз, подстилку, мусор и т. п. увлажняют водой, а при наличии инфекционной… 2) увлажняют пол, стены, кормушки, перегородки;СПОСОБЫ УБОРКИ И УНИЧТОЖЕНИЯ ТРУПОВ ЖИВОТНЫХ
Обеззараживание на заводах по производству мясокостной муки. Трупы животных, павших от острых инфекционных болезней и не подлежащие вскрытию… Трупы животных, павших от других причин, предварительно направляют на вскрытие… Сжигание трупов. Трупы животных, павших от особо опасных инфекций, сжигают в специальных трупосжигательных печах. В…ОБЕЗЗАРАЖИВАНИЕ НАВОЗА
В ветеринарной практике используется несколько способов обеззараживания навоза. На крупных комплексах жидкий навоз разделяют на твердую и жидкую фракции путем… В последнее время жидкий навоз, контаминированный неспорообразующими возбудителями, дезинфицируют жидким аммиаком.…КОНТРОЛЬ КАЧЕСТВА ВЕТЕРИНАРНОЙ
ДЕЗИНФЕКЦИИ ОБЪЕКТОВ ЖИВОТНОВОДСТВА
1. Контроль подготовки объектов к дезинфекции (проверяют степень очистки поверхностей, их увлажненность, защиту электрооборудования и приборов,… 2. Контроль за соблюдением установленных режимов дезинфекции (выбор препарата… 3. Бактериологический контроль качества дезинфекции осуществляют специалисты ветеринарных лабораторий периодически или…Отбор проб для исследования
Пробы (смывы, отпечатки, соскобы) для исследования берут с 10-20 различных участков поверхности животноводческого помещения (полов, стойл, проходов,… Для контроля качества дезинфекции при туберкулезе с каждого вида поверхности… При заключительной дезинфекции одновременно берут пробы с территории фермы в разных направлениях от углов здания и от…Отбор проб-отпечатков
Контроль качества дезинфекции помещений методом бактериологического исследования смывов
Для индикации кишечной палочки 0,5 мл центрифугата высеивают в пробирки с модифицированной средой Хейфеца или КОДА. Посевы выдерживают 12-18 часов в… Для индикации стафилококков (0,5 мл центрифугата высеивают в 5 мл… Для индикации спорообразующих аэробов смывы обрабатывают, как указано выше, но перед центрифугированием их прогревают…Контроль качества дезинфекции методом отпечатков на тонкий слой плотной питательной среды
Ванны и пробирки с пробами-отпечатками, доставленные в лабораторию, помещают на 16-18 ч в термостат при 37°С. После инкубирования пробы…Исследование с целью выделения микобактерий
Смывы обрабатывают, как указано выше. Из центрифугата каждой объединенной пробы делают высев на среды для выделения стафилококков, готовят по шесть… Пробы почвы с прилегающей территории и соскобы с поверхности помещений (каждую… При наличии роста стафилококков хотя бы в одной исследованной пробе качество дезинфекции признают неудовлетворительным…Оценка качества дезинфекции
При профилактической дезинфекции помещений для содержания взрослого поголовья и текущей дезинфекции частично освобожденных от животных или… Качество заключительной дезинфекции при ее контроле по выделению бактерий… При споровых инфекциях качество дезинфекции признают удовлетворительным при отсутствии роста Вас. anthracis. При…Контроль качества профилактической аэрозольной
Дезинфекции, проводимой формалином
Перед проведением дезинфекции индикаторные пробирки размещают на полу, стенах и потолке помещения и на находящемся в нем оборудовании. Особо важно… Качество дезинфекции оценивают непосредственно после окончания экспозиции (12… При контроле качества дезинфекции в очагах бактериальных (кроме туберкулеза) и вирусных инфекций в качестве…Приготовление нейтрализующих растворов
Нейтрализующие растворы готовят в концентрации в 10 раз меньше, чем концентрация использованного дезинфицирующего средства. Раствор делают на стерильной воде в стерильной посуде и разливают в пробирки или флаконы с соблюдением правил стерильности (растворы уксусной кислоты и бикарбоната натрия можно стерилизовать автоклавированием). Раствор аммиака стерилизации не подлежит. Готовые пробирки (флаконы) можно хранить в течение пяти дней при комнатной температуре.
Подготовка предметных стекол
Подготовка предметных стекол со средой
Прогретые над пламенем горелки предметные стекла (берут корнцангом) раскладывают на ровной, строго горизонтальной поверхности стола. На них пипеткой…Подготовка стекол для микрокультивирования микобактерий
Предметные стекла разрезают вдоль на узкие полоски размером 1,2x7,5 см, моют и помещают на 2 часа в хромпик (40 г дихромата калия высыпают в фарфоровую кружку или эксикатор и растворяют в небольшом количестве воды, затем осторожно добавляют концентрированную серную кислоту до общего объема 1 л). После хромпика стекла вновь моют дистиллированной водой, протирают чистой льняной тканью, стерилизуют сухим жаром (160 гр.) 2 ч и хранят в закрытых сосудах (эксикаторах).
Приготовление диагностических сред
Питательная среда КОДА сухая.Состав и способ приготовления приведены в этикетке на упаковке среды. Солевой мясопептонный бульон. К обычному МПБ с рН 7,2-7,4 добавляют 6% натрия… Солевой мясопептонный агар.К расплавленному МПА добавляют 8% хлорида натрия, перемешивают до полного растворения соли,…Экономический ущерб причиняемый грызунами
Излюбленным местом обитания грызунов являются животноводческие помещения, которые заселены ими практически на 100%. Поселяясь на фермах они… Таким образом, даже только прямой ущерб от грызунов очень велик и складывается…Переносчиками которых они являются
Грызуны могут переносить около 200 возбудителей различных инфекционных и инвазионных болезней человка и домашних животных. Они сами болеют… Туляремия.В неблагополучных по туляремии хозяйствах бывает высокой и… Бруцеллез. Грызуны в ряде случаев являются источником возбудителя инфекции при бруцеллезе. Они легко заражаются…Биологические особенности мышевидных грызунов
Общим свойством грызунов является высокая их плодовитость. В результате чего выжившие особи после бескормицы или других неблагоприятных условий за… Серая крыса, пасюк (Rattus norvegicus Berk.) – один из самых крупных…МЕТОДЫ БОРЬБЫ С МЫШЕВИДНЫМИ ГРЫЗУНАМИ
Профилактические мероприятия. Профилактическая работа сводится к ветеринарно-санитарным и строительно-техническим мерам, направленным на то, чтобы… Запасы сена, соломы и другие корма надо размещать на расстоянии не менее 10 м… В местах технических вводов в помещения канализационных, водопроводных, вентиляционных коробов, электропроводов,…ИСТРЕБИТЕЛЬНЫЕ МЕРОПРИЯТИЯ
Борьба с мышевидными грызунами проводится химическим, механическим и биологическим методами.
Химический метод дератизации
Все яды условно могут быть объединены в группы соединений обладающих общими для них свойствами. Но каждый препарат или его рабочая форма имеет и… Зоокумарин, натриевая соль зоокумарина, пенокумарин, средсдство “Зоосорбцид”,… Фосфид цинка, крысид, тиосемикарбазид, фторацетат натрия и бария, фторацетамид, монофторин, глифтор натрия и кальция…Механический метод дератизации
Рис. 19. Капкан плашкаБиологический метод дератизации
Для истребления грызунов в СССР применялись бактерии Исаченко и Мережковского выделенные от грызунов во время эпизоотии среди них, бактерия №5170… В целях профилактики сальмонеллезных заболеваний и сальмонеллоносительства…СПОСОБЫ И ФОРМЫ ПРИМЕНЕНИЯ ДЕРАТИЗАЦИОННЫХ СРЕДСТВ
Выбор средств для дератизации, способа и формы их примения зависит от вида объекта, подлежащего дератизации, степени заселенности его грызунами, эффективности применяемых методов. Дератизация должна обеспечить полное уничтожение на объекте грызунов, при этом необходимо предпринять меры для предотвращения отравления дератизационными ядами животных.
Приманочный способ дератизации
Пищевые приманки. Применение химических средств в виде пищевых отравленных приманок — наиболее простой и эффективный способ истребления грызунов. В… Для лучшей поедаемости приманок к ним добавляют 3% растительного масла или… С пенными формами родентицидов приманки готовят при тщательном смешивании 1 кг пищевой основы с тем количеством…Бесприманочный способ дератизации
Бесприманочный способ дератизации основан на биологической особенности грызунов очищать языком волос и лапки. При этом яд механически попадает в… Истребление грызунов на животноводческих фермах и комплексах проводят… Обработку нор грызунов и щелей 1%-ным дустом зоокумарина, ратинданом (0,5%-ный дуст дифенацина), пенокумарином,…Способ газации
Дератизация в свинарниках
При случайном отравлении животных антикоагулянтами следует немедленно применить лечение, заключающееся в назначении раз в день животному противоядия… Расстановку подвесных кормушек, приманочных ящиков, поилок и кормушек из… В свинарниках-маточниках, откормочниках и в других помещениях, где содержатся свиньи разных возрастов и ежедневно…Дератизация в коровниках
ДЕЗИНСЕКЦИЯ И ДЕЗАКАРИЗАЦИЯМЕТОДЫ ДЕЗИНСЕКЦИИ И ДЕЗАКАРИЗАЦИИ
Разнообразие экологических и биологических особенностей членистоногих обусловливает применение различных методов их истребления, которые можно подразделить на физические, химические и биологические.
Физический метод
Огонь паяльной лампы применяют для выжигания мест обитания клопов, куриных клещей. Перед этим рекомендуется поверхность увлажнять водой.… Для уничтожения паразитов, находящихся в таре, инвентаре, используют горячую… При воздействии низких температур членистоногие впадают в состояние анабиоза, что временно приостанавливает их…Химический метод
Химические средства для борьбы с насекомыми и клещами должны обладать минимальной токснчвостью для теплокровных животных и человека и высокой… Контактные средства убивают насекомых и клещей при непосредственном… Кишечные средства действуют через пищеварительный тракт, куда они попадают вместе с кормом.Биологический метод борьбы с членистоногими
Применение ядохимикатов, не обладающих узким спектром действия, всегда ведет к уничтожению и полезных насекомых. Они менее защищены от действия… Используются препараты (естественные и синтезированные), привлекающие… Половой стерилизации самок и самцов можно достичь с помощью рентгеновских лучей, гамма-излучений, кобальта 60 или…РЕПЕЛЛЕНТЫ
Репелленты (от лат. repello — отгонять) — средства, отпугивающие насекомых и клещей от животных и человека. Эти вещества должны быть малотоксичными,… Выпускается ряд репеллентов, получивших широкое распространение. ДЭТА (диэтилтолуамид). Бесцветная маслянистая жидкость, используется в концентрированных растворах в диметилфталате и…Формы дезинсекционных и дезакарицидных препаратов
Химические вещества в зависимости от их особенностей и назначения применяются для уничтожения насекомых и клещей в различных формах (растворов,… Иногда смешивают различные препараты. При этом надо учитывать их… Инсектоакарицидные растворы. Препараты, нерастворимые в воде, часто используются в виде растворов в органически…МЕТОДЫ БОРЬБЫ С ЧЛЕНИСТОНОГИМИ
Слепни — самые крупные кровососущие двукрылые насекомые, относящиеся к… Рис. 20.СлепниМУХИ И МЕРЫ БОРЬБЫ С НИМИ
Рис. 23. Мухи
В животноводческих помещениях преобладает комнатная муха, осенняя жигалка, на территории ферм — синие и зеленые мясные мухи, на пастбищах — полевые мухи и жигалки, которые нападают на животных, вызывая их беспокойство рис. 24.

Рис. 24. Теленок обсиженный мухами
Место выплаживания мух – органические отбросы: навоз, остатки кормов, сточные канавы, гниющие овощи, остатки рыбы, мяса.
Самка зa период существования откладывает более 600 яиц. Через 10–15 часов из них выходят личинки, которое зарываются в субстрат на 10–25 см влажностью до 80% при 5–30°С, где они линяют и превращаются в куколок, а затем — в имаго. Цикл развития длится 10–30 дней. Откладка яиц у мух начинается при 17°С. В животноводческих помещениях со стабильным температурно-влажностным режимом мухи могут развиваться круглый год, давая до 25 поколений. Максимальная численность мух наблюдается в июле — августе. В поисках пищи и мест откладки яиц они могут перелетать на расстояние 4–5 км.
Чистота предотвращает массовое размножение мух. Необходимо ежедневно убирать помещения от навоза и остатков корма, своевременно ремонтировать полы, очищать жижестоки. Вне помещений также надо поддерживать чистоту, регулярно убирать мусор, навоз, держать закрытыми биотермические ямы. Навоз разрешается складывать на расстоянии не менее 200 м от жилых и животноводческих помещений. По краям навозохранилищ необходимы оградительные канавки, на дно которых наносят инсектицид. При укладке навоза его необходимо засыпать торфом, землей толщиной до 20 см.
Кормокухни, защищают от мух путем укрепления на дверях, окнах, форточках марли, мелкой сетки. Внутри помещений устанавливают мухоловки, подвешивают липкие бумаги. Действенным методом уничтожения мух является применение привлекающих веществ (аттрактантов), в том числе — пищевых, к которым добавляют инсектицид (хлорофос и др).. Особенно эффективна липкая масса (100 частей канифоли и 60 частей касторового масла). Эту смесь разогревают на слабом огне и наносят на пергаментную бумагу, доски, металлические листы.
Для уничтожения личинок и куколок мух в местах выплода применяют 1%-ный раствор хлорофоса, 0,1%-ную водную эмульсию ТХМ-3, 10%-ную — креолина, нафтализола или 5%-ную — полихлорпинена по 2–5 л/м2, сухую хлорную смесь (с содержанием хлора не менее 25% — 1 кг/м2). Обработки рекомендуется повторять, каждые 10 дней.
Взрослых мух истребляют путем опрыскивания животноводческих помещении 0,5–1%-ным йодным раствором хлорофоса, 0,5%-ной эмульсией карбофоса, ТХМ-3 или тролена, 0,1%-ной — ДДВФ, 0,5%-ной — байгона, 2%-ной — циодрина из расчета 50–100 мл/м2 поверхности. Хорошо уничтожают мух аэрозоли из ДДВФ, инсектола, акродекса, дифоса, ветсанозола из расчета 30–40 мл на животное. Обработки повторяют каждые 15–20 дней в отсутствие животных. Помещения перед загоном животных тщательно проветривают.
Для опрыскивания животных на пастбищах используют специальные устройства. Поверхность тела обрабатывают 0,5–1%-ным раствором хлорофоса, карбофоса, 0,5%-ными эмульсиями ДДВФ, диброма и другими средствами по 400– 500 мл на животное каждые 6–7 дней.
Защита животных от вшей
Вши вызывают у животных болезни под названием сифункулятозы, которые характеризуются беспокойством, зудом кожи, дерматитами, снижением… Рис. 25. Свинья пораженная вшамиРис26. Теленок пораженный вшами
Рисунок 27. Различные стадии развития вшейЗащита животных от блох
На территории бывшего СССР зарегистрировано более 300 видов блох. В ветеринарии имеет значение человечья блоха (Pulex irritans) — она паразитирует… Для уничтожения блох животных периодически обрабатывают дустами севина…Борьба с маллофагами
Рис.28. Власоед Trichodectidae Ротовой аппарат грызущего типа. Это постоянные эктопаразиты, развиваются с неполным превращением в течение 3–4 недель.…Борьба с клопами
Важнейшая профилактическая мера – чистота. При обнаружении клопов выясняют очаги паразитов, проводят тщательную механическую очистку помещений от… Уничтожать, клопов можно кипятком, паром, аэрозолями «Инсектол», огнем…Меры борьбы с тараканами
Самки тараканов откладывают 3–5 коконов, содержащих 20–60 яиц. Вышедшие из них личинки по внешнему виду напоминают взрослых особей, линяют 6–7 раз и… Основными профилактическими мерами борьбы являются отсутствие доступа к пище и… Для дезинсекции используют 2%-ный раствор хлорофоса, 0,5–1%-ные эмульсии карбофоса, трихлорметафоса-3 по 50 мл/м2.…Защита животных от клещей
Рис.32. Корова пораженная клещами
Они проходят следующие стадии развития яйцо, личинка, нимфа Одна самка откладывает 5–15 тыс. яиц. По способу питания иксодовые клещи делятся на одно , двух и треххозяинные. К треххозяинным клещам относятся представители родов Ixodes, Dermacentor, некоторые — родов Haemophysalis, Rhipicephalus. Двуххозяинные — Н. plumbeum, H detritum, Rh bursa, однохозяинные— В. calcaratus, H scupense.
Иксодовыс клещи — переносчики возбудителей многих болезней животных и человека. Передача патогенных агентов возможна трансфазно и трансовариально От клещей выделено более 30 арбовирусов, в том числе вирусы клещевых энцефалитов человека. Они переносят также возбудителей Ку-лихорадки, анаплазмоза, туляремии. Более 20 видов иксодид являются специфическими переносчиками пироплазмид. При массовом нападении высасывают значительное количество крови, снижая молочную и мясную продуктивность животных. Могут быть случаи падежа животных от паралича после укусов клещей.
Защита животных. Иксодид уничтожают в естественных биотопах, помещениях и на животных. С целью нарушения условий обитания клещей на различных стадиях развития в природных условиях используют изоляцию и смену выпасов при организации мер борьбы с клещами, которые питаются только на домашних животных При смене выпасов нельзя допускать животных на заклещёванные участки. За 6–7 месяцев погибают от голода клещи В. calcaratus, за 10 мес — Rh. bursa.
Осушение заболоченных и низинных пастбищ приводит к изменению мест обитания влаголюбивых клещей (Ixodes), высев однолетних и многолетних трав резко снижают количество клещей в биотопах. Естественные враги их — насекомые-наездники, самки которых откладывают в тело нимф до 20 яиц, что приводит к гибели последних.
В животноводческих помещениях, (в трещинах стен, потолков, пола, под кормушками, норах грызунов) нередко обитают клещи рода Hyalomma. Для уничтожения иксодовых заделывают трещины с добавлением акарици-дов, убирают мусор, проводят дезакаризацию помещений с использованием 2%-ного раствора хлорофоса, 1%-ного трихлорметафоса-3, карбофоса, дикрезила, 0,5%-ного фталофоса, 1%-ной суспензии севина и др. Перед обработкой животных из помещения удаляют, а через 3–4 часа после нее кормушки и поилки, нижние части стен обмывают теплой водой. Для обработки помещений используют аэрозоли акарицидов, которые получают путем сжигания шашек (НБК-Г17), «Аэрол-2» и др.
В борьбе с клещами важное место занимает уничтожение их на теле животных. Чаще всего клещей находят в ушных раковинах, подгрудке, в паху, на коже вымени, в межчелюстном пространстве. Обработку кожных покровов производят каждые 6–7 дней 1%-ным раствором хлорофоса, трихлорметафоса-3 (1–2 л на животное), арсенитом натрия с концентрацией мышьяковистого ангидрида 0,16% — для крупного рогатого скота. Для уничтожения клещей на теле животных используют 0,2%-ный неоцидол, 0,5%-ный циодрин, 0,85%-ный севин, 0,75%-ный дикрезил, эктомин (1:1000), эктопор (1 мл на 5 кг веса), неоцидол (1:1000) и др. В теплое время года акарицидные препараты применяют в виде растворов, эмульсии, суспензий, в холодное — в виде дустов.
Наиболее действенный способ — купание животных в проти-вопаразитарных ваннах. Хорошие результаты дает опрыскивание животных акарицидными препаратами в душевых установках.
Чесоточные клещи относятся к мелким постоянным паразитам различных животных, вызывают чесотку. В зависимости от принадлежности возбудителя различают следующие виды чесоточных болезней: саркоптозы (зудневая чесотка), псороптозы (накожниковая чесотка), хориоптозы (кожеедная чесотка), демодскоз (железничная чесотка).
Отличаются эти болезни клиническими признаками, морфологическими и биологическими особенностями возбудителей.
Подготовка животных к лечению. К применению акарицидов животных надо подготовить. Прежде всего необходимо очистить от грязи кожный покров. У животных с длинной шерстью на пораженных участках удалить шерстный покров. Корки кожи на пораженных местах размягчают втиранием теплой мыльной воды, а затем — вазелина или вазелинового масла. Через некоторое время их удаляют.
Для обработки животных применяют 2%-ный раствор хлорофоса, 0,15%-ную эмульсию неоцидола, 0,5%-ную —дикрезила, 4–5%-ную суспензию коллоидной серы. Обработку повторяют через 8–10 дней.
Ветеринарно-санитарная оценка молока
Высокая эффективность молочного скотоводства во многом должна обеспечивается качественно новыми технологиями, гарантирующими получение конкурентной продукции для реализации, как на внутреннем, так и на внешнем рынках. Производством молока в республике занимается 2300 сельскохозяйственных предприятий (97%) из них 793 хозяйства имеют поголовье по 800 и более голов. Последние должны стать основой для перевода их на интенсивные технологии производства молока.
В последние годы молочное скотоводство республики Беларусь, включая его материально- техническую базу, проходит сложный период развития. Для него характерны сокращения поголовья коров, их продуктивности, объемов сокращения производства молока при одновременном удельном росте затрат труда ,кормов , энергии и снижения рентабельности отрасли .
Так, за последние десятилетие численность коров уменьшилось на 29 %, продуктивность дойного стада снизилась на 22 %, производство молока сократилась на 47 %.
Рентабельность производства молока снизилась в 2001 году (-24,5%),2002 (–7,6 %) и отрасль становится убыточной по сравнению с 1991 годом. Одной из основных причин низкой эффективности и нерентабельности производства молока: слабая материально-техническая база молочного скотоводства, устаревшая как физически, так и морально. Из находившихся в эксплуатации 14,7 тыс. доильных установок около 70 % выработали эксплуатационный режим, и более 4 тысяч подлежат срочной замене. Молочно-товарные фермы республики используют 12 тыс. установок для охлаждения молока, которые не отвечают современно-гигиеническим требованиям, так как они выпущены 15- 20 лет назад. (Н.А. Попков ,2003).
Отчетные данные Минсельхозпрода РБ за период 1999-2002 г.г. показывают, что удельный вес высшего сорта молока по областям республики колеблется в пределах 21,2-78,7 %, первого сорта 33,8- 76,0 %, второго сорта 3,9-9,7% , не сортового 0,5-2,0 %. Наиболее высокий удельный вес сдачи высшего сорта молока в Минской области 62-78,5%,от общего количества закупленного молока, первого сорта 33,8-15,8 %, при этом количество второго сорта достигает 3,1 –4,8 % , не сортового 0,9—1,2 %. Основными причинами снижающими качество молока являются: большое содержание соматических клеток, бактериальная обсеменённость, высокая кислотность, низкая плотность.
Развитие животноводства в значительной мере сдерживается распространением разных болезней сельскохозяйственных животных, и в первую очередь маститов. Маститы (воспаление молочной железы) в 70-90% случаев протекают без явно выраженных клинических признаков (скрытое течение). Падеж животных, как правило, не наблюдается. Однако у животных, больных маститами, снижаются удои, а после переболевания некоторые из них вообще утрачивают способность продуцировать молоко вследствие атрофии одной или нескольких четвертей вымени. Особую опасность представляют скрытые маститы, которые широко распространены в условиях машинного доения. В молочных стадах маститы выявляются у 8-25 % коров, а в течение года переболевает до 70 % маточного поголовья. Часто скрытые маститы остаются незамеченными из-за несвоевременного диагностирования, переходят в хроническую форму и являются постоянным источником заражения здоровых животных.
Причиняемый этой болезнью экономический ущерб слагается из снижения молочной продуктивности, выбраковки животных, увеличения количества бесплодных коров.
В среднем 10-15 % переболевших клиническим маститом коров выбраковывается из-за атрофии долей вымени, а среди высокопродуктивных коров , эта цифра достигает 30 %. В результате от каждой коровы недополучают 3-4 телёнка и удой за 3-4 лактации.
Телята, полученные от больных коров маститом, страдают диспепсией и другими расстройствами пищеварения в 2 раза и погибают в 4-5 раз чаще, чем телята от здоровых животных. Жирность молока из пораженной доли вымени уменьшается на 5-12%, снижается на 10-20% уровень лактозы, количество казеина, активность ферментов, титруемая кислотность. В молоке повышается содержание соматических клеток и микроорганизмов. Такое молоко утрачивает технологические свойства.
Машинное доение улучшает гигиену и условия труда, резко повышает его производительность, создает возможность внедрения автоматизации. Если оно правильно организовано, то не только облегчает труд работников животноводства, уменьшает потребность в рабочей силе, но и повышает рентабельность молочно-товарных ферм. Однако с повышением уровня механизации допускается много погрешностей в проведении доения, что может привести к воспалению молочной железы. Строгое выполнение ветеринарно-санитарных мероприятий при получении и первичной обработки молока на ферме, соблюдение технологии машинного доения коров, своевременная диагностика, профилактика, лечение заболеваний вымени коров позволяют получать молоко высшего сорта более 95%.
Современные требования к качеству молока
В мировой практике для характеристики санитарно-гигиенического качества молока используют следующие показатели: органолептические, общую… Согласно требований ТУ РБ 00028493.380-98 молоко разделяют на три сорта (табл.…Ветеринарно-санитарная оценка молока
Органолептические показатели
Причинами изменения органолептических свойств молока могут быть физиологическое состояние коров (начало и конец лактации, стадии полового цикла);… Изменение цвета. Красноватый цвет. Причиной покраснения могут быть гемоспоридиозы, кровавое молоко от разрывов сосудов вымени, чаще в…Кислотность молока
Кислотность молока зависит и от факторов, не связанных с микробным обсеменением. Она зависит от (индивидуальных и породных особенностей коров,… Кислотность повышается у животных в послеродовой и предзапускной периоды, при…Плотность молока
Когда свежее и цельное молоко не соответствует требованиям ТУ по показателям плотности и кислотности, разрешается принимать его как сортовое на…Бактериальная обсемененность
Степень обсеменения микрофлорой устанавливается на молочном заводе при сдаче-приемке молока один раз в 10 дней редуктазной пробой. По полученному… В большинстве стран с развитым молочным скотоводством к 1-му классу относят… Во всех странах ЕЭС вступили требования к экспортируемому молоку, ужесточившие критерий общей обсеменённости . Если…Содержание соматических клеток.
Важным показателем санитарно–гигиенического качества молока является содержание в нем соматических клеток. Которые являются критерием и индикатором состояния здоровья вымени. Соматические клетки это клетки тела животного, которые образуются в вымени в процессе естественного старения и обновления тканей. В состав соматических клеток входят лейкоциты (80-85 % от общего числа), эритроциты, клетки плоского, цилиндрического и кубического эпителия молочной железы. Повышенное содержание соматических клеток особенно лейкоцитов в молоке свидетельствует о том, что оно получено от больного животного. Принято считать, что молоко, содержащее большое количество соматических клеток, не может быть высокого качества.
Во всех странах с развитым молочным скотоводством в зависимости от содержания соматических клеток в молоке устанавливают его классность и цену. Международная молочная федерация предложила считать физиологической нормой количество клеток, не превышающее 500 тыс. /мл молока.
Соматические клетки молока отличаются по своей природе от других его компонентов. Они не происходят из молочной секреторной ткани, однако всегда присутствуют в молоке и считаются нормальным его компонентом. Все зависит только от их количества. Содержание соматических клеток в молоке может меняться под влиянием многих факторов: возраста коров, физиологического состояния их организма или молочной железы, стадии лактации.
Проведенные нами исследования по изучению содержания соматических клеток в молоке лактирующих коров по сезонам года показали ,что здоровые животные имеют в основной массе в молоке 150-300 тыс см3 соматических клеток( табл. 3)
Таблица 3.
Содержание соматических клеток ,в молоке лактирующих коров,% в зависимости от сезона года
| Количество соматиче-ских клеток в тыс. 1 см3 | Зима Декабрь-февраль | Весна март-апрель | Лето июнь-июль | Осень сентя-брь-октябрь) | В течение года | |
| 2,9 | 4,06 | 14,3 | 8,1 | 7,1 | ||
| 10,8 | 20,6 | 39,5 | 29,7 | 24,8 | ||
| 28,1 | 31,7 | 41,2 | 37,1 | 34,4 | ||
| 30,9 | 24,6 | 10,1 | 17,5 | |||
| 15,8 | 14,3 | 0,8 | 8,1 | 10,0 | ||
| 7,2 | 2,4 | 0,8 | 4,7 | 3,9 | ||
| 2,9 | 1,6 | 2,2 | 1,5 | |||
| 1,4 | 0,8 | 0,6 | ||||
| 0,7 | 0,2 | |||||
При определении соматических клеток в молоке по дням начала лактации выявлено , что максимальное их содержание (6,54- 1,0 млн.) в 1см3 молока находится в течение первых 5 дней лактации.При этом соотношение содержания соматических клеток в молоке молозивного периода к нормальному молоку составляет к нормальному молоку коров лактациннного периода превышение в 13 раз в первый день лактации, во 2 день- 6 раз, 3 день- 3 раза (табл.4).
Содержание соматических клеток ,в молозиве коров, в зависимости от дня лактации.
| День лактации после отела | Количество соматических клеток в млн.1 см3 | Соотношение содержание соматических клеток ,в молоке молозивного периода,к нормальному молоку коров лактационого периода,раз |
| 6,54±0,34 | 13,08 | |
| 3,16±0,23 | 6,32 | |
| 1,57±0,11 | 3,14 | |
| 1,26±0,09 | 2,52 | |
| 1,0±0,06 | ||
| 0,50±0,002 | ||
| 0,34±0,001 | - |
Содержание соматических клеток в молоке может меняться под влиянием : физиологического состояния их организма или молочной железы, стадии лактации, заболевания молочной железы, половой органов и т. д.(табл.5)
5Содержание соматических клеток в молоке у коров
| Период лактации | Содержание лейкоцитов,см3 | При патологии | Содержание лейкоцитов,см3 |
| Молозивный | 0,64-2,5млн. | Эндометриты | 1,5-2,0 млн. |
| 1 неделя | 640 тыс. | Задержание последа | 1,1-1,8 млн. |
| 2 неделя | 100 тыс. | Раздражение вымени | 1,3 млн. через 2 дня до 500 тыс. |
| 3 неделя | 70 тыс. | Мастит субклинический | 1,5-2,5 млн. |
| 2-6 месяцев | 34 тыс. | Мастит клинический | 5-40 млн. |
| Стародойкости и запуска | 1,5-2,5 млн. | Мастит хронический | 2-2,5 млн. |
Количество клеток в молоке увеличивается при заболевании и раздражении вымени, травмировании, в молозивный и предзапускной периоды, у старых животных, при желудочно-кишечных и других заболеваниях. Принято считать, что повышенное содержание соматических клеток в сборном молоке связано с заболеванием коров маститами.И. С. Загаевский (1986) считает, что количество соматических клеток в молоке больных маститом коров подвержено колебаниям в зависимости от стадии лактации, температуры наружного воздуха и т. д. У здоровых коров в 1 мл молока содержится клеток от 175 до 500 тыс., при субклиническом мастите — 670—890 тыс., при клиническом — 2,7—11,4 млн., при раздражении вымени — 875—969 тыс. В период лактации в пробах молока от здоровых коров содержится 300±50 тыс. 1мл соматических клеток. При возникновении ранних форм мастита их количество резко повышается.
В странах с высокоразвитым молочным скотоводством средний уровень содержания соматических клеток в молоке у коров не высок (табл.6)
6.Уровень содержания соматических клеток в молоке
| Страна | Количество соматических клеток, тыс./см3 | Страна | Количество соматических клеток, тыс./см3 |
| Швейцария | Австрия | ||
| Бельгия | Норвегия | ||
| Австралия | Швеция | ||
| Дания | Финляндия |
Как видно из представленных данных их уровень составляет 164-433 тыс. 1 см3.
Специалисты Ассоциации по улучшению скота в США выявили четкую зависимость между бактериальной обсеменностью и числом соматических клеток в молоке (табл.7 ).
7.Взаимосвязь между количеством соматических клеток и бактериальной обсемененностью молока.
| Количество соматических клеток, тыс./см3 | Процент образцов | |
| Не содержащих патогенную микрофлору | Содержащих патогенную микрофлору | |
| Менее 100 | 62,2 | 37,8 |
| До 200 | 39,0 | 61,0 |
| До 300 | 33,4 | 66,6 |
| До 400 | 31,0 | 69,0 |
| До 500 | 26,2 | 73,8 |
| До 700 | 37,1 | 72,9 |
| До 1000 | 24,2 | 76,8 |
Представленные в таблице данные показывают ,что при повышении уровня соматических клеток возрастает бактериальная обсеменённость молока.
Необходимо отметить ,что при высоком содержании соматических клеток в молоке снижается и продуктивность животных .Так специалисты из Германии считают ,что при наличии в молоке соматических клеток от 500 тыс. до 1 млн. молочная продуктивность у животных снижается на 10,0%,а до 5,0 млн. на 30,0%. Проведенные исследования в СЩА, Бельгии, Финляндии показали , что при повышении соматических клеток до 1000 тыс. теряется до 900 кг молока в год (табл.8).
Взаимосвязь между количеством соматических клеток и снижением молочной продуктивности
Оценка сборного молока по количеству клеток дает возможность определить примесь в нем маститного молока и степень распространения маститов в стаде,… Молоко с примесью молозива или стародойного, а также полученное от коров с… Исследования показали ,что примесь анормального молока влияет на классность молока по микробиологической оценке( табл.…ФАКТОРЫ, снижающие санитарное качество молока
Источники бактериального обсеменения молока
При машинном доении такими источниками в первую очередь становятся молочная железа, кожа сосков имени, доильное оборудование и молочная посуда. Вымя животного. Относительно бактериальной обсеменённости молока в вымени, в… По данным П. К. Полищук и др.(1978), в вымени здоровых животных микроорганизмы встречаются в железистой части…Изменение количества микрофлоры при хранении молока
Сразу после получения молока размножение микрофлоры приостанавливается. Часть бактерий, поступивших в молоко, погибает под воздействием… Продолжительность бактерицидной фазы зависит в основном от количественного…Влияние маститов на качество молока
Увеличивается содержание водо-растворимых фракций белка (альбумина, глобулина), хлора, натрия, ферментов (каталазы, редуктазы, фосфатазы),… Более опасными являются скрытые маститы. Они часто остаются незамеченными в… К. Буткус, с соавторами (1985) исследовали молоко от трех групп коров, больных субклиническим маститом с различной…Способы и средства санитарной обработки вымени коров снижающие бактериальную обсеменённость молока
Существует два способа обмывания вымени : из ведра и струей теплой воды, подаваемой под давлением. Обмывание вымени теплой водой не освобождает… Полотенце, промываемое в несменяемой воде, при подмывании вымени коровы может… Молоко остающееся на кончике соска после доения., служит питательной средой для микроорганизмов, которые размножаются…Методы технического контроля качества молока и молочных продуктов
При создании аналитического оборудования в мировой практике сохраняется стремление к увеличению производительности, повышению точности , уменьшению… Ведущей в области конструирования и изготовления высоко точных приборов для… Многие фирмы выпускают комбинированные аналитические системы для одновременного химического и микробиологического…Взаимосвязь содержания соматических клеток в сборном молоке и заболеваемость коров стада субклиническим маститом
Хозяйства при отправлении молока на перерабатывающие предприятия определяют, плотность, кислотность, содержание жира. При поступления молока на… Необходимо отметить, что хозяйства и молочная промышленность республики… Одним из важнейших требований найболее полного использования молока на пищевые цели является повышение его качества …ЗАКЛЮЧЕНИЕ
Анализ литературных данных и результатов исследований по диагностике и профилактике вирусных респираторных и желудочно-кишечных заболеваний телят и поросят свидетельствует о том, что они остаются актуальной проблемой в животноводческих и свиноводческих хозяйствах. Инфекционный ринотрахеит, вирусная диарея, парагрипп-3, респираторно-синцитиальная, рота-, корона-, адено-, парвовирусные инфекции, трансмиссивный гастроэнтерит свиней, энтеровирусный гастроэнтерит поросят, хламидиоз, сальмонеллез, пастереллез, дизентерия регистрируются во многих странах мира с развитым животноводством и свиноводством и при их возникновении являются экономически значимыми заболеваниями. Основными причинами их возникновения являются нарушения условий кормления и содержания животных – стельных коров, супоросных свиноматок, новорожденных телят и поросят, использование комбикормов не по назначению и ряд других факторов, которые снижают резистентность организма животных и приводят к возникновению пневмоэнтеритов. На фоне этих нарушений активизируются вирусы и условно-патогенные микроогранизмы, обитающие в дыхательных путях и желудочно-кишечном тракте крупного рогатого скота и свиней. Необходимо учитывать и то обстоятельство, что взрослые животные после переболевания вирусными инфекциями, которые протекают у них без проявления клинических признаков, длительное время остаются вирусоносителями и представляют потенциальную опасность для телят и поросят, которые рождаются незащищенными. В хозяйствах, неблагополучных по вышеуказанных вирусных и бактериальных инфекциях, прослеживается тенденция названных болезней к стационарности и особенно это проявляется в крупных комплексах, когда постоянно имеются чувствительные животные – новорожденные телята и поросята.
Несмотря на достигнутые успехи в вопросах диагностики и профилактики названных заболеваний, при их возникновении животноводческие и свиноводческие хозяйства несут большие экономические потери от падежа молодняка. Поэтому и сегодня во всем мире проводятся поиски новых средств и способов специфической профилактики вирусных и бактериальных инфекций
В этой работе сделана попытка проанализировать и обобщить современные данные по этиологии, клиническому проявлению, эпизоотологическим особенностям вирусных, бактериальных и паразитарных, незаразных болезней сельскохозяйственных животных, отражены вопросы их диагностики и профилактики.
Особое внимание уделено вопросам дифференциальной диагностики пневмоэнтеритов телят и поросят, а также - борьбы с ними, проведения их профилактики.
Учитывая это, для их специфической профилактики необходимы ассоциированные вакцины против целого ряда инфекций. Одновременно требуется создание для животных оптимальных условий кормления и содержания, повышающих их устойчивость к заболеваниям. Только при таком комплексном подходе к профилактике пневмоэнтеритов можно быть уверенным в том, что сохранность телят и поросят будет высокой.
Авторы выражают надежду, что обобщенные современные данные по этиологии, патогенезу, клиническому проявлению, эпизоотологии, диагностике и профилактике пневмоэнтеритов телят и поросят вирусной и бактериальной этиологии, изложенные в монографии, будут полезными для научных сотрудников, занимающихся изучением названных заболеваний, специалистов ветеринарных лабораторий и практических ветеринарных врачей. Это даст возможность грамотно подходить к данной проблеме, поможет более оперативно и эффективней проводить диагностику и профилактику пневмоэнтеритов крупного рогатого скота и свиней, реализация которых позволит снижать заболеваемость и падеж животных.
| Литература |
| Абрамов С.С. Бронхопневмония // Профилактика незаразных болезней молодняка.— М.: Агропромиздат, 1990. — С.115—123. |
| Авербах М.М., Романова Р.Ю., Инсанов А.Б. и др. Циркулирующие иммунные комплексы и микобактериальные антигены в крови больнах туберкулезом легких//Микробиол. … -М.,1984.-№12.-С.91-94. |
| Агеева Т.Н. Антитела, иммунные комплексы, антигены при туберкулезе крупного рогатого скота и инфицировании атипичными микобактериями.:Дис. … канд. вет. наук: 16.00.03/ БелНИИЭВ. – Минск, 1993. – 147 с. |
| Андреев Е.В., Драгомир А.В. Острые респираторные заболевания крупного рогатого скота.— Кишинев: Картя-Малдовеняскэ, 1979.— 194 с. С.34—35. |
| Андросик Н.Н., Якубовский М.В., Панковец Е.А. Вирусный (трансмиссивный) гастроэнтерит поросят //Справочник по болезням молодняка животных. --Мн: Уроджай, 1995. -- С. 6 -- 9 |
| Апатенко В.М. Смешанные вирусные инфекции сельскохозяйственных животных.— Киев: Урожай, 1978.— 120 с. |
| Атамась В.А., Андреев В.Е., Чечеткина Н.Т. Респираторные болезни сельскохозяйственных животных.— Киев: Урожай, 1986.— 184 с. |
| Баева Е.В. Функции иммунной системы при стрессовых воздействиях в раннем постнатальном онтогенезе. Автореф. дис. ... д-ра биолог. наук: 14.00.16 /НИИ эксп. медицины.— Л., 1991.— 34 с. |
| Беляров В.М., Лукьяновский В.А. Некробактериоз: Клиника, профилактика, меры борьбы // Ветеринария. – 1984. - № 2. – С. 17-18. |
| Букринская А.Г., Грачева Н.М., Васильева В.И. Ротавирусная инфекция (этиология, клиника, диагностика, эпидемитология). --М.: Медицина, 1989. - 210 с. |
| Вирусные болезни животных/ В.Н.Сюрин, А.Я.Самуйленко, Б.В.Соловьев, Н.В.Фомина.- М., ВНТИБП, - 928 с. |
| Власенко В.В. Туберкулез в фокусе проблем современности/ Винница: Наука, 1998.- 350с. |
| Вскрытие животных и дифференциальная патоморфологическая диагностика болезней: Учеб. пособие / М.С.Жаков, В.С.Прудников, И.А.Анисим и др. - М.: Ураджай, 1998. - 263 с. |
| Высоцкий А.Э. Контаминация молочно-товарных ферм микобактериями и средства ее снижения: Дис. …канд. вет. наук:16.00.03 / Минск. 2002. - 146 с. |
| Выявление антител к возбудителям вирусно-бактериальных инфекций у беловежских зубров /Шашенько А.С., Красочко П.А., Красочко И.А. //Современные проблемы охраны зубра. Матер. международного симпозиума по зубру.— Минск, 1994.— С.73—74. |
| Гертман М.И. Биологические свойства Л-форм Mycobacterium bovis // Автореф. дис. ... канд. вет. наук. - М.: - 1988. – 18С. |
| Гизатуллин Х.Г., Юсупов Р.Х. Чума свиней и современные методы ее лабораторной диагностики.- Казань: Таткнигоиздат, 1973. - 120 с. |
| Горбань Н.И. Вирусные респираторные болезни животных.— Киев: Урожай, 1981.— 64 с. |
| Донченко А.С. Туберкулез крупного рогатого скота, верблюдов и овец: Автореф.дис. … докт. вет. наук: 16.00.03 / Л., 1989. – 34 с. |
| Донченко А.С. Туберкулёз крупного рогатого скота, верблюдов и овец: Автореф. дис. … канд. вет. наук: 16.00.03 / Ленинградский вет. ин-т. – Ленинград, 1989. – 34 с. |
| Донченко А.С. Установление парааллергии на туберкулин у крупного рогатого скота в благополучных хозяйствах // Ветеринария . - 1987. - № 12. - С.37-38. |
| Дорожкова И.Р. Формы персистирования микобактерий туберкулеза в организме человека.: Автореф. дис. … докт. мед. наук.- М., 1974.-41С. |
| Драгомир А. Вирусный гастроэнтерит //Сельское хозяйство Молдавии. -- 1976. -- N 6. -- С. 39. |
| Душук Р.В. Трансмиссивный гастроэнтерит свиней. (Обзор. информ.) ВНИИТЭИСХ. Сер. "Животноводство и ветеринария". –М., 1981. – 56 с. |
| Жидков С.А. Вирусная диарея — болезнь слизистых оболочек крупного рогатого скота (характеристика возбудителя, диагностика и специфическая профилактика) Автореф. дис. ... д-ра вет. наук: 16.00.03 /ВИЭВ.— М, 1994.— 44 с. |
| Завгородний А.И. Атипичные микобактерии у крупного рогатого скота в зоне лесостепи и степи Украинской ССР: Автореф. дис. ... канд. вет. наук: 16.00.03 / Харьковский вет. ин-т. - Харьков, 1987. - 22 с. |
| Зелютков Ю.Г. О возможности одновременной иммунизации против рота- и коронавирусной инфекции// Использование физических и биологических факторов в ветеринарии и животноводстве. Мат.Всес. научн.конф., Витебск, 11—12 сент.1991.-М., 1992. — С.48—49. |
| Зелютков Ю.Г. Эпизоотологическая и сравгнительная эффективность методов диагностики ротавирусной инфекции телят // Ветеринарная наука-производству. — Вып.27.-Мн., 1989. — С.13—19. |
| Зелютков Ю.Г., Гоголев М.М., Карпуть И.М. Лечение инфекционных энтеритов новорожденных телят// Тез.докл. III Всес. конф.по эпизоотологии. Новосибирск, 24—26 сентября 1991 /ВАСХНИЛ, РАСХН, ИЭВСиДВ.- Новосибирск, 1991. — С.281—282. |
| Зелютков Ю.Г., Красочко П.А. Эффективность постановки реакции непрямой гемагглютинации (РНГА) при диагностике вирусной диареи крупного рогатого скота //Информационный листок.— Витебск: ЦНТИ, 1989.— № 21.— 4 с. |
| Зелюткоў Ю.Г., Красачка П.А. Атрыманне эрытрацытарнага дыягностыкума вiруснай дыярэi буйной рагатай жывелы // Весцi Акадэмii навук БССР. Сер.сельскагаспадарчых навук. 1990.- № 1. — С.113—116. |
| Земскова З.С., Дорожкова И.Р. Скрыто протекающая туберкулезная инфекция // М.: - Медицина. - 1984. - С.49-63,178-186. |
| Зыков М.П., Ильина Т.Б. Потенциально-патогенные микобактерии и лабораторная диагностика микобактериозов. - М.: 1978. – 174 с. |
| Иммунитет и его коррекция в ветеринарной медицине /Красочко П.А., Новиков О.Г., Красочко И.А. и др. Под ред. П.А.Красочко. Смоленск, 2002. – 460 с. |
| Инструкция о мероприятиях по профилактике и ликвидации туберкулёза животных. Утв. Гл. упр. ветеринарии 10.11.1988. – 26 с. |
| Использование ИФА для изучения динамики противовирусных антиител Ig М и Ig G-классов / Красочко П.А., Ковалев Н.А., Красочко И.А. и др. // Ученые записки Витебского ордена “Знак Почета” ветеринарного института им. Октябрьской революции. Т.30.- Витебск, 1993. — С.62—64. |
| Использование твердофазного ИФА для выявления Ig М- антител к вирусу диареи у крупного рогатого скота / Красочко П.А., Красочко И.А., Федоров Ю.Н. и др. // Иммунитет сельскохозяйственных животных: Труды ВИЭВ. Т. 67.- М., 1989. — С 27—31. |
| Кадочкин А.М. Атипичные микобактерии и их роль в сенсибилизации животных к туберкулину // Бюл. ВНИИЭВ. - М.: - 1983. - Вып. 51. - С. 50-52. |
| Каронелли Т.В. Липиды микобактерий и родственных микроорганизмов. – М., 1984. – 135 с. |
| Карпуть И.М. Иммунология и иммунопатология болезней молодняка.— Мн.: Ураджай, 1993.— 288 с. |
| Карышева А.Ф., Карышев С.В. Справочник по инфекционным заболеваниям.— Кишинев: Штиинца, 1989.— 658 с. |
| Кассич Ю.Я. Реакция связывания комплемента и ее применение при оздоровлении стад крупного рогатого скота от туберкулеза: Автореф. дис. …докт. вет . наук.- М.- 1979 – 29 с. |
| Ковалев Н.А., Музычин С.И., Бутьянов Д.Д. Профилактика инфекционных болезней животных / Под ред. Н.А.Ковалева и С.И.Музычина.— Мн.: Ураджай, 1988.— 173 с. |
| Коваленко И.В. Л-формы микобактерий туберкулёза: Сб. Клиническое значение и выявление. - Мн.: «Наука и техника», 1989. - 104 с. |
| Красочко П., Пузына Г. Вакцины против бесплодия // Мололчное и мясное скотоводство.- 1991.- № 1. — С.37—38. |
| Красочко П.А. Иммунный ответ у телят при различных способах введения вакцинного РС-вируса // Технология получения и выращивания здорового молодняка сельскохозяйственных животных и рыбопосадочного материала. Тез. докл. республ. научн.-практ.конф. - Мн., 1993. — С.107—108. |
| Красочко П.А. Иммунологическая и профилатическая эффективность перги// Апитерапия сегодня (сборник 5). Матер. 5-й научн.-практ.конф. по апитерапии “Пчелы и ваше здоровье.-Рыбное, 1997. — С. 107—109. |
| Красочко П.А. Использование Т-активина для коррекции приобретенного иммунодефицита при респираторных инфекциях телят // Современные проблемы иммунологии, биотехнологии и клеточной инженерии в ветеринарной медицине. Тез.докл Всес. научн.-техн.конф. М., 1990. — С.75—77. |
| Красочко П.А. Моно- и ассоциативные вирусные респираторные инфекции крупного рогатого скота, (иммунологическая дигнос-тика, профилактика и терапия. Автореф. дис. ... д-ра вет.наук.16.00.03/ БелНИИЭВ.- Мн., 1997. — 34 с. |
| Красочко П.А. Роль вирусов в этиологии респираторных инфекций телят // Биотехнологические аспекты развития животноводства. Кишинев: Молдагроинформреклама, 1991. — С.125—130. |
| Красочко П.А. Чувствительность ИФА и РНГА при диагностике вирусной диареи крупного рогатого скота // Ветеринария. 1991.- № 5. С. 58—59. |
| Красочко П.А. Эффективное средство при респираторных заболеваниях // Молочное и мясное скотоводство.- 1992.- № 2. — С.7—8. |
| Красочко П.А., Грибко С.М. Специфическая профилактика инфекционного ринотрахеита и вирусной диареи крупного рогатого скота // Актуальные проблемы ветеринарной медицины. Матер.Межд.научн.-практ.конф. Смоленск, 1996. — С.39—41. |
| Красочко П.А., Еремия Н.Г. Иммунологическая оценка цветочной пыльцы и перги // Апитерапия и пчеловодство. Матер.научн.конф. Вып.3. Вильнюс: Ална литера. - 1993. — С.40—44. |
| Красочко П.А., Зелютков Ю.Г. Иммуноферментный анализ при обнаружении противовирусных антител в сборном молоке // Ветеринарная наука-производству. Межведомственный сборник. Вып.31. - Мн., 1993. — С.19—21. |
| Красочко П.А., Зелютков Ю.Г., Красочко И.А. Вирусные пневмоэнтериты телят. – Минск: БИТ “Хата”, 1999.- 168 с. |
| Красочко П.А., Красочко И.А. Наличие антител к вирусу диареи крупного рогатого скота у сельскохозяйственных и диких животных // Информационный бюллетень института экспериментальной и клинической ветеринарной медицины.- Харьков, 1995. — С.36—37. |
| Красочко П.А., Красочко И.А., Зелютков Ю.Г. Определение состояния поствакцинального иммунитета у телят с помощью ИФА // Иммунодиагностика и иммунотерапия. Труды 1-й Международной конф.- Витебск, 1995. — С.87—88. |
| Красочко П.А., Помирко Т.И. Анализ степени инфицированности крупного рогатого скота и овец вирусами парагриппа-3 и диареи // Современные аспекты профилактики инфекционных болезней молодняка /Межвузовский сборник научных трудов Кишиневского СХИ им. М.В.Фрунзе. Кишинев, 1989. — С. 52—55. |
| Красочко П.А.. Федоров Ю.Н., Феоктистова Т.А. Результаты разработки твердофазного ИФА-теста при вирусной диарее крупнорго рогатого скота // Биотехнологические аспекты развития животноводства. Кишинев: Молдагроинформреклама, 1991. — С.118—125. |
| Краткий определитель бактерий Берги //Под ред. Д.Ж.Хоуята.- М., «Мир», 1980.- 319 с. |
| Литвин В.П., Поживил А.И. Инфекционные и инвазионные болезни телят.— Киев: Наукова думка, 1991.— 208 с. |
| Лысенко А.П. Антигены Micobacterium bovis и атипичных микобактерий, изучение и применение для дифференциальной диагностики туберкулеза крупного рогатого скота: Дис. … докт. вет. наук: 16.00.03 / БелНИИЭВ. – Минск, 1994. – 379 с. |
| Лысенко А.П. Разработка и внедрение новых методов диагностики и профилактики туберкулеза крупного рогатого скота в республике Беларусь/ Современные вопросы патологии сельскохозяйственных животных. Сб. науч.тр. международ.науч-практич. конф.- Минск, 2003.- С. 6-9. |
| Лысенко А.П., Агеева Т.Н, Карпова Г.А. и др. Разработка упрощенной технологии получения туберкулинов и результаты их испытания в эксперименте. |
| Лысенко А.П., Карпова Г.А., Агеева Т.Н. Специфичность антигенов М. bovis при диагностике туберкулеза крупного рогатого скота в ИФА/Ветеринария. -1992. -N 3. -С. 22-24. |
| Максимович В.В. Дифференциальная диагностика классической чумы свиней. – Мозырь: КПУП «Колор», 2001. – 160 с |
| Максимович В.В., Веремей Э.И. Некробактериоз животных – Мозырь: КПУП «Колор», 1999. – 56 с. |
| Мартма О.В., Тяхнас К.К. Парааллергические реакции на туберкулин и их дифференциация // Ветеринария. - 1978. - № 4. -С. 35-38. |
| Мосин В.М. Трансмиссивный гастроэнтерит свиней (распространение, профилактика и меры борьбы): Автореф. Дисс. … конд. Вет. наук: 16.00.03 / БелНИИЭВ, 1998. – С.19. |
| Мусин А.Ж. Л-трансформация микобактерий туберкулеза в организме крупного рогатого скота // Автореф. дис. ... канд. вет. наук. - Алма-Ата. - 1985. – 19С. |
| Найманов А.Х. Аллергическая диагностика микобактериальных инфекций крупного рогатого скота: Автореф. дис. … докт. вет. наук: 16.00.03 / ВНИИЭВ. – М., 1993. – 29 с. |
| Нахмансон В.М., Бурба Л.Г. Дифференциальная диагностика инфекционных болезней сельскохозяйственных животных. Справочник. - М.: Росагропромиздат, 1990. - 255 с. |
| Никитин В.М. Справочник серологических реакций.— Кишинев: Штиинца, 1977.— 220 с. |
| Никитин М.Г., Базылев П.М. Болезнь Ауески. - М.: Колос, 1967. - 263 с. |
| Новиков Д.К., Новикова В.Н. Клеточные методы иммунодиагностики.— Мн.: Беларусь, 1979.— 224 с. |
| Овдиенко Н.П., Козин А.И. Применение РНГА для дифференциальной диагностики неспецифических туберкулиновых реакций у крупного рогатого скота// Труды ВИЭВ.- 1979.- Т. 49.- С. 102-107. |
| Особенности эпизоотической ситуации и динамика туберкулеза крупного рогатого скота в Республике Беларусь / А.П. Лысенко, А.А. Холод, Т.Н. Агеева и др. // Зооантропонозные болезни, меры профилактики и борьбы: Материалы международной научно-практической конференции. - Мн., 1997. - С. 65-66. |
| Панкова Г.Е. Респираторные болезни крупного рогатого скота.— М., 1986.— 44 с. |
| Паразитоценоз фасциол и микобактерий туберкулеза в организме животных /В.П.Марциновский, А.И.Мереминский, В.А.Кисилев, А.Я.Марциновская // III Всесоюзный съезд паразитоценологов. Тезисы докл. - Киев, 1991. - С. 100. |
| Патологическая анатомия сельскохозяйственных животных / А.В.Жаров, В.П.Шишков, М.С.Жаков и др.; Под ред. В.П.Шишкова, А.В.Жарова. - 3-е изд., перераб. и доп. - М.: Колос, 1995. - 543 с |
| Плященко С.И. Стрессы — благо или зло. Мн.: Ураджай, 1991.— 173 с. |
| Притыченко А.Н. Туберкулин очищенный для млекопитающих (оптимизация очистки, диагностические и иммунологические свойства): Дис. … канд. вет. наук: 16.00.03 / Минск, 2002. - 116 с. |
| Романенко В.Ф. Энтеровирусный гастроэнтерит //Справочник по болезням свиней. -- Киев: Урожай. -- 1981. -- С. 60 – 62. |
| Романенко В.Ф. Энтеровирусы свиней - возбудители энзоотического энцефаломиелита и гастроэнтерита: Автореф. дисс. ... д-ра вет. наук: 16.00.03 /Казанский вет. ин-т. -- Казань, 1978. -- 37 С. |
| Румачик И.И. Методические основы лабораторной диагностики туберкулёза крупного рогатого скота. // Ветеринария . - 1987. - № 12. С. - 62-64. |
| Румачик И.И. Методы оздоровления стад крупного рогатого скота от туберкулеза // Сб. Ветеринарная наука - производству. - Мн.: - 1993. - Вып. 31. - С. 70-77. |
| Румачик И.И. Совершенствование диагностики и мер борьбы с туберкулезом крупного рогатого скота и свиней: Дис. … докт. вет. наук: 16.00.03 / БелНИИЭВ. – Минск, 1997. – 379 с. |
| Сидорчук А.А., Дриаева М.Д., Федосеенко В.А. Значение анаэробных микроорганизмов и их ассоциаций в норме и патологии у сельскохозяйственных животных.// Новое в диагностике и профилактике болезней животных: Межвуз. сб. науч. тр./ МГАВМ и Б им. К.И. Скрябина, 1995. – С. 177-180. |
| Сидорчук А.А., Панасюк С.Д., Устинова Г.И., Кружков Н.Н., Федосеенко В.А. Некоторые аспектя иммунопрофилактики некробактериоза конечностей крупного рогатого скота при использовании ассоциированной вакцины «Нековак». // Актуальные вопросы инфекционных и инвазионных болезней животных: сб. науч. тр./ МГАВМ и Б им. К.И. Скрябина, 1995. – С. 142-146. |
| Соломаха О.И., Кириллов Л.В., Меньшин В.В., Лавченко Е.Г., Жиров В.А. Профилактика некробактериоза животных.// Ветеринария. – 1997. - № 5. – С. 15-17. |
| Стрижакова О.М., Вишняков И.Ф., Стрижаков А.А. Дифференцирование вирусов трансмиссивного гастроэнтерита свиней и респираторного коронавируса в сандвич варианте ТФ ИФА на основе моноклональных антител //Вирусные болезни с.-х. животных: Тез. докл. Всерос. науч. практ. конф., Владимир, 17 -- 21 апр. 1995 г. /Всерос. науч.-исслед. ин-т защиты животных. -- Владимир, 1995. -- С. 58. |
| Сюрин В.Н., Белоусова, Р.В., Фомина Н.В. Диагностика вирусных болезней животных: Справочник.— М.: Агропромиздат, 1991.— 528 с. |
| Туберкулез животных и меры борьбы с ним. / Под ред. Ю.Я. Кассича. – Киев. Урожай, 1990. – 304 с. |
| Тузова Р.В. Туберкулез сельскохозяйственных животных и птицы. – Минск, Ураджай, 1983. – 263 с. |
| Федоров Ю.Н. Факторы иммунобиологической защиты у новорожденных животных // Бюллетень ВИЭВ.-1982.- Вып.47. — С.60—62. |
| Федосеев В.С., Рубцова И.Н., Кириленко Н.Г. и др. Л-трансформация микобактерий//Ветеринария.- 1985.-№ 12.- С.30-32. |
| Федосеенко В.А., Сидорчук А.А., Есипенок В.А. Применение гидролизатов соевой муки и кормового концентрата лизина в качестве основ питательных сред для культивирования микроорганизмов. // Актуальные проблемы ветеринарно-санитарного контроля сельскохозяйственной продукции. // Тез. Докл. 2 межд. Научно-практической конф. / Москва, 1997. – С. 168-169. |
| Фримель Г. Иммунологические методы: М., «Медицина», 1987.-472 с. |
| Фукс П.П. Вирусно-микоплазменная патология генитальных и респираторных органов крупного рогатого скота (этиология, патогенез, диагностика): Автореф. дис. ... д-ра вет. наук: 16.00.03 /Казанский вет. институт.— Казань, 1990.— 38 с. |
| Ходун Л.М. Среда Фаст-ЗЛ для ускоренного выделения микобактерий туберкулёза // Ветеринария. - 1996. - № 8. - С. 51-52. |
| Ходун Л.П. Оптимизация аллергической и лабораторной диагностики туберкулёза крупного рогатого скота: Автореф. дис. … д-ра вет. наук: 16.00.03 / Казанская гос. академия вет. мед. – Казань, 1997. – 31 с. |
| Холод А.А., Лысенко А.П., Румачик И.И. Эпизоотическая ситуация по туберкулёзу крупного рогатого скота в Республике Беларусь // Зооантропонозные болезни, меры профилактики и борьбы: Материалы международной научно-практической конференции. Гродно, - 1997. - С.64. |
| Христов С. Коронавирусни заболевання при свинете.. Ветер. Сб. -- 1983. -- 81, 8. -- С. 18 -- 21. |
| Чепик Г.В. Методика дифференциации туберкулиновых реакций с применением ППД-туберкулина для млекопитающих и птиц. - М., 1980. – 8 с. |
| Шаров А.Н. Аллергическая диагностика туберкулёза у животных: повышение её эффективности: Автореф. дис. ... док. вет. наук: 16.00.03 /Всесоюзный ин-т экспериментальной ветеринарии. - М., 1989. – С. 9-10, 32-34. |
| Шаров А.Н. Наставление по применению симультанной туберкулиновой пробы с применением туберкулина и комплексного аллергена из атипичных микобактерий (КАМ) при диагностике туберкулёза у животных. - М., 1978. - 7 с. |
| Шаров А.Н., Плотников Э.С. Комплексный аллерген из атипичных микобактерий // Ветеринария. - 1980. - № 5. - С. 41-43. |
| Шахов А.Г. Положенко Э.Г. Груздев К.Н. Профилактическая эффективность интерферонов в ветеринарии: Тез. докл. республ. семинара. -- Киев, 17 -- 19 окт. 1989 г. -- С. 32 – 34. |
| Штрауб О.Х. Инфекции крупного рогатого скота, вызванные вирусами герпеса.— М.: Колос, 1981.— 207 с. |
| Щуревский В.Е., Овдиенко Н.П., Кадочкин А.М., Кудяров В.Н. Быстрорастущие микобактерии и их значение в патологии крупного рогатого скота//Ветеринария.-1984.-№ 9.- С.29-30. |
| Ястребов А.С. Борьба с вирусными гастроэнтеритами поросят в свиноводческих хозяйствах //Международный аграрный журнал. –Минск, 1998, № 4. –С. 45—46. |
| Ястребов А.С. Вирусные гастроэнтериты в свиноводческих хозяйствах Республики Беларусь // Весцi Акадэмиi аграрных навук Республiкi Беларусь. – Минск, 1998, № 3. С.72—74. |
| Ястребов А.С. Вирусные гастроэнтериты свиней. Минск. БИТ “Хата”, 1999.- 80 с. |
| Ястребов А.С., Савельева Т.А. Эпизоотическая эффективность асоциированной вакцины против трансмиссивного гастроэнтерита и ротавирусной болезни поросят //Зооантропонозные болезни, меры профилактики и борьбы: Тез. докл. международ. науч.-практ. конф., Гродно, 23--24 окт. 1997 г. /Белорус. науч.-исслед. ин-т эпидемиол. и микробиол., Белорус. науч.-исслед. ин-т эксперимент. вет., Гродненский с.-х. ни-т, Гродно, 1997. -- С. 40. |
| Ястребов А.С., Ковалев Н.А., Савельева Т.А. Диагностики вирусных гастроэнтеритов в свиноводческих хозяйствах //Животноводство. – Минск. – 1999, № 2. – С. |
| Ястребов А.С., Савельева Т.А. Энтеровирусный гастроэнтерит свиней //Ветеринарная наука – производству: Сб. науч. Тр. / Булорус. Науч.—исслед. ин-т эксперимент. Вет. – Минск: Хата, 1998. –вып. 33. – С. 12—14. |
| Benfield D.A., Haefterman E.O., Burnstein T. An indirect fluorescent antibody test for antibodies to transmissible gastroenteritis of swine //Canad. J. Comp. Med. -- 1978. -- Vol. 42, N 4. -- P. 478. |
| Bohl E.H. Transmissible gastroenteritis //Diseases od swine. Iowa State University Press, Ames 5th ed. -- 1981. -- P. 195. |
| Bohl E.H. Transmissible gastroenteritis of swine //Diseases of Swine. Iowa Press University. -- 1975. -- P. 195. |
| Bolin S.R. et al. Frequency of association of noncytopathic bovine viral diarrhea virus with mononuclear leucocytes from persistently infected cattle // Am. J. Res.— 1987.— V.48.— № 10.— P.1441—1445. |
| Bolin S.R., Scclurkin A.W., Coria M.F. Effect of bovine viral diarrhea virus on the percentages and absolute numbers of circulating B- and T-lymphocytes in cattle // Am. J. veter. Rec.— 1985.— V.46.— № 4.— P.884—886. |
| Closs O., Harboe M., Axelsen N. et al. The antigens of M. Bovis strein BCG. – Studied by Crossed Immunoelectrophoresis a Referense System, // Scand. J. Immunol. - 1980. - 12. - P. 263-28. |
| Daniel T.M., Eduardo A., Belestrino O.C., et. al. The tuberculosis specificity in humans of M.tuberculosis antigen 5//Amer. Rev. Rest. Dis.- 1982.-126.4.- P.600-606. |
| Daniel T.M., Janicki B. Mycobacterial antigens. – Microbial Reviews, Vol. 42, № 1, 1978. – P. 84 – 113 |
| Dannacher G., Moussa A. Ratogenic et formes cliniquen de l’infection par le virus de la diarrhee viral bes bivins (BVD) // Rev. Med. veter.— 1986.— V.137.— № 5.— P.359—365. |
| Epizootology of PI-3, Bovine RS- and IBR-virus infections in dairy herds with traditional calf rearing / Van Nienwstadt A.P.K.M.I., Verhoeff J., van den Ingh. T.S.G.A.M., Hartman E.G. // Proc. 12 th. World Congress on Diseases of Cattle.— 1982.— V.1.— P.124—130. |
| Fu Z.F., Hampson D.J. Group A rotaviruses excretion patterns in naturally infected pigs //Rev. Veter. Sc. -- 1987. -- Vol. 43, N 3. -- P. 297 -- 300. |
| Fukusho A., Shimizu Y., Ito Y. Isolation of cytopathic porcine in cell roller culture in the presence of trypsin //Arch. Virol. -- 1981. --Vol. 69, N 1. -- P. 49 -- 60. |
| Garcia S.J.F., Amador Y.A., Perales O.J.A. Clasificacion del genero Mycobacterium // Rev. Latinoamer. Microbiol., 1977, - Bd. 19. - N. 1. - P. 7 - 15. |
| Harboe M. ,Wiker, R. Duncan, M. Garsia, T. W. Duker, B. W. Broolcs, C.Turcotte and S. Nagai, Protein G based enzymelinked immunosorbent assay for anti-MPB 70 antibodies in bovine tuberculosis//J. Clin. Microbiol. ,-1990. -28,-5,-913-92l. |
| Hess R.G. Control of infectious gastroenteritis of swine //21 st Intern. Veter. Congr., 6. -- 1979. -- P. 34. |
| Hogg A. TGE epizootic and enzootic //Med. Vet. Pract. -- 1981. -- Vol. 83, N 6. -- P. 489 -- 492. |
| Liess B. Bedentung der Immunotelerance fur die Pathogenese der bovinen Virusdiarrhoe (BVD) // Berl. U. Munch. Tierarztl. Wschr. — 1985.— V.98.— № 12.— P.420—423. |
| Ludwig H. Bovine herpesviruses // The Herpesviruses (ed. B.Roizman) I.B.Plenum Press New York and London, Charter.— 1982.— P.135—214. |
| McKecher D.G. Viruses if other vertebrates // The herpesvirus / Kaplan A.S. ed al.— New York: Academie Press, 1973.— P.427—493. |
| Monaghan M.U. et al. In vitro immunodiagnostic assays for bovine tuberculosis // Veterinary Mycrobiology. - 1994. - № 40 - P. 111-124, 125-135. |
| Nafi E.K., Nassaan N.K., El-Sebaia A. Serum protein electrophoresis profiles under spontaneus cases of infectious bovine rhinitracheitis (IBR) and Mucosal disease virus diarrhea (MD-VD) infectiu calves // Asson. Veter. Med. J.— 1985.— V.14.— № 28.— P.153—157. |
| Olafson P., McCallum A.D., Fox F.H. An apparantly new transmissible disease of cattle // Cornell Vet.— 1946.— V.36.— № 3.— P.205—213. |
| Panina G. Infezioni intestinali da agenti virali nei suinetti //Revista Suinicoltura. -- 1978. -- Vol. 19, N 3. -- P. 59. |
| Pensaert M.B., Cox E. Porcine respiratory coronavirus related to transmissible gastroenteritis virus //Agri.-Pract. -- 1989. -- Vol. 10, N 2. -- P. 17 -- 21. |
| Petersen K.F. Mycobacterien und Mycobacteriosen (Quber Tuberculose und Lepre)// Pneumologie.-1989.- 43.5.- s.236-249. |
| Pitshard E.I. Experimental transmission of transmissible gastroenteritis by starlings //Amer. J. Vet. Res. -- 1965. -- 26. -- P. 1177 -- 1179. |
| Rouse B.T., Babiuk L.A. Host responses to infections bovine rhinotracheitis virus 1. Isolation and immunologic activities of T-lymphocytes // J. Immunol.— 1974.— V.113.— P.1391—1398. |
| Runyon E. Recognition and characterisation of pulmonary mycobacteria pathgens other than tubercle bacilli // Bull. Int. centre Tuberc. - 1959. - B. 29,4. - P. 369 - 413. |
| Simikins R.A., Weilnan P.A., Saif L.J. Antigenic variation among transmissible gastroenteritis virus (TGE) and porcine respiratory coronavirus stsains detected with monoclonal antibodies to the S protein of TGEV //Amer. J. Vet. Res. -- 1992. -- Vol. 53 -- P. 1253 -- 1258. |
| Straub O.C. Infectiose bovine rhinotracheitis. History and development // Develop. biol. Standart.— 1975.— № 28.— P.530—533. |
| Takimura Y., Thompson J.R. Laboratory diagnosis of mycobacteria // J. Hospital Tapica. - (USA). - 1969. - P. 77-78. |
| Tsukamura M. Numerical classification of 280 strains of slowly growihg mycobacteria. Proposal of Mycobacterium tuberculosis series, Mycobacterium avium series and Mycobacterium nonсhromogenicum series // Microbiol. аnd Immunol., 1983. – Bd. 27. – N. 4. – P. 315 – 334. |
| Witte K.H. et al. Die epizootische Virusdiarrhoea //Tierarztl. Umschau. -- 1981. -- 36,4. -- S. 235 -- 250. |
| Woods R.D., Geoffrey, Corlet et al. Attenuated virus. Патент 8800100. Великобритания МКИ С 12 N 7/00, 15/00, А61К39/П5. Заявл. 5.01.1989. //Изобретения стран мира. -- М., 1990. --Вып. 65, N 2. -- 12 с. |
Приложение 1
Постановление Министерства сельского хозяйства и продовольствия от 3 января 2001
В соответствии с Законом Республики Беларусь от 2 декабря 1994г. «О ветеринарном деле» (Ведомости Верховного Совета Республики Беларусь, 1995г., №… утверждении Положения о порядке освобождения от обложения налогом на… Министерство сельского хозяйства и продовольствия Республики БеларусьПОЛОЖЕНИЕ
1. Настоящее Положение разработано в соответствии с Законом Республики Беларусь «О ветеринарном деле» (Ведамасцi Вярхоунага Савета Рэспублiкi… 2. Положение является обязательным для юридических лиц независимо от форм… 3. Для получения разрешения на ввоз заявитель представляет в Главное управление ветеринарии с Государственной…Обоснование Программы
Гельминтозы оказывают многообразное патологическое воздействие на состояние здоровья населения и, особенно, детского. Они вызывают выраженную… Сокращения в тексте: Государственное учреждение (далее – ГУ) «Республиканский центр гигиены, эпидемиологии и общественного здоровья» -…ПРИЛОЖЕНИЕ 4
| КОМПЛЕКС ВЕТЕРИНАРНО-САНИТАРНЫХ МЕРОПРИЯТИЙ ПО ДИАГНОСТИКЕ, ПРОФИЛАКТИКЕ И ТЕРАПИИ ЗАБОЛЕВАНИЙ КРУПНОГО РОГАТОГО СКОТА НА ЖИВОТНОВОДЧЕСКИХ ФЕРМАХ И КОМПЛЕКСАХ |
| №№ п/п | Наименование мероприятий | Срок обработки | Примечение | |||
| 1. ОБЩЕХОЗЯЙСТВЕННЫЕ И САНИТАРНЫЕ МЕРОПРИЯТИЯ | ||||||
| 1. | Посещение специализированных ферм и комплексов разрешается при наличии письменного допуска областного управления ветеринарии, главного ветеринарного врача района | Постоянно | ||||
| 2. | Вход на территорию осуществляется через санитарный пропускник с обязательной заменой верхней одежды и обуви на спецодежду и спецобувь. | Постоянно | ||||
| 3. | Специальные транспортные средства на территорию комплексов и ферм пропускают только через дезбарьер. | Постоянно | ||||
| 4. | Обслуживающий персонал животноводческих ферм обеспечивается двумя комплектами санитарной одежды, смену, стирку и дезинфекцию которой необходимо проводить не реже одного раза в неделю. | Постоянно | ||||
| 5. | На животноводческих фермах (в коровниках, профилакториях, прифермских территориях, выгульных площадках) осуществлять проведение комплекса санитарных работ: механическую очистку, санитарный ремонт, дезинфекцию, побелку, проведение санитарных дней. | 1 раз в месяц | ||||
| 6. | На территориях ферм и комплексов запрещается содержать собак (кроме сторожевых) и скот личного пользования. Сторожевых собак необходимо подвергать вакцинации против бешенства, чумы, парвовируснорго энтерита, дегельминтизации и другим ветеринарным обработкам. | Постоянно | ||||
| 7. | У входа в каждое производственное помещение устанавливаются постоянно действующие дезбарьеры (дезванны, дезковрики), заполненные 2% раствором едкого натрия или другими дезосредствами. | Постоянно | ||||
| 8. | На молочно-товарных фермах хозяйства организовать цеховую систему содержания крупного рогатого скота: -цех сухостойных коров; - родильное отделением и профилакторий; -цех раздоя и осеменения коров; -цех производства молока | Постоянно | ||||
| 9. | Обязательным условием для всех ферм и комплексов является соблюдение принципа “свободно-занято” с обязательной санацией помещений в течение 2-3 дней. | Постоянно | ||||
| 10. | Постановка новых групп животных в помещения (родильное отделение, профилакторий, телятник) разрешается только после их предварительной подготовки, трех-дневной санации. | Постоянно | ||||
| 11. | Подготовка помещений для постановки новых групп животных осуществляется следующим образом: -тщательная механическая очистка и мойка стен, полов, кормушек, ограждений, станков, боксов, клеток, навозных каналов, транспортеров и т.д. с использованием технических средств (УДП, УДП-М, ОМ 52-80 и т.д., подающих воду под давлением не менее 20 атмосфер; -влажная дезинфекция одним из дезинфектантов: 3-4% горячим раствором едкого натра из расчета 0,5-1 л на м2, 10-15%-ным раствором гипохлорита кальция; 5% раствор хлорамина, 2%-ный раствор теотропина из расчета 0,3-1 л на 1 м2 и т.д. -аэрозольная дезинфекция (при отсутствии животных и полной герметизации) 40%-ным раствором формалина из расчета 15-20 мл на 1 м3 помещения при помощи аэрозольных генераторов (установки АГ-УД-2, САГ-2 и т.д.); - аэрозольная дезинфекция в присутствии животных осуществляется 1-3%-ным раствором формальдегида, 2-3%-ным раствором теотропина 1-2%-ным раствором глутарового альдегида; 0,5-1% раствором едкого натрия из расчета 15-20 мл на 1 м3 помещения. | Постоянно | ||||
| Организационно-хозяйственные мероприятия по обеспечению высокой воспроизводительной функции животных | ||||||
| В хозяйстве анализировать и подводить итоги работы по каждой ферме за истекший месяц по воспроизводству стада и принимать меры по устранению выявленных недостатков. | До 5 числа каждого месяца | |||||
| Для контроля за состоянием здоровья животных проводить доклиническую диагностику уровня обмена веществ на основании биохимических исследований крови следующих показателей: общий белок, альбумины, глобулины, остаточный азот, мочевину, общий кальций, неорганический фосфор, каротин. Витамины А, С, холестерин, бета-липопротеиды, глюкозу, кетоновые тела, гемоглобин, метгемоглобин , щелочной резерв. | За 1-1,5 мес. до родов октябрь-ноябрь | Формирует контрольные группы животных 10-15 гол. наиболее полно отра жающих средний возаст, массу тела и продуктивность стада. | ||||
| При обнаружении отклонений в обмене веществ принимаются меры по коррекции рационов для восполнения дефицитных питательных веществ с учетом качества и химического состава кормов, а также дополнительного назначения витаминных препаратов, минеральных премиксов, синтетических антиоксидантов. | Постоянно | |||||
| Контроль за качеством и соотношением кормов в рационе: (сено- 25-30%, силос или сенаж - 25-30%, концентраты 20-25%, корнеклубнеплоды - 15-20%) | Постоянно | |||||
| Ограничение скармливания силоса или сенажа. на 1 голову дается 7-10 кг сена, 3-5 кг силоса или сенажа хорошего качества, 5-7 кг корнеклубнеплодов, 2 кг концентратов | За 14 дней до отела | |||||
| Необходимо проводить ежедневный моцион стельных коров и нетелей | По 3-5 часов ежедневно | |||||
| Запуск коров осуществляют за 60 дней до отела. | В течение 5-6 дней | |||||
| За 1,5-2 месяца до отела стельных коров и нетелей переводят в цех сухостойных коров или выделяют в отдельные группы. | Постоянно | |||||
| За 5-10 дней до отела коров и нетелей переводят в родильные отделения, тщательно очищенные, вымытые и продезинфицированные. | Постоянно | |||||
| Родильное отделение функционирует в режиме предприятий закрытого типа. Оно должно быть теплым (12-160С), сухим (относительная влажность 70-75%), светлым (80-100 люкс) и содержаться в образцовом порядке. В нем имеются душевая комната для санитарной обработки животных, необходимое оборудование и дезинфицирующие средства. В качестве подстилки используют сухую солому, которую меняют ежедневно.Навозные желоба посыпают хлорной известью, а проходы известью-пушенкой. Стойла дезинфицируют перед постановкой в них животных и после освобождения. Метлы, лопаты хранят в бочке с дезраствором, раз в месяц организуют санитарный день для проведения тщательной еханической очистки полов и стен, кормушек, оборудования, проводят дезинфекцию (5%-ный раствор кальцинированной соды, 3%-ный креолин,2%-ный едкий натрий и др.), а затем побелку стен и перегородок 15-20%-ной взвесью свегашенной извести. | ||||||
| Перевод коров или нетелей в родильные боксы после дополнительной санитарно-гигиенической обработки кожи с применением дезрастворов | За 12-24 часа до отела | |||||
| Санация наружных половых органов, промежности, хвоста, задней части крупа теплой водой с мылом и орошением слабым раствором дезинфицирующих средств (раствор марганцевокислого калия 1:5000, 1% раствора лизола и т.д.) | При появлении первых признаков родов | |||||
| В родильном отделении закрепляют постоянный обслуживающий персонал, обученный правилам приема и ухода за новорожденными телятами. Перед приемом теленка доярка моет руки теплой водой с мылом и дезинфицирует их 0,5-1%-ным раствором хлорамина. В сезон массовых растелов организуют круглосуточное дежурство. | ||||||
| Сразу после родов корове предоставляют возможость облизать теленка и дают подсоленную теплую воду (100гр. Соли на ведро воды, можно добавить 1 кг комбикорма). | ||||||
| Ежедневно проводить осмотр растелившихся животных и в случае задержания последа приступают к его оперативному отделению между 24-36 ч. после отела. | ||||||
| Перед переводом из родильного отделения в цех раздоя и осеменения на 10-14 день после отела проводят клинико-гинекологическое обследование коров с целью выявления послеродовых заболеваний и принятия лечебных мер. | ||||||
| В период с 25 по 45 день после отела проводят повторное клинико-гинекологическое исследование коров. | ||||||
| Всех животных с нормальной упитанностью без видимой патологии половых органов спустя 45 дней после отела подвергать неспецифической стимуляции воспроизводительной функции и только в случае отсутствия эффекта после 3-х сеансов лечения назначают специфические средства. | ||||||
| Через 2 месяца после последнего осеменения поводят ректальное обследование на стельность и оперативно принимаются меры в случае бесплодия животного. | ||||||
| При многократных и непродуктивных осеменениях проводить мероприятия, обеспечивающие повышение оплодотворяемости (санация полости матки, стимуляция полноценной овуляции, лечение атонии половых путей и др.). | ||||||
| В конце года подвести итоги работы по воспроизводству стада с определением причин яловости и бесплодия (аборты, мертворождение, выбытие стельными, выбытие нестельными в 1 кв., удлиненный сервис-период) и определить задачи на предстоящий год. | ||||||
| Микроклимат помещений обеспечивают в соответствии ОНТП-1-77 | Постоянно | Температура воздуха зимой +10оС, относительная влажность - до 75%. движение воздуха - 0,5 м/с, содержание аммиака до 0,2 мг/л, воздухообмен 17 м3+/ч на 1 ц массы тела. | ||||
| СПЕЦИАЛЬНЫЕ ВЕТЕРИНАРНО-САНИТАРНЫЕ МЕРОПРИЯТИЯ | ||||||
| Ветеринарно-санитарные мероприятия, проводимые с сухостойными коровами и нетелями при их подготовке к отелу | ||||||
| 1. | В зависимости от эпизоотической ситуации, возникающей в хозяйстве стельных коров и нетелей иммунизируют против: | |||||
| -колибактериоза крупного рогатого скота | За 2-1,5 месца до отела двукратно | Инактивированой формол-квасцовой вакциной (с учетом циркуляции антигенных вариантов E.coli в стаде) | ||||
| -сальмонеллеза (паратифа) | За 2-1,5 месца до отела двукратно | Инактивированными вакцинами (с учетом циркуляции возбудителей в стаде) | ||||
| -пастереллеза | За 2-1,5 месца до отела | |||||
| -рота- и коронавирусной вирусной инфекции | За 2-1,5 месца до отела двукратно | Инактивированными вакцинами (в зависимости от наличия возбудителей в стаде) | ||||
| -инфекционного ринотрахеита крупного рогатого скота | Во второй половине стельности двукратно | Живой вакциной (в зависимости от наличия возбудителя в стаде) | ||||
| -вирусной диареи крупного рогатого скота | Во второй половине стельности двукратно | Живой вакциной (в зависимости от наличия возбудителя в стаде) | ||||
| -парагриппа-3 крупного рогатого скота | Во второй половине стельности двукратно | Живой вакциной (в зависимости от наличия возбудителя в стаде) | ||||
| Восполняют недостаточность витаминов в рационе путем внутримышечного введения витамина А - 700 тыс.ИЕ, Д - 200 тыс. ИЕ, Е - 200 ИЕ | Трехкратно через 10-12 дней за 1,5 - 1 месяц до отела | |||||
| Скармливают витаминно-минеральные и минеральные подкормки, а также полисолей микроэлементов | Ежедневно начиная за 60 дней до отела | Костовит-Форте, Олиговит, Биовит-2 и т.д. | ||||
| Ветеринарно-санитарные мероприятия, проводимые при нарушениях воспроизводительной функции у коров | ||||||
| При задержании последа к лечению приступать через 6-8 часов после выведения плода. Коровам подкожно вводить окситоцин или питуитрин по 30-40 ЕД (2-3 раза с 3-часовым интервалом, увеличивая дозу до 45-50 ЕД). Можно назначать и нейротропные препараты 0,5%-ный прозерин или 0,1% карбахолин подкожно 2-3 мл. Внутривенно вводить 150-200 мл 40%-ного раствора гдюкозы, глюконат кальция или хлористый кальций 100-120 мл (10%-ный раствор). При отсутствии эффекта от принятых мер через 24-36 ч. приступать к оперативному отделению. После операции в матку вводить антимикробные средства широкого спектра действия (экзутер 1-2 таблетки, геомицин-Ф, гинобиотик и др.). Введение препаратов повторять 2-3 раза с интервалом 24-48 часов. Для восстановления сократительной функции матки применять окситоцин, питуитрин, прозерин, карбахолин и т.д. За животными ежедневно вести наблюдение в течение 15-25 дней. | ||||||
| При субинволюции матки и послеродовых эндометритах лечение коров должно быть комплексным, курсовым и по заранее составленной схеме и направленное на повышение защитных функций организма, усиление сократительной способности матки и освобождение ее полости от патологического содержимого; на восстановление структуры и функции эндометрия; подавление жизнедеятельности патогенной микрофлоры. Для повышения защитных сил организма наряду с назначением диетического кормления, надлежащего ухода и содержания рекомендуется внутривенное введение растворов глюкозы, хлористого кальция и применение одного из средств патогенетической неспецифической терапии: ихтиоло-, новокаинотерапия, витаминные препараты в лечебных дозах. Для усиления сократительной функции матки и освобождения ее полости от скопившихся лохий, эксудата коровам дважды с 24-часовым интервалом вводить 1%-ный раствор синестрола в дозе 0,8-1 мл на 100 кг массы, после этого вводить окситоцин или питуитрин 30-40 ЕД 1-2 раза в день в течение 4-5 суток. Из нейротропных препаратов применять прозерин, карбахолин в дозе 2-3 мл. Для подавления развития микрофлоры в матку вводить антимикробные средства в жидкой форме подогретыми до температуры тела, обычно в дозе 75-150 мл с интервалом 24-48 часов или готовой форме (свечи, таблетки, палочки) вводить по 1-5 шт. с тем же интервалом. | ||||||
| Стимуляция половой функции: а) неспецифическая (активный моцион, массаж матки и яичников, витаминные препараты, молозиво, АСД-2 и др.) б) специфическая При гипофункции яичников назначают гонадотропные препараты: -фолликулин внутримышечно двукратно с интервалом 7-9 дней в сочетании с витамином Е (3-4 мл 750-1000мл токоферола). -Сыворотка жеребых кобыл (СЖК) 2500-3000 м.е. подкожно однократно. Чтобы предотвратить анафилаксию сначала вводить 1-2 мл, а через 1-2 часа остальную дозу. -Агофоллин, сурфагон, гравогормон и др. При персистентных желтых телах назначают препараты лютеолитического действия: а) Простагландины (эстрофан, суперфан, ремофан и др.) вводить двукратно с интервалом 11 дней по 2 мл внутримышечно б) Энуклеация (отдавливание). | ||||||
| Повышение оплодотворяемости коров. Осеменять животных только при нормальном состоянии половых органов. Если охота проявилась в первые 30 дней после отела - осеменять при условии нормальных родов и отсутствия послеродовых заболеваний. Осеменение проводить в спокойной обстановке, не ранее чем через 15-20 мин. После помещения коровы в станок и выдерживать там после осеменения еще 15-20 мин. Выпускать в стадо после окончания охоты. Осеменять корову перед доением или не ранее 2,5-3 часов после доения. С целью повышения оплодотворяемости животных, особенно при многократных осеменениях, применять до и после осеменения препараты по нижеприведенным схемам: а) сразу после выявления охоты ввести внутримышечно 0,5 мл агофоллина или 2 мл сурфагона. б) за 2-3 часа до осеменения ввести в шейку матки пенициллин (200тыс.ед), стрептомицин (250-300 тыс.ед.) или др. антибиотики нетоксичные для спермиев. в)перед осеменением ввести в канал шейки матки на глубину 2-4 см окситоцин или питуитрин - 2 мл (10 ЕД). Окситоцин можно вводить в первые 10-15 мин после осеменения внутримышечно в дозе 6-8 мл (30-40 ЕД).. г) через сутки после осеменения вводить внутримышечно 1%-ный раствор прогестерона в дозе 10 мл 2-3 дня подряд или по 5мл на 2, 3, 4, 6 и 8 дни. | ||||||
| Профилактика инфекционных и инвазионных заболеваний. Низкая оплодотворяемость, наличие абортов и мертворожденности приплода, массовая заболеваемость и высокий отход молодняка указывают на возможное поражение стада инфекционными и инвазионными заболеваниями, приводящими к бесплодию маток - инфекционным ринотрахеитом, вирусной диареей, хламидиозом, вибриозом и др. Диагностические исследования проводят путем определения возбудителя (вирусы, бактерии, клостридии, вибрионы) в пробах крови у 7-10% животных, влагалищной слизи, кусочках плаценты, других органах и сычуге абортированных плодов. В зависимости от эпизоотической ситуации хозяйства осуществляют профилактическую иммунизацию коров и нетелей вакцинами против вышеуказанных инфекций в соответствии с наставлениями по применению вакцин. (Порядок применения вакцин против инфекционного ринотрахеита и вирусной диареи см. выше) -Псевдомоноз крупного рогатого скота. Вакцина против псевдомоноза в дозе 5 мл внутримышечно в области крупа двукратно с интервалом 10 дней. -Хламидиоз крупного рогатого скота. Используют вакцину против хламидиозного аборта овец в дозе 3 мл перед осеменением коров однократно подкожно в области подгрудка или вакцину против хламидиоза крупного рогатого скота (в соответсвии с насталением по применению) . -Вибриоз (кампилобактериоз). Специфической вакцины нет. Мероприятия проводят согласно ветеринарному законодательству (т.1,1973). Трихомоноз. Специфической вакцины нет. Мероприятия проводят согласно ветеринарному законодательству (т.1; 1973). | ||||||
| Все проводимые специалистами мероприятия должны быть зарегистрированы в гинекологическом журнале, который ведется по принципу истории болезни. По другим менее распространенным гинекологическим заболеваниям лечебно-профилактические мероприятия проводить согласно методическим рекомендациям БелНИИЭВ им.С.Н.Вышелесского “Диагностика, профилактика и лечение гинекологических болезней коров”, 1995 год | ||||||
| Комплекс мероприятий по диагностике, лечению и профилактие субклинических и клинических маститов в лактационный период | ||||||
| ДИАГНОСТИКА | ||||||
| Ветеринарная служба организует карантинирование всех животных, поступающих для комплектования молочных ферм. За время карантина дважды исследуют коров и нетелей ( на 8-9 мес. Стельности) клиническими методами, а при установлении отклонений от физиологической нормы и при помощи быстро маститного теста на молочно- контрольных пластинках МКП-2 с Беломастином. | ||||||
| Направляются не менее двух раз в год в районную ветлабораторию пробы молока, секрета вымени, взятые от коров в лактационный и запускной периоды для проведения бактериологических исследований и определения чувствительности выделенных микроорганизмов к антибиотикам. | ||||||
| С целью выявления клинических маститов, изменения физико-химических свойств молока ( цвета, наличие сгустков, примесь слизи) периодически контролируется по ежедневному сдаиванию первых струек молока дояркой в специальную кружку. | ||||||
| В плановом порядке не менее одного раза в месяц проводятся исследования коров дойного стада на скрытые маститы с использованием быстрых маститных тестов ( беломастин,димастин и другие) на МКП- 2. Выявленных в результате исследований коров подвергают лечению. Секрет, молоко полученное из пораженных долей уничтожают. | ||||||
| Выздоровление коров контролируется клиническими методами ( осмотр, пальпация, пробное сдаивание) и с помощью быстрых маститных тестов. При положительных результатах исследования на 7-10 день после окончания лечения животным назначают повторный курс лечения | ||||||
| Ведется строгий учет больных животных в амбулаторном журнале | ||||||
| ЛЕЧЕНИЕ | ||||||
| Общее положение.Для удаления патологического секрета и уменьшения напряжения тканей вымени у больных животных сдаивают секрет:при остром течении мастита через 2-4 часа, при подостром и хроническом в обычные сроки доения. | ||||||
| Если воспалению предшествует другая болезнь (эндометрит, мастит), то наряду с противомаститными препаратами принимают меры к лечению первичного или способствующего заболевания. | ||||||
| Положительные результаты исследования на 5-7 день после лечения свидетельствуют, что животное больное, поэтому курс лечения повторяют, контролируя его клиническими и быстрыми маститными тестами. | ||||||
| При лечении мастита используют этиотропную, патогенетическую, физическую и комплексную терапию , сочитающие два или три лечения. | ||||||
| Этиотропная терапия. При лечении животных с острым серозным катаральным , гнойно-катаральным и фибри-нозным маститом вводят парентерально в дозах 3-5 тыс.единиц на 1 кг массы антибиотики. Из антибиотиков при лечении мастита наиболее эффективны сочетания: пенициллин + стрептомицин, стрептомицин + эритромицин, тетрациклин + неомицин, бициллин-3 и другие. При выборе антибиотиков для лечения, целесообразно определить чувствительность выделенной микрофлоры. Для лечения при остром течении мастита, вводят внутримышечно один из препаратов: 1% раствор стрептоцида, 1-5% раствор норсульфазола. , растворы риванола 1: 1000, 2-5% раствор ихтиола и фурациллина 1: 5000.Растворы вводят подогретыми до 38-40 С в дозе 50-80 мл. С целью разжижения скопившегося в молочной железе секрета вводят 50-60 мл 1-2% раствор гидрокарбоната ( натрий двууглекислый, 0,25% раствор нашатырного спирта с последующим сдаиванием через 15- 20 минут.Для лучшего удаления содержимого вымени окситоцин вводят подкожно в дозе 5 мл или внутривенно в дозе 5 ЕД на 100 кг массы животного. При катаральном , фибринозном, гнойном мастите, а также при флегмоне, гангрене наряду с противомикробными средствами показаны внутривенные введения 40% раствора глюкозы в дозе 400 мл , 10% раствора кальция хлорида в дозе 100-150 мл , 0,25% раствор новокаина в дозе 0,5- 1 мл на 1 кг массы животного. Если в вымени развился гангренозный процесс, то через сосок вводят 0,5 - 1% раствор калия перманганата или 3% раствор перекиси водорода или раствор Люголя в обьемах 50-80 мл в пораженную четверть. При подостром и хроническом течении мастита лечебные препараты вводят внутривыменно после тщательного сдаивания секрета пораженной четверти. Для этих целей используют антибиотические средства и комплексные препараты, содержащие антибиотики и сульфаниламиды: мастисан,мастисаны А, Б. Е, рифациклин, неотил, мастиквин в дозах, согласно наставления по применению. Перед внутривымянным применением кончик соска дезинфицируют. Вводить в вымя большие обьемы лечебных препаратов не рекомендуется. | ||||||
| Патогенетическая терапия. При патогенетической терапии используют новокаиновые блокады. -- Короткая новокаиновая блокада нервов вымени. Укол делают сзади вымени в точке пересечения линий,идущих на высоте основания вымени и проходящих на расстоянии 1-2 см от средней линии, делящей вымя на половины. После подготовки места укола иглу вводят на глубину 8-12 см в направлении запястного сустава той же стороны. В подвымянное пространство инъецируют 150-200 мл 0,5% раствора новокаина. Повторные введения через 24-48 часов. -- Внутривенное введение новокаина. Новокаин в 0,25 % концентрации вводят медленно в яремную вену из расчета 0,5-1,0 мл на 1 кг массы животного. Препарат вводится 2-3 раза через 1-2 дня. -- Применение ихглюковита. Ихглюковит вводят после дезинфекции места иньекции в прямокишечную ямку возле корня хвоста в дозе 1,0 мл на 100 кг живой массы 2-3 раза через 24-48 часов. -- Использование окситоцина. Окситоцин рекомендуется использовать по следующей методике: из пораженной четверти вымени тщательно сдаивают эксудат, а затем в яремную вену вводят 40 ЕД окситоцина и вновь тщательно сдаивают большую четверть. При этом ее массажируют от основания к соску. При необходимости лечение повторяют через 8-12 часов. -- Физические методы лечения Холод применяют только в фазе активной артериальной гипоанемии. Пораженную четверть обливают холодной водой. Применение холода не должно продолжаться более 3-4 часов Тепло назначают в фазе пассивной ( венозной,) гиперемии на 3-5 день, при ослаблении воспалительной реакции с этой целью применяют согревающие компрессы (этиловый или камфорный спирт). -- Массаж следует проводить через 3-4 дня после начала заболевания. один - два раза в день , сочетая его с втиранием мазей или линиментов. Для этого используют камфорное масло,камфорную, стрептоцидовую , салициловую, иодную, ихтиоловую, норсульфазоловую мази, хиносепт и другие., а так же линименты. При гнойном, фибринозном, воспалении , гангрене и флегмоне вымени массаж запрещен. -- Особенности лечения субклинических маститов. При лечении скрытых маститов необходимо вводить антибиотики с малым сроком выделения их с молоком. С этой целью рекомендуется внутривымянное введение водных растворов пенициллина, эритромицина в дозе 50-100 тыс. ЕД. Перед введением эритромицина его растворяют в 10 мл этилового спирта, а затем в 90 мл дистиллированной воды. Так же рекомендуются внутривымянные введения комбинированных препаратов : мастицид , мастисан ампилокс , рифациклин,.кабактан и другие. Молоко от коров, леченых антибиотиками, необходимо браковать в следующие сроки: пенициллин,стрептомицин 2-3 дней, мастисан А,Б.Е 3-4 дня. | ||||||
| ПРОФИЛАКТИКА МАСТИТОВ | ||||||
| Подготовка ферм к машинному доению . На машинное доение переводят здоровых коров, форма вымени которых отвечает соответствующим требованиям . Наиболее желательная форма вымени ваннообразная, чашеобразная с сосками средней величины 5-9 см: цилиндрической формы , расположенной под прямым углом к вымени. | ||||||
| Фермы должны быть обеспечены моющими и дезинфицирующими средствами. | ||||||
| Не реже 1 раз в месяц необходимо проводить профилактический осмотр доильных установок, молочного оборудования, исправность вакуумной системы, замена сосковой резины проводится не реже чем 6 месяцев. | ||||||
| .Перед началом доения проверяют каждый доильный аппарат на чистоту пульсаций. В. В двух тактном аппарате число пульсов должно быть 80+5 , в трехтактных аппаратах 60 + 5. Величина вакуума в вакуумпроводе должна соответствовать инструкции доильной установки. | ||||||
| Систематически должно проводиться контролирование санитарного состояния доильных установок. Особое внимание обращается на загрязнение сосковой резины, коллектора, молочного шланга, труб, молокопровода, молочных насосов, на режим мойки и дезинфекции и санитарного качества молока. | ||||||
| Осуществляется контроль за своевременным проведением на каждой молочной ферме санитарного дня не реже 1 раза в неделю. | ||||||
| Систематически контролируется выполнение санитарных правил получения молока. уделяя особое внимание предварительной обработке вымени. | ||||||
| С целью недопущения распространения маститов готовятся растворы дезосредств (0,5 %-ный раствор однохлористого иода. хлорамина, дезмола и других.). для ежедневной обработки сосков вымени коров | ||||||
| МЕРОПРИЯТИЯ ПО ДИАГНОСТИКЕ И ЛЕЧЕНИЮ МАСТИТОВ В СУХОСТОЙНЫЙ ПЕРИОД | ||||||
| ДИАГНОСТИКА | ||||||
| Запускают коров за 1,5 -2 месяца до предполагаемого отела. При этом ограничивают дачу сочных кормов и концентратов до 50% рациона. С трехкратного доения переводят на двухкратное, затем на однократное , после чего доят через день и ,прекращают доить. У коров, которые трудно запускаются, в отдельных случаях исключают из рациона полностью сочные и концентрированные корма и ограничивают водопой. | ||||||
| Диагностику мастита у запускаемых коров проводят за 7-14 дней до начала сухостойного периода (последний день запуска) ,14-15 дней после прекращения доения и за 10-14 дней до отела. | ||||||
| При исследовании секрета за 7-14 дней до запуска и последний день запуска исследования проводят на МКП-2 с беломастином. При этом учитывают только резко положительные результаты в отдельных долях вымени | ||||||
| Диагностические исследования у коров, находящихся в сухостое основываются на данных клинического осмотра, пальпации долей вымени. Если устанавливают признаки болезни, то прибегают к пробному выдаиванию и органолептической оценке секрета вымени. | ||||||
| У здоровых коров в первые 2030 дней сухостойного содержания в вымени много жидкого секрета серовато-белого цвета. без хлопьев. Во второй половине сухостойного периода секрета в вымени мало (3-5 мл) Он вязкий желто-коричневого цвета, тягучий, клейкий , однородный. При мастите имеет матовую полужидкую , водянистую консистенцию, отсутствие клейкости или густую неоднородную сметанообразную неклейкую массу с преобладанием гноя. | ||||||
| Сразу после отела мастит устанавливают по характеру молозива. После отстаивания его в пробирке образуются два слоя : верхний -- интенсивно-желтого цвета, занимающий две трети объема, нижний -- белого цвета, без каких -либо включений. При воспалении и травмах вымени молозиво приобретает розовый или красный цвет, при отстаивании на дне пробирки и под верхним слоем появляются кольца красно-малинового цвета за счет эритроцитов. При развивающемся воспалении на дне пробирки образуется бело-серый осадок или серо-желтый экссудат , не разделяющийся при отстаивании | ||||||
| Молозиво от маститных коров подвергается кипячению и уничтожается. | ||||||
| Диагностику мастита у нетелей проводят на 8-9 месяце стельности, при подозрении на заболевание проводят пробное доение. У здоровых нетелей секрет не отличается от секрета здоровых коров, находящихся во второй половине сухостойного периода. | ||||||
| ЛЕЧЕНИЕ. | ||||||
| Коровам, больным маститом, перед переводом на сухостойное содержание с лечебной целью, а также животным, переболевшим в период лактации с профилактической в пораженные четверти вымени однократно вводят мастицид-2, орбенин, аэродит, клатоклокс или другие препараты пролонгированного действия. Эффективно применение иодвисмутсульфамида на полимерной основе, путем 2-4 аппликаций с интервалом 48 часов в дозе 15 мл на долю. Через 10 дней у больных животных проводят пробное сдаивание, при необходимости препараты применяют повторно | ||||||
| При установлении мастита в начале сухостойного периода экссудат из пораженной четверти вымени сдаивают и вводят один из препаратов длительного действия. | ||||||
| При выявлении воспаления молочной железы во второй половине сухостойного периода внутривымянно назначают мастицид-2, дифурол А, один из мастисанов А,Б,Е в зависимости от чувствительности микрофлоры вымени к антибиотикам. Дозы и кратность введения согласно соответствующим наставлениям по их применению. | ||||||
| Рекомендовано использовать для лечения коров в сухостойный период препарат, состоящий из бициллина-1 (100- 200 тыс ЕД) , стрептомицина сульфата (50-100 тыс.ЕД) , норсульфазола (0,2-0,35 ) и подсолнечного масла или тривитамина АДЕ ( до 10 мл) . Препарат применяют коровам на 4-7 день после запуска. Вводят его в каждую долю вымени после предварительного сдаивания и обработки сосков 70 спиртом, при необходимости повторно вводят через 3-7 дней пенициллин внутривымянно 100 тысЕД , стрептомицин 100 ЕД на новокаине в течение 3-х дней , бициллин -3 в дозе 300 тыс ,ЕД с сульфаленом ( 0,5 -0,8 ) на вазелиновом или подсолнечном масле (5,0 мл) | ||||||
| Терапевтический эффект лекарственных препаратов определяют клиническими методами исследования и пробным сдаиванием секрета через 15-20 дней после курса лечения или после отела коровы. | ||||||
| Требования к содержанию новорожденных телят в профилактории с первого дня до 20-дневного возраста | ||||||
| Прием новорожденного теленка, дезинфекция пуповины (5%-ным раствором йода, 1%-ным раствором марганцевокислого калия, лизола и т.д.), обтирание и обсушивание его после облизывания коровой | В первые 20-30 минут после рождения | |||||
| Выпаивание молозива (5% от живого веса теленка) путем подсоса или из сосковой поилки | В течение 1-го часа после отела | |||||
| Выпаивание молозива в течение первых 7 дней при температуре 37-38оС. | Не менее 3-6 раз в сутки через равные промежутки времени | |||||
| В неблагополучных хозяйствах телятам применяют с целью профилактики: | ||||||
| -молозивный иммуноглобулин, молозивную сыворотку (сероколострин), неспецифический иммуноглобулин | В первые сутки после рождения | Сыворотку применяют внутримышечно в дозе 0,5-1.0 мл на 1 кг живой массы или внутрь по 150-200 мл | ||||
| Контроль уровня иммунного состояния организма новорожденных телят и технологии выпойки молозива | Через 24-36 часов после рождения | Содержание иммуноглобулинов в крови у новорожденных телят не менее 15 мг/мл | ||||
| Выпаивание телятам пробиотиков - ПАБК, бифидофлорина, энтеробифидина, бифидумбактерина, лактобактерина и т.д. | 2-3 раза в день начиная с 1-2 дня после рождения | По 30-50 мл (в соответствии с наставлением по применению) | ||||
| Обработка телят витаминами (А,Д,Е), микроэлементами (селен, йод, кобальт) | На 2-3 день после рождения | 2-3 раза (в соответствии с наставлением по применению) | ||||
| Обработка телят иммуностимуляторами (Т-активин, В-активин, апистимулин-А, тималин, мастим, достим и т.д.) | На 2-3 день после рождения | В соответствии с наставлением по применению | ||||
| Приучение телят к концентратам, сену и другим грубым кормам | На 10-15 день | |||||
| Обезроживание телят, переводимых для откорма на комплексы или специализированные фермы и для воспроизводства | 5-10 день | |||||
| Вакцинация против паратифа телят | При формировании групп | В соответсвии с наставлением по применению вакцины | ||||
| Микроклимат в секциях профилактория обеспечивают согласно ОНТП-1-77 | В секциях в зимний период температура воздуха должна быть +20оС, относительная влажногсть - 75%, скорость движения воздуха - 0,15 м /с, содержание углекислого газа - 0,2%, аммиака - 0,15 мг/л, воздухообмен - 20 мз/час. Для обогрева новорожденных телят в каждой секции облрудуют светильники с инфракрасными лампами, устанавливают ультрафиолетовые источники из расчета один источник на 2 клетки. | |||||
| Круглогодичное выращивание новорожденных телят осуществлять в индивидуальных домиках-профилакториях и пленочниках на открытом воздухе | Постоянно | Содержание телят в домиках при температуре окружающего воздуха не ниже 25оС | ||||
| Осуществляется контроль за состоянием обмена веществ. В комплексе мер профилактики заболеваний применяют специальные премиксы, витаминно-минеральные и минеральные добавки | 15-20 день жизни | |||||
| Мероприятия при заболеваниях телят с поражением желудочно-кишечного тракта | ||||||
| 1. | Голодная диета, замена молозива 1%-ным раствором натрия хлорида, отваром льняного семени, отваром ромашки и др. лекарственных трав. Скармливание молока (молозива) в небольших дозах (0,5-0,7 л) | В течение 8-18 часов при появлении первых признаков заболевания | ||||
| Введение лекарственных смесей внутрибрюшинно (растворы по Шарабрину, растворы по Порохову, растворы калината, ЛЕРСа, Рингера-Локка и т.д. ) | В первые часы после клинического проявления заболевания | 1 раз в день 3-4 дня подряд | ||||
| Обработка телят пробиотиками - ПАБК, бифидофлорина, энтеробифидина, бифидумбактерина, лактобактерина и т.д. | 2-3 раза в день начиная после клинического проявления заболевания | По 50-150 мл (в соответствии с наставлением по применению) | ||||
| Обработка телят иммуностимуляторами (Т-активин, В-активин, апистимулин-А, тималин, мастим, достим и т.д.) | После клинического проявления заболевания | В соответствии с наставлением по применению | ||||
| Антимикробная терапия с назначением подтитрованных антибактериальных препаратов (антибиотики, сульфаниламиды, нитрофураны и т.д.) | После клинического проявления заболевания | В соответствии с наставлением по применению | ||||
| Лечение с использованием сывороточных препаратов (поливалентной сыворотки против колибактериоза (эшерихиоза) сельскохозяйственных животных; сыворотки крови крупного рогатого для профилактики и терапии пневмоэнтеритов телят; молозивного иммуноглобулина, молозивной сыворотки (сероколострина), неспецифического иммуноглобулина; гипериммунной сыворотки против инфекционного ринотрахеита, вирусной диареи, рота- и коронавирусной инфекции, колибактериоза телят; сыворотки против сальмонеллеза (паратифа) сельскохозяйственных животных) препаратов серебра (колларгол, протаргол), спиртового раствора желчи (3 части желчи и 1 часть спирта), глюкозо-спиртового раствора (1 л физ.раствора, 100 г глюкозы и 100 г спирта, внутрь по 100 -150 мл, внутревенно по 50-100 мл), гетерогенной кровью (на 1 л крови - 5%-ного р-ра лимоннокислого натрия - 100,0, 40%-ного р-ра глюкозы - 200,0, 20%-го раствора кофеина натрия бензоата - 100,0, аскорбиновой кислоты - 25-50,0, тетравита 100,0, антибиотиков - 500,0 тыс - 1 млн ЕД; доза 1 мл на 10 кг живой массы). | После клинического проявления заболевания | В соответствии с наставлением по применению | ||||
| Для стимуляции ферментативной активности сычуга и его переваривающей способности, повышения функции поджелудочной железы заболевшим телятам необходимо применять: а) натуральный или искусственный желудочный сок внутрь; б) кутикулин внутрь; в) пепсин, трипсин, химотрипсин, панкреатин - внутрь; г) лизосубтилин Г10х - внутрь | ||||||
| Мероприятия при выращивании телят старше 20 дневного возраста на комплексах и фермах | ||||||
| Передачу телят для дальнейшего выращивания осуществляют в возрасте 20-25 дней для комплектования животноводческих комплексов, телятников на крупных фермах. | В 20-25 дневном возрасте | |||||
| Выпаивание 120 г глюкозы или сахарозы, растворенной в 1-2 л воды | ||||||
| Очистка кожного покрова, дезинфекция копыт | Перед транспортировкой | |||||
| Введение антистрессовых препаратов (транквилизаторы - аминазин, трофтазан; антибактериальных препаратов - тетрациклин, хлорамфеникрол, ветофлок, ампивет, нутрицин-сульфа, триметосул и т.д.; антибиотиков пролонгированного действия - бициллин-3 или 5, геомицин-ретард и т.д.; энергетические препараты - глюкоза, сахароза; иммуностимуляторы - адаптогены - Т-активин, апистимулин-А, бактериальные липополисахарида и т.д.) | Перед транспортировкой | В соответствии с наставлением по применению препаратов | ||||
| При поступлении на новые фермы или комплексы телята подвергаются чиске кожного покрова, мойке, дезинфекции копыт 10%-ным раствором сульфата меди, о,5%-ным раствором едкого натра или 1-2% раствором формалина, лизола или креолина | Сразу после поступления | |||||
| Аэрозольная обработка каждой партии вновь поступивших телят одним из нижеследующих препаратов: | ||||||
| -сывороткой крови крупного рогатого скота для профилактики и терапии пневмоэнтеритов с антибиотиками или препаратами серебра (0,5% -ным протарголом или 0,05% коларголом из расчета 2 мл на мз помещения ); -йодтриэтиленгликолем в дозе 500 мг/мз; -молочной кислотой в дозе 100 мг/мз; -возгонкой 2 г хлорной извести и 0,02 г скипидара на 1 мз помещения и т.д. | ||||||
| Первое кормление из расчета 50%-ной потребности, а затем в течение 1-2 дней из расчета 100% два раза в день | Через 12-24 часа | |||||
| Производственные группы формируются клинически здоровыми телятами | Разница в возрасте не должна превышать 10-15 дней, в весе 10-15 кг, вместимость секции - 50-150 голов, продолжительность заполнения - не более 2-3 дней из 2-3 хозяйств | |||||
| При комплектовании производственных групп телятами, поставляемыми из различных хозяйств-поставщиков, необходимо учитывать эпизоотическую ситуацию, сроки проведенных специфических мероприятий. | ||||||
| Перегруппировки животных производят с учетом эпизоотической обстановки, сроков вакцинации, соблюдения принципа пусто-звнято | Согласно технологии, принятой в данном хозяйстве или на комплексе | |||||
| Микроклимат помещений обеспечивыают согласно ОНТП-1-77 | В секциях в зимний период температура воздуха должна быть: для телят в возрасте 20-90 дней +15оС, 90-120 дней - +12оС, старше 4-х месяцев - +10оС; относительная влажногсть - 75%, скорость движения воздуха - 0,3-0,5 м /с, содержание углекислого газа - 0,2%, аммиака - 0,2 мг/л. В теплый период года скорость движения воздуха должна быть 0,5-0,8 м/с | |||||
| Во вновь сформированных группах телят проводят капрологические исследования на фасциолез, диктиокаулез, мониезиоз | В 30-60 дневном возрасте | |||||
| Проводят дегельминтизацию при фасциолезе, диктиокаулезе, мониезиозе | В 30-60-дневном возрасте по показаниям | |||||
| Комплекс ветеринарно-санитарных мероприятий при возникновении респираторных заболеваний у телят на фермах | ||||||
| Мероприятия для профилактики респираторных заболеваний на фермах: | ||||||
| -обработка 0,5%-ным раствором протаргола на сыворотке реконвалесцентов; -обработка иммуностимуляторами (апистимулин-А, Т-активин, тималин, тимоген, достим, АСД и др.); -обработка селенитом натрия с витамином Е (селевит, интравит и т.д.); -аэрозольные обработки животных в помещениях при приемке и постановке молочной кислотой, хлорскипидаром, однохлористым йодом | 1-й день завоза телят на комплекс | |||||
| Кормление животных: -изотонический раствор натрия хлорида (1 л) с глюкозой или сахарозой (100-120 г) внутрь; -сухое обезжиренное молоко (40-50% от дневной нормы); -концентраты (40-50% от дневной нормы); сено (дневная норма). | 1-й день завоза телят на комплекс | |||||
| -аэрозольные обработки имеющимися препаратами; Кормление - дневная норма концентратов, сухого обезжиренного молока, сена. | 2-й день завоза телят на комплекс | |||||
| -обработка 0,5%-ным раствором протаргола на сыворотке реконвалесцентов;-обработка иммуностимуляторами (апистимулин-А. Т-активин, АСД); -аэрозольные обработки имеющимися препаратами. | 4-й день завоза телят на комплекс | |||||
| -вакцинация против инфекционного ринотрахеита, вирусной диареи и парагриппа-3; -обработка селенитом натрия с витамином Е (селевит, интравит и т.д.); | 7-10-й день завоза телят на комплекс | В соответствии с наставлением по применению вакцин в зависимости от эпизоотической ситуации в хозяйстве | ||||
| -иммунизация против пастереллеза крупного рогатого скота | 14-17 день после завоза телят на комплекс | В соответствии с наставлением по применению вакцин в зависимости от эпизоотической ситуации в хозяйстве | ||||
| 7. | -иммунизация против паратифа крупного рогатого скота | 14-17 день после завоза телят на комплекс | В соответствии с наставлением по применению вакцин в зависимости от эпизоотической ситуации в хозяйстве | |||
| -иммунизация против стригущего лишая | 21-24 день после завоза телят на комплекс | В соответствии с наставлением по применению вакцин в зависимости от эпизоотической ситуации в хозяйстве | ||||
| -вакцинация против инфекционного ринотрахеита, вирусной диареи и парагриппа-3. | 28-31 день после завоза телят на комплекс | В соответствии с наставлением по применению вакцин в зависимости от эпизоотической ситуации в хозяйстве | ||||
| Терапевтические мероприятия при возникновении респираторных заболеваний на фермах и комплексах: | ||||||
| - пассивная имунизация животных (обработка сывороточными препартами - сыворотка крупного рогатого скота для профилактики и терапии пневмоэнтеритов телят, молозивный иммуноглобулин, неспецифический ПЭГ-иммуноглобулин, гипериммунная сыворотка против инфекционного ринотрахеита, вирусной диареи, парагриппа-3, аденовирусной инфекции крупного рогатого скота и т.д.) | В первые дни после появления заболевших животных | Подкожно в дозе 2 мл на 1 кг живой массы двукратно с интрвалом в 48-72 часа | ||||
| - аэрозольные обработки: а) тимолом - 0,25 г на 1 теленка 1 раз в сутки 3-5 дней подряд; б) 40%-ным раствором молочной - 1 мл на 1мз помещения 1 раз в сутки 3 дня подряд; в) хлорскипидаром -2 г хлорной извести и 0,02 г скипидлара на 1 мз помещения 1 раз в день 5-7 дней подряд; г) йодистым алюминием - 1 г кристаллического йода, 0,09 г алюминиевой пудры и 0,13 г хлористого аммония и несколько капель воды - 1 раз в сутки 4-5 дней подряд; | ||||||
| -симптоматическое лечение: отхаркивающие а) ингаляция 0,5-1% раствора гидрокарбоната натрия, 0,5% раствор аммония хлорида; б) натрия гидрокарбонат внутрь с молоком в дозе 2-2,5 г на 10 кг живой массы ежедневно в течение 8-10 дней подряд; в) листья мать-и-мачехи внутрь в виде настоя с молоком или его заменителем в дозе 20 г; г) калия йодид внутрь с молоком в дозе 2-4 г. жаропонижающие 2 раза в день до нормализации температуры а) натрия салицилат 10-15 г внутрь б) аспирин 2,0-5,0 г внутрь в) антипирин 5-10 г внутрь сердечные а) кордиамин 1-3 мл подкожно б) коффеин 2-3 мл подкожно | ||||||
| -для снятия токсикоза: а) внутривенно 30% раствор натрия тиосульфата в дозе 15-20 мл 3-4 дня подряд; б) внутривенно полиглюкин (100-200 мл), гемодез (100-200 мл 1 раз в день 3-4 дня подряд; в) внутривенно 40%-ный раствор глюкозы по 50-100 мл 1 раз в день 3-4 дня подряд; г) внутривенно 10%-ный кальция глюконат или 10%-ный кальция хлорида по 50-100 мл 1 раз в день 3-4 дня подряд | ||||||
| -антибактерильная терапия с учетом чувствительности микрофлоры: а) антибиотиками б) сульфаниламидами в) нитрофуранами | В соответсвии с наставлением по их применению | |||||
| -иммуностимулирующая терапия а) Т-активин - 1 мкг/кг живой массы 3 дня подряд, через 7-дневный перерыв 3 дня подряд; б) натрия нуклеинат - 0,8 г раз в день в течение 4-5 суток или 3-7 мг/кг массы в виде 5%-ного раствора внутримышечно; в) апистимулин-А - внутримышечно 1 мг/кг живой масы 1 раз в 3 дня 3-4 раза; г) аскорбиновая кислота - по 0,5 г два раза в день внутримышечно в виде 5%-ного раствора в комплексе с антибиотиками и сульфаниламидами; д) трипсин - по 10 мг 0,25% раствора внутримышечно 1 раз в день до 10 дней и т.д. | ||||||
| Нормализация обменных процессов организма путем введения в рацион витаминов, витаминно-минеральных, минеральных подкормок, суперконцентратов, премиксов, спецкомбикормов. | ||||||
| Диагностические мероприятия при респираторных и желудочно-кишечных заболеваниях телят | ||||||
| 1. | При возникновении в хозяйстве пневмоэнтеритов бактериальной этиологии (сальмонеллез, пастереллез, колибактериоз, псевдомоноз и т.д.) для бактериологического исследования в лабораторию необходимо направлять паренхиматозные органы, сердце, трубчатую кость, головной мозг, пораженные легкие или кишечник от телят, не подвергавшихся лечению антибактериальными препаратами | Исследования проводить в соответствии с требованиями, предъявляемыми к каждому инфекционному заболеванию | ||||
| 2. | При возникновении вирусных инфекций исследования проводятся по следующим направлениям: | |||||
| -вирусовыделение Проводится на культуре клеток или на куриных эмбрионах из органов, в которых происходит максимальное накопление возбудителей | Исследования проводить в соответствии с требованиями, предъявляемыми к каждому инфекционному заболеванию | |||||
| --выявление вирусных антигенов или вирусных частиц используется биологический материал - мазки отпечатки, гомогенат тканей, носовые и легочные истечения, фекалии | Исследования проводить в соответствии с требованиями, предъявляемыми к каждому инфекционному заболеванию | |||||
| -серологические исследования Используются парные пробы сывороток крови от животных, взятых в начале заболевания и через 14-21 день, а для экпресс-диагностики - одиночные пробы, взятые от клинически здоровых и переболевших пневмоэнтеритами телят. Пробы крови, взятые от коров свидетельствуют о циркуляции возбудителя в стаде и степени инфицированности стада; пробы крови, взятые от телят до 20-дневного возраста свидетельсвуют о состоянии колострального иммунитета и правильности технологии выпойки молозива. | Исследования проводить в соответствии с требованиями, предъявляемыми к каждому инфекционному заболеванию | |||||
| СИСТЕМА ПРОФИЛАКТИКИ ХРОНИЧЕСКИХ ИНФЕКЦИЙ | ||||||
| ЭПИЗООТИЧЕСКОЕ СОСТОЯНИЕ ПО ХРОНИЧЕСКИМ ИНФЕКЦИЯМ Животноводство агрофирмы “Ждановичский тепличный комбинат” устойчиво благополучно по бруцеллезу, туберкулезу и лейкозу. Поэтому ветеринарно-санитарные мероприятия должны быть направлены на предупреждение заноса инфекции, плановый контроль и обеспечение продажи племенных животных. | ||||||
| ПРОФИЛАКТИКА ХРОНИЧЕСКИХ ИНФЕКЦИЙ | ||||||
| В целях недопущения заноса инфекционных заболеваний ввод животных из других хозяйств, в том числе крупного рогатого скота для личного пользования гражданами, перемещение животных внутри хозяйства проводится только с ведома главного ветеринарного врача хозяйства и на основании соответствующих ветеринарных свидетельств. | ||||||
| Поступающие в хозяйство животные должны в течение 30 дней находится на карантине в изолированных помещениях. В указанный период проводится: n клиническое обследование животных (при поступлении в карантин и при его завершении); n взятие крови для исследования на бруцеллез, лейкоз, лептоспироз, (через 10-14 дней после поступления); n аллергическое исследование на туберкулез (через 10-14 дней после поступления); обследование на вибриоз, трихомоноз и при необходимости на другие инфекции и инвазии; При получении положительных результатов проводят мероприятия в соответствии с действующими инструкциями по профилактике и ликвидации указанных инфекций. | ||||||
| Карантинное отделение должно размещаться на расстоянии не менее 100 м от животноводческих и других производственных помещений, должно иметь автономную систему удаления и хранения навоза. До поступления животных и после их удаления помещение дезинфицируется горячим раствором, состоящим из 3% каустической соды и формальдегида или другим дезинфектантом, обеспечивающим равноценное действие | ||||||
| Профилактика бруцеллеза крупного рогатого скота | ||||||
| Обязательному исследованию на бруцеллез подвергают коров и телок перед осеменением или продаже на племя | ||||||
| Поголовья указанное в пункте 1 обследуют 1 раз в год с применением роз бенгал пробы. Животных, предназначенных для племпродажи отделяют от других животных и ставят на месячный профилактический карантин, в котором их однократно исследуют роз бенгал пробой. Вывод животных разрешается не позднее, чем через 30 дней после исследования и получении отрицательных результатов по всей выводимой группе. | ||||||
| В случаях аборта, преждевременных родов или появлении признаков наступающего аборта животных немедленно изолировать от общего стада и принять меры по установлению диагноза. В ветеринарную лабораторию на бактериологическое исследование направляют абортированный плод (или желудок плода), кусочки плодовых оболочек, сыворотку крови абортирующего животного. Повторно сыворотку крови доставляют в лабораторию через 15-20 дней после аборта | ||||||
| ПРОФИЛАКТИКА ТУБЕРКУЛЕЗА КРУПНОГО РОГАТОГО СКОТА | ||||||
| Профилактика туберкулеза у коров. | ||||||
| Контроль эпизоотического состояния стада осуществляют путем пла- нового двукратного аллергического обследования поголовья в течение года. Исследование проводят с применением внутрикожной пробы с туберкулином для млекопитающих в дозе 10000 МЕ. Первое плановое исследование проводят в январе или в первой половине февраля, когда не отмечается снижения резистентности животных. Исследованию подвергают всех коров, независимо от физиологического состояния. Дату введения туберкулина определяют так, чтобы в случаях вакцинации животных против инфекционных болезней интервал до введения туберкулина был не менее 3 недель. Второе плановое исследование проводят перед постановкой стада на стойловой содержание. В случаях выявления реагирующих животных, часть из них подвергают комиссионному диагностическому убою, патматериал пересылают для лабораторного исследования. Через 30-45 суток стадо, включая ранее реагировавших животных, подвергают симультанной пробе с применением туберкулина и комплексного аллергена из атипичных микобактерий (КАМ). При учете результатов определяют утолщения кожной складки в месте введения туберкулина для млекопитающих при наличии реакции пальпируют место введения КАМ, определяя интенсивность реакций на оба аллергена. При необходимости выполняют замеры кожных складок кутиметром. Оценку результатов симультанной пробы проводят в соответствии пунктами 3.2.4, 3.2.5 “Наставления по диагностике туберкулеза животных”. В случаях, если интенсивность реакций достоверно выражена на КАМ, и отсутствуют животные реагирующие с оценкой “+” и “=” стадо признают благополучным по туберкулезу и очередное исследование проводят через 6 месяцев. В случаях достоверного результата, но наличия части животных с реакциями “+” и “=” их подвергают диагностическому убою. При отсутствии макроскопических изменений и с учетом результатов бактериологического исследования стадо признают благополучным, очередное исследование проводят через 3-4 месяца. | ||||||
| Профилактика туберкулеза у молодняка крупного рогатого скота | ||||||
| Аллергическому исследованию подвергают телок, достигших возраста 1 год, а также в период 30 дней до племпродажи. Исследование проводят с применением внутрикожной пробы с туберкулином для млекопитающих в дозе 10000 МЕ. Учет реакций проводят в соответствии с “Наставлением по применению туберкулина для млекопитающих”. Для племпродажи допускают только не реагирующих на туберкулин животных из групп, в которых были получены отрицательные результаты внутрикожной пробы. Результаты исследования оформляют актом и они вносятся в ветеринарное свидетельство. В случаях единичных реакций на туберкулин, реагирующих телок сдают на убой с последующим бактериологическим исследованием патматериала. Через 30-45 суток группу, где были выявлены реагирующие особи подвергают симультанной пробе с применением туберкулина и комплексного аллергена из атипичных микобактерий (КАМ). При учете результатов определяют утолщения кожной складки в месте введения туберкулина для млекопитающих при наличии реакции пальпируют место введения КАМ, определяя интенсивность реакций на оба аллергена. При необходимости выполняют замеры кожных складок кутиметром. Оценку результатов симультанной пробы проводят в соответствии пунктами 3.2.4, 3.2.5 “Наставления по диагностике туберкулеза животных”. Необходимо иметь в виду, что здоровые телки и нетели после племпродажи и транспортировки в другие хозяйства из-за транспортного стресса, нарушения кормления, особенностей микрофлоры новой местности в период 30-дневного карантина могут давать реакции на туберкулин не связанные с заражением возбудителем туберкулеза. Поэтому, целесообразно в условия договора купли-продажи включать пункт о совместном комиссионном обследовании поголовья с применением симультанной пробы или только туберкулина для млекопитающих, но с последующей ускоренной дифференциацией в случаях появления реакций на туберкулин (методика утверждена ГУБ Минсельхозпрода Республики Беларусь 29.04.96 г). Для ее осуществления реагирующим на туберкулин животным непосредственно после учета реакции повторно вводят туберкулин для млекопитающих и КАМ в диагностических дозах. Туберкулин вводят отступив 5-10 см от развившейся реакции, КАМ симметрично, с другой стороны шеи. Реакцию учитывают через 48 часов. Животных, у которых повторно не развивается реакция на туберкулин или ее интенсивность больше выражена на КАМ считаются не реагирующими и могут эксплуатироваться в общем стаде. | ||||||
| ВЕТЕРИНАРНО-САНИТАРНЫЕ МЕРОПРИЯТИЯ ПО ПРОФИЛАКТИКЕ ТУБЕРКУЛЕЗА И НЕСПЕЦИФИЧЕСКИХ РЕАКЦИЙ НА ТУБЕРКУЛИН | ||||||
| После проведения очередных плановых исследований и удаления реагировавших на туберкулин животных в животноводческих помещениях при наличии возможности удаления животных проводят дезинфекцию с применением 3% щелочного раствора формальдегида. При невозможности удаления животных из помещения более, чем на 5-6 часов дезинфекцию проводят 3% раствором Дезавита П или 3% Инкрасептом ТБ, при использовании которых не проводится мойка и дегазация помещений. Для профилактики неспецифических реакций особое внимание обращают на очистку и дезинфекцию кормушек. В летний период поилки на пастбище еженедельно дезинфицируют 5% раствором Дезавита П или 5% раствором Инкрасепта ТБ (15 мин. с последующей промывкой водой). | ||||||
| ПРОФИЛАКТИКА ИНФИЦИРОВАНИЯ КРУПНОГО РОГАТОГО СКОТА ВОЗБУДИТЕЛЕМ ТУБЕРКУЛЕЗА ЧЕЛОВЕЧЕСКОГО ВИДА | ||||||
| В связи с ростом заболеваемости туберкулезом человека возрастает вероятность инфицирования крупного рогатого скота возбудителем туберкулеза человеческого вида. При этом, как правило, заболевание не развивается, но у животных появляются реакции на туберкулин и определенное время они потенциально опасны как источник инфекции. Для профилактики необходимо: n запретить посещение молочно-товарных ферм и помещений для выращивания молодняка посторонними лицами; n обеспечить персонал спецодеждой и раздевалками с индивидуальными шкафами; обеспечить своевременное прохождение животноводами медицинским обследованием, включая флюорографию (1 раз в год) | ||||||
| ПРОФИЛАКТИКА ЛЕЙКОЗА У КРУПНОГО РОГАТОГО СКОТА | ||||||
| Контроль за состоянием стада по лейкозу проводят путем однократного серологического исследования поголовья, начиная с 6-месячного возраста один раз в год. Отбор молодняка для племенных целей проводится только от серонегативных коров. Исследованию на лейкоз подвергают молодняк в период 30 дней перед племпродажей. Отрицательный результат исследования фиксируется в ветеринарном свидетельстве. Все ветеринарные и зоотехнические мероприятия должны проводится при строгом соблюдении правил асептики и антисептики. |
ПРИЛОЖЕНИЕ 5
Система ветеринарно-санитарных мероприятий на промышленных свиноводческих комплексах и фермах
I. Общие профилактические требования.
1. Свиноводческие хозяйства по воспроизводству и выращиванию свиней должны работать в режиме предприятий закрытого типа. Вход и выход из… 2. Формирование производственных групп осуществляют с учетом технологии… - в период осеменения и первой стадии супоросности (до 32 дней) свиноматок содержат фиксировано в индивидуальных…II. Ветеринарные требования к комплектованию промышленных комплексов.
2. Эпизоотологическое благополучие хозяйств-поставщиков оценивают за ряд лет по данным государственной ветеринарной отчетности, а также осмотром… 3. Свиньи, отобранные для комплектования свиноводческих комплексов, должны… 4. Поступающее поголовье в хозяйства подвергают 30-дневному карантированию. Содержание свиней в карантине должно…III. Диагностические исследования и лечебно-профилактические обработки свиней в период карантина.
2. На 2-3 день после завоза Отбор проб фекалий от завезенной группы свиней для … 2. Перед… 12. 1-2- раза в год Выборочное исследование на …Нормы биохимического и гематологического статуса организма свиней.
Справочное приложение № 2Оптимальные параметры микроклимата для свиней.
Справочное приложение № 3Мероприятия по диагностике и профилактике паразитарных заболеваний.
1. Кишечные нематодозы. Диагноз на кишечные нематодозы ставят на основании микроскопического исследования фекалий и посмертно при обнаружении…Оллуланоз.
Для лечения применяют: - ивомек в дозе 1 мл на 33 кг массы тела подкожно однократно; - ринтал в дозе 5-10 мг/кг массы тела с кормом групповым способом однократно (по АДВ);Смешанные паразитозы.
Для профилактики паразитозов хряков обследуют на гельминтозы и протозоозы не реже 2 раза в год и при необходимости проводят лечебные мероприятия. В… Для профилактики смешанных паразитозов свиней используют антигельминтики…Криптоспоридиоз.
Обследуют поросят с 3-4-дневного возраста, у павших поросят берут соскобы слизистой оболочки нижней части подвздошной кишки. Для лечения криптоспоридиоза применяют перорально сульфадимезин в дозе 0,05…ПРИЛОЖЕНИЕ 6
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
ПО ЭПИЗООТОЛОГИЧЕСКОМУ ОБСЛЕДОВАНИЮ
ЖИВОТНОВОДЧЕСКИХ ПРЕДПРИЯТИЙ
В основу профилактики болезней крупного рогатого скота, вызванных высо- и… Эпизоотологическое обследование – одна из самых важных сторон работы любого ветврача; его проводят как в научных, так…Заболеваемость крупного рогатого скота респираторными болезнями в ____________________________________________ за _______________ годы
Заболеваемость крупного рогатого скота желудочно-кишечными болезнями в _________________________________________________ за _______________ годы
Данные о падеже крупного рогатого скота в________________________________________________ за _______________ годы
Данные о вынужденном убое крупного рогатого скота в________________________________________________ за _______________ годы
Данные о непроизводительном выбытии крупного рогатого скота в________________________________________________ за _______________ годы
Данные о непроизводительном выбытии телят от респираторных болезней _________________________________ за _______ годы
Годы Получено телят (гол.) Всего заболело телят (голов) Пало и вынужденно убито телят по причине…Данные о непроизводительном выбытии телят от желудочно-кишечных болезней _________________________________ за _______ годы
Годы Получено телят (гол.) Всего заболело телят (голов) Пало и вынужденно убито телят по причине …Данные о заболеваемости коров маститом в __________________________________________________________ за ________ годы
Данные о заболеваемости коров с поражениями репродуктивных органов ______________________________________________ за _______________ годы
Приложение 2.
Схема эпизоотологического обследования
Сельскохозяйственного предприятия
УТВЕРЖДАЮ
Главный ветеринарный
Врач района
______________________
«_____»_______________
Общая и ветеринарно-санитарная характеристика
Животноводческого предприятия
1.2. Область, район, населенный пункт __________________________________________ 1.3. Направление предприятия и его основная производственная специализация.… 1.4. Поголовье _______________________________________________________________Характеристика эпизоотической обстановки на предприятии
… 2.2. Регистрация данной болезни в прошлом (дата, месяц, год)… 2.3. Время последнего случая проявления болезни и краткая характеристика первых клинических признаков…Проведение противоэпизоотических и профилактических мероприятий
Способы и дата установления диагноза __________________________________________ 3.2. Диагноз подтвержден ветеринарной лабораторией (название лаборатории,… 3.3. Характеристика выделенного возбудителя (по данным лаборатории) ____________Заключение (к разделам 2 и 3 схемы)
4.1. Источником возбудителя послужили:
- завезенные животные из ____________________________________________________,
-обслуживающий персонал _________________________________________________
4.2. Эффективность проведенных мероприятий по оздоровлению предприятия ______
4.3. Рекомендуемые дополнительные противоэпизоотические и профилактические мероприятия, направленные на ускорение оздоровления предприятия ____________
____________________________________________________________________________
____________________________________________________________________________
Примечания: ___________________________________________________________
___________________________________________________________________________
____________________________________________________________________________
Подписи