Гидролиз солей слабых кислот и сильных оснований
Если соль образована слабой кислотой и сильным основанием, то реакцию гидролиза можно схематически изобразить так:
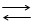 М+ + А - + Н2О НА + М+ + ОН-. (4)
М+ + А - + Н2О НА + М+ + ОН-. (4)
Связывания иона гидроксония Н+ анионами слабой кислоты А - приводит нарушению равновесия реакции диссоциации воды
 Н2О Н+ + ОН-
Н2О Н+ + ОН-
И появлению избыточной концентрации ОН-. При этом Сн+ < Cон - и раствор имеет щелочную реакцию. Константа гидролиза реакции (4)
| Кг= | СНА * Сон- | = | СНА * Сон- | (5) |
| СМ+ * СА- | СА- |
Слабая кислота НА, получающаяся при гидролизе, диссоциирует, хотя и в малой степени, на ионы:
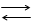
НА Н+ + А - (6)
В противном случае гидролиз шел бы до конца - вся соль превращалась бы в НА и МОН. Выразив константу диссоциации слабой кислоты - константу равновесия реакции (6) - следующим образом:
| К кисл. = | СН. СА- |
| СНА |
Можно определить через нее отношение
| СНА | = | Сн+ | (7) |
| СА | К кисл. |
Подставив (7) в (5), получим
| Кг= | Сн+ * Сон- | = | Кw | (8) |
| К кисл. | К кисл. |
Константа гидролиза равна отношению ионного произведения воды к константе диссоциации слабой кислоты. 
Найдем степень гидролиза соли. Концентрация негидролизованной соли равна СМА (1 - a)  . Негидролизованная соль в разбавленном растворе полностью диссоциирована на ионы и поэтому ее концентрация равна концентрации аниона
. Негидролизованная соль в разбавленном растворе полностью диссоциирована на ионы и поэтому ее концентрация равна концентрации аниона
СМА - = СМА (1 - a). (9)
При гидролизе образуются эквивалентные количества молекул НА и ионов ОН-. Так как мы рассматриваем соль слабой кислоты, то НА диссоциированна в малой степени. Если пренебречь диссоциацией НА, то можно сказать что, Сон - = СНА. Молекула НА образуется из молекулы соли при гидролизе. Если гидролизовано СМА*a молей, то
Сон - = СНА= СМА*a. (10)
Подставив выражения (9) и (10) в уравнение (5), получим
| Кг= | С2МА*a2 | = | СМА*a2 | (11) |
| С МА* (1-a) | 1-a |
Откуда
СМА*a2 + Кг * a - Кг = 0 и
 a= -
a= - 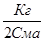 +
+ 
Второй корень уравнения не имеет физического символа, так как a не может быть меньше нуля.
Если степень гидролиза мала (a << 1), то 1-a » 1 и выражение (11) упрощается
Кг » С МА *a2; a » 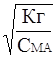 (12)
(12)
Из выражения (12) видно, что увеличение концентрации соли СМА приводит к уменьшению степени гидролиза. Разбавление раствора увеличивает степень гидролиза.
Подставив в уравнение (12) значения Кг из выражения (8), получим
a »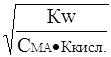 . (13)
. (13)
Сравнение степени гидролиза растворов двух солей одинаковой концентрации дает
a1 »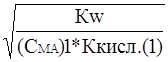 ; a2»
; a2» ; и
; и
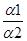 =
= , (14)
, (14)
так как (С МА) 1 = (С МА) 2
Степень гидролиза обратно пропорциональна корню квадратному из константы диссоциации слабой кислоты.
Используя выражение (10), можно записать
Сон+ * Сон - = Кw; Сон+ =  =
= 
Подставив сюда  из выражения (13), получим
из выражения (13), получим
Сн+=  =
= 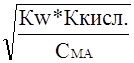 ;
;
После логарифмирования и перемены знаков
lg Сн+ = - ½ lg Кw - ½ lg Ккисл. + ½ lg Сма.
Но - lg Сн + = рН; подобные же обозначения можно употребить и для логарифмов констант равновесия.
Тогда
рН= ½ рКw + ½ рКкисл. + ½ lgСМА. (15)
Из выражения (15) видно, что рН растворов солей слабых кислот и сильных оснований растет с уменьшением константы диссоциации слабой кислоты и с ростом общей концентрации соли. Другими словами, щелочность раствора растет с уменьшением Ккисл. И с ростом СМА.