Гидролиз солей сильных кислот и слабых оснований
Реакцию гидролиза соли, образованной сильной кислотой и слабым основанием, схематически можно изобразить так:
 М+ + А - + Н2О МОН + Н+ +А - , (16) и константа гидролиза
М+ + А - + Н2О МОН + Н+ +А - , (16) и константа гидролиза
Кг =  . (17)
. (17)
Раствор имеет кислую реакцию (Сн+>Сон-). Одним из продуктов гидролиза является слабое основание. Диссоциация слабого основания препятствует протеканию гидролиза до конца
 МОН М+ + ОН - ;
МОН М+ + ОН - ;
К осн. = 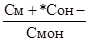 ,
,
Откуда  . (18)
. (18)
Подставив выражение (18) в (17), получим
Кг =  .
.
Подобно выводу выражения (12), при гидролизе соли, образованной слабым основанием и сильной кислотой
a »  . (19)
. (19)
Как и в первом случае, увеличение концентрации соли в воде приводит к уменьшению степени гидролиза a. Разбавление раствора увеличивает степень гидролиза. Подставив в уравнение (19) значение Кг, получим
a » 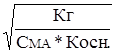 . (20)
. (20)
Степень гидролиза соли обратно пропорциональна корню квадратному из константы диссоциации слабого основания. Рассматривая гидролиз соли слабого основания и сильной кислоты, получим выражение, аналогичное уравнению (15)
РН = ½ рКw - ½рКосн. - ½ lgСМА. (21)
Из выражения (21) видно, что рН уменьшается с уменьшением Косн. и с увеличением Сма, или кислотность раствора возрастает с уменьшением константы диссоциации слабого основания и с ростом общей концентрации соли.