рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Охрана труда
- /
- Гидролиз солей многоосновных кислот и оснований
Реферат Курсовая Конспект
Гидролиз солей многоосновных кислот и оснований
Гидролиз солей многоосновных кислот и оснований - раздел Охрана труда, Характеристики гидролиза Рассмотрим Теперь Гидролиз Солей, Образованных Слабой Многоос...
Рассмотрим теперь гидролиз солей, образованных слабой многоосновной кислотой или слабым основанием многовалентного металла. Гидролиз таких солей протекает ступенчато. Так, первая ступень гидролиза карбоната натрия протекает согласно уравнению
Nа2СО
Nа2СО3 + Н2О  NаНСО3 + NаОН, или в ионно-молекулярной форме:
NаНСО3 + NаОН, или в ионно-молекулярной форме:
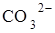
 + Н2О
+ Н2О  НСО3 - + ОН-.
НСО3 - + ОН-.
Образовавшаяся кислая соль в свою очередь подвергается гидролизу (вторая ступень гидролиза)
NаНСО3 + Н2О  Nа2СО3 + NаОН, Или НСО3 - + Н2О
Nа2СО3 + NаОН, Или НСО3 - + Н2О  Nа2СО3 + ОН-.
Nа2СО3 + ОН-.
Как видно, при гидролизе по первой ступени образуется ион НСО3-, диссоциация которого характеризуется второй константой диссоциации угольной кислоты
НСО3- Н+ +
Н+ +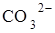 ;
;
К2, кисл. = 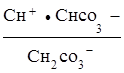
При гидролизе по второй ступени образуется угольная кислота, диссоциацию которой характеризует первая константа ее диссоциации
НСО3 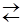 Н+ +Н
Н+ +Н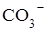 ;
;
К1, кисл. = 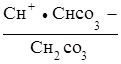 .
.
Поэтому константа гидролиза по первой ступени
Кг,1= 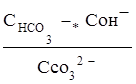
связана со второй константой диссоциации кислоты, в константа гидролиза по второй ступени
Кг,2= 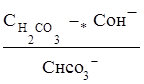
с первой константой диссоциации кислоты. Эта связь выражается соотношениями:
Кг,1= 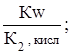 Кг,2=
Кг,2= 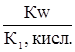 .
.
Поскольку первая константа диссоциации кислоты всегда больше второй, то константа гидролиза по первой ступени всегда больше, чем константа гидролиза по второй ступени: Кг,1> Кг,2. По этой причине гидролиз по первой ступени всегда протекает в большей степени, чем по второй. Кроме того, ионы, образующиеся при гидролизе по первой ступени (в нашем примере - ионы ОН -), способствуют смещению равновесия второй ступени влево, т.е. также подавляют гидролиз по второй ступени.
Аналогично происходит гидролиз солей, образованных слабым основанием многовалентного металла. Например, гидролиз CuCl2, который по первой ступени протекает с образованием гидроксохлорида меди
CuCl2 + Н2О 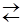 CuОНCl +НСl или в ионно-молекулярной форме
CuОНCl +НСl или в ионно-молекулярной форме
Cu2+ + Н2О 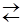 CuОН+ + Н+.
CuОН+ + Н+.
Гидролиз по второй ступени происходит в ничтожно малой степени:
CuОНCl+ + Н2О 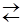 Cu (ОН) 2 + НСl Или CuОН+ + Н2О
Cu (ОН) 2 + НСl Или CuОН+ + Н2О 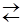 Cu (ОН) 2 + Н.
Cu (ОН) 2 + Н.
Примером гидролиза солей многоосновных слабых кислот и слабых оснований может служить гидролиз ацетата алюминия, протекающий до основных солей - гидроксоацетата дигидроксоацетата алюминия:
Аl (СН3СОО) 3+ Н2О 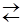 Аl (ОН) (СН3СОО) 2+ СН3СООН;
Аl (ОН) (СН3СОО) 2+ СН3СООН;
Аl (ОН) (СН3СОО) 2 + Н2О 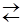 Аl (ОН) 2 (СН3СОО) + СН3СООН.
Аl (ОН) 2 (СН3СОО) + СН3СООН.
Рассмотрим для данного случая отдельно гидролиз катиона и гидролиз аниона. Эти процессы выражаются ионно-молекулярными уравнениями:
Аl3++ Н2О 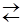 АlОН2 +Н+; СН3СОО - + Н2О
АlОН2 +Н+; СН3СОО - + Н2О 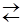 СН3СООН +ОН - .
СН3СООН +ОН - .
Итак, при гидролизе катиона образуются ионы Н+, а при гидролизе аниона - ионы ОН-. Эти ионы не могут в значительных концентрациях сосуществовать; они соединяются, образуя молекулы воды. Это приводит к смещению равновесия вправо. Иначе говоря, гидролиз катиона и гидролиз аниона в этом случае усиливают друг друга. Если кислота и основание, образующие соль, не только слабые электролиты, но и мало растворимы, или неустойчивы и разлагаются с образованием летучих продуктов, то гидролиз соли часто протекает необратимо, т.е. сопровождается полным разложением соли. Так, при взаимодействии в растворе соли алюминия, например АlCl3, с карбонатом натрия выпадает осадок гидроксида алюминия и выделяется диоксид углерода
2АlCl3 + 3 Nа2СО3+ 3Н2О 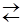 2Аl (ОН) 3¯ + 3СО2 +6 NаCl или
2Аl (ОН) 3¯ + 3СО2 +6 NаCl или
2Аl3++ 3СО32-+3Н2О 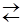 2Аl (ОН) 3¯+ 3СО2.
2Аl (ОН) 3¯+ 3СО2.
Протонная теория кислот и оснований рассматривает гидролиз солей как частный случай кислотно-основного равновесия.
– Конец работы –
Эта тема принадлежит разделу:
Характеристики гидролиза
Введение... Гидролиз солей...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Гидролиз солей многоосновных кислот и оснований
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов