ДИАГРАММЫ ФАЗОВОГО РАВНОВЕСИЯ ДВОЙНЫХ СИСТЕМ
(ДИАГРАММЫ СОСТОЯНИЯ)
Диаграммы фазового равновесия (диаграммы состояния) - это графическое изображение фазового состава сплава в условиях равновесия в зависимости от температуры и химического состава сплава.
ФАЗОВОЕ РАВНОВЕСИЕ
 |  | ||
 |  |
| Закономерности существования фаз в состоянии равновесия определяет правило фаз Гиббса С = К – Ф + 1 (Р = const). С – число степеней свободы (число внешних (Т0) и внутренних (состав) факторов, которые можно изменять, не меняя фазового равновесия); К – число компонентов; Ф – число фаз; при К = 2, Ф = 3→С = 0 – нонва-риантное равновесие; Ф = 2→С = 1 моновариантное Ф = 1→С = 2 равновесие |
Условие равновесия – минимум свободной энергии Гиббса
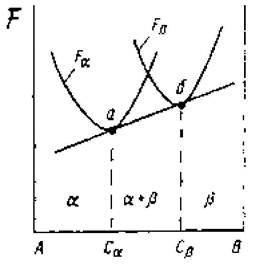
Сα, Сβ - составы равновесных фаз
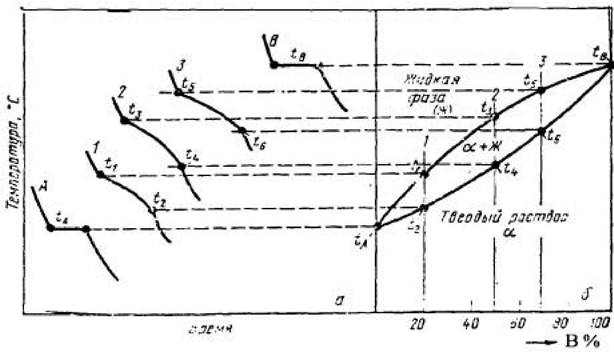
Диаграммы состояния строят экспериментально по кривым охлаждения сплавов. На кривых охлаждения определяют критичес кие то ч к и – те м пе р а -туры перегиба или площадки на кривой, связанные с те пл о в ым эффектом фазового превращения. По ним определяют температуру превращения.
ТИПЫ ДИАГРАММ СОСТОЯНИЯ







 Компоненты н еограни-ченно растворяются как в жидком, так и в твердом состоянии.
Компоненты н еограни-ченно растворяются как в жидком, так и в твердом состоянии.

| А11В1 ла |
линия Т нача-крис тал лиз ации сплавов - ликвидус. А22В, - линия Тиконца кристаллизации сплавов - солидус. В структуре любого сплава этой системы - утвердый раствор компонентов А и В друг в друге.

Схема микроструктуры /твердого раствора
Компоненты ограниченно растворимы друг в друге в твердом состоянии и кристаллизуются с образованием эвтектики.
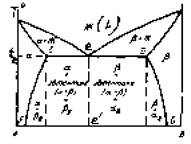
а - ограниченный твердый раствор В в А. Предельная растворимость изменяется по линии СF.
р- ограниченный твердый раствор А в В. Предельная растворимость изменяется по линии DG.
При температуре tе и
концентрации е обра
зуется эвтектика -
смесь кристаллов двух
фаз, одновременно кри
сталлизующихся из
жидкости по эвтек
тической реакции.

|
| Схема структуры эвтектического сплава |
Ье-^ас+рД.
| Компоненты зуют друг |
обра-с другом химическое соединение АmBn.
АmBn – устойчивое химическое соединение, образующееся при химическом составе сплава, который отвечает то ч к е
Д7.
а- ограниченный
твердый раствор
В(А).
р- ограниченный
твердый раствор
А(В).
у- ограниченный твердый раствор на базе решетки химического соединения АщВп.
ДИАГРАММЫ СОСТОЯНИЯ


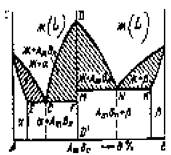
 В данной системе структура формируется в результате перитектической реакции -выделившиеся из жидкости кристаллы араствора взаимодействуют с жидкой фазой, образуя новую |3фазу.
В данной системе структура формируется в результате перитектической реакции -выделившиеся из жидкости кристаллы араствора взаимодействуют с жидкой фазой, образуя новую |3фазу.
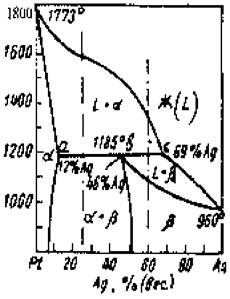
При температуре 11850С происходит перитектиче-ская реакция
11 85 С
Lc + аа------------- > рь
а - твердый раствор на базе решетки Pt;
р- твердый раствор на базе решетки Ag.
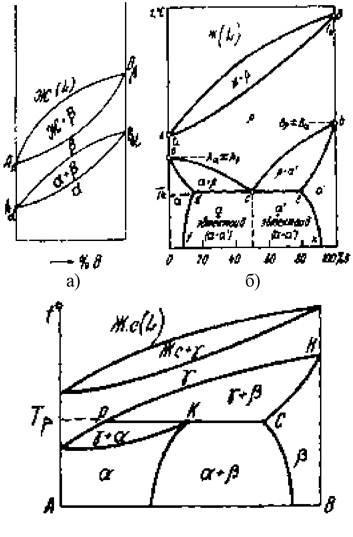 Компоненты имеют полиморфное превращение – изменение типа кристаллической решетки при определенной температуре. Полиморфное превращение вызывает фазовые превращения в тв е р д о м состоянии.
Компоненты имеют полиморфное превращение – изменение типа кристаллической решетки при определенной температуре. Полиморфное превращение вызывает фазовые превращения в тв е р д о м состоянии.
М$ще&тр$ций 8, %
в)
а) полиморфное превращение
А* оА т ; Ва оВр;
| Т |
| А |
б) эвтекоидное - распад Ртве рдого раствора
->ad + а е.
в) перитектоидное
| Гр+Рс |
т
>ак
 JДИАГРАММЫ СОСТОЯНИЯ И СВОЙСТВА СПЛАВОВ
JДИАГРАММЫ СОСТОЯНИЯ И СВОЙСТВА СПЛАВОВ
 |  |
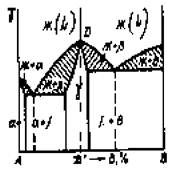
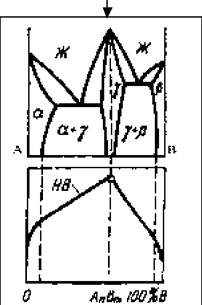 Свойства сплавов зависят от их состава с максимум или минимум при составе сплава 50 % А и 50 % В.
Свойства сплавов зависят от их состава с максимум или минимум при составе сплава 50 % А и 50 % В.
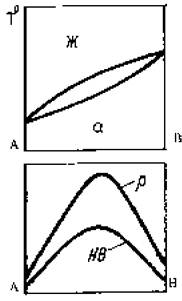
Свойства меняются в зависимости от состава по кривой линии в области тв е р д ых растворов и по линейному закону в двухфазной области.
Свойства сплавов характеризуются наличием максимума при составе сплава, образующего химическое с оединение.

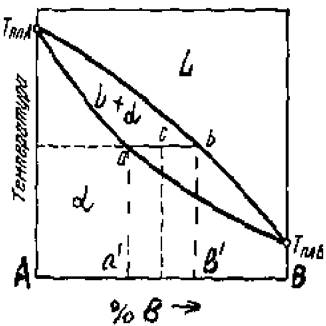
 Химический состав фаз любого сплава системы можно определить с помощью каноды, а их количество – по правилу рычага.
Химический состав фаз любого сплава системы можно определить с помощью каноды, а их количество – по правилу рычага.
|
Пр а в ил о рычага с – то ч к а сплава; acd – канода;
b/ - состав жидкой фазы, L; a/ - состав тв е р д о й фазы, α; QL – ac/ad⋅100% - количество жидкости, %; Qα = cd/ab⋅100 % - количество α фазы, %.
ВОПРОСЫ И ЗАДАЧИ ПО ТЕМЕ
1. Что представляют из себя диаграммы состояния, почему их называют равновесными?
2. Что так о е компонент сплава?
3. Что та к о е кривая охлаждения; критичес кая то ч к а , что она показывает?
4. Что так о е эвтектика, при каких условиях она образуется?
5. Что та к о е перитектическое превращение?
6. Какие линии диаграммы носят название ликвидус и солидус, линии предельной растворимости?
7. Как повлияет на тв е р д о с ть сплава появление в его структуре химического соединения?
8. Что так о е эвтектоид, каковы условия его образования?
9. Что так о е полиморфное превращение, как оно представлено на диаграммах состояния?
10. Как зависит изменение свойств сплавов от типа диаграмм состояния?
ЗАДАЧИ
Задача № 1
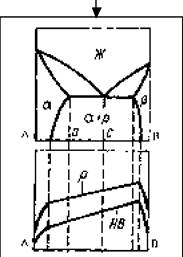
На рис. 5 представлена диаграмма состояния двух компонентов, кристаллизующихся с образованием эвтектики. Расставить фазы и определить структуру сплавов при Т0ком. Зарисовать структуру сплавов при Т0ком. (сплавы 20 % В, 50 % В, 80 % В).
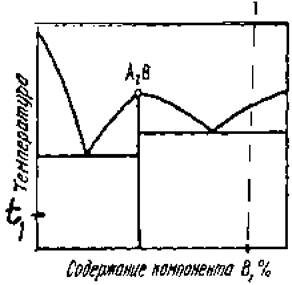
Рис.5 Задача № 2
Для сплава 1 (рис. 5) по дс читать количество фаз и структурных составляющих при температуре tе.
Задача № 3
Определите фазы в сплавах, строение которых показано на рис. 6.

|
1ТСКТИ]Рис. 6
Задача № 4
Как изменится химический состав фаз в процессе кристаллизации сплава 1 (рис. 7)?
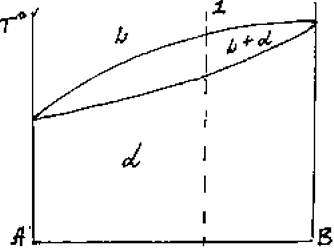
|
Задача № 5
Рис. 7
Постройте кривую охлаждения сплава 1 (рис. 7) и проверьте ее по правилу фаз Гиббса. Объясните полученные значения числа степеней свободы на разных этапах охлаждения.