Электродиализ
Этот метод – вариант ионного обмена. Но в нём ионитный слой заменён специальными ионообменными мембранами, а движущая сила – внешнее электрическое поле.
При наложении постоянного электрического поля на раствор в последнем возникает движение ионов растворённых солей, а также Н+ и ОН-. При достижении катода катионы, а также молекулы воды восстанавливаются, например:
2H2O + 2e → H2 ↑ +2OH-,
2H+ + 2e → H2 ↑ .
На аноде происходит окисление анионов:
4OH- - 4e → 2H2O + O2 ↑ ,
2Cl- - 2e → Cl2 ↑ .
Если в электродную ячейку поместить ионообменные мембраны: катионообменную, пропускающую только катионы, – со стороны катода, а со стороны анода – анионообменную, пропускающую только анионы, то объём ячейки разделится на три камеры (рисунок 12.2). В этом случае в катодную камеру из средней могут проходить лишь катионы, мигрирующие к катоду, а в анодную – анионы, мигрирующие к аноду. Значит, концентрация ионов в средней (второй по счёту, чётной) камере будет уменьшаться, в приэлектродных камерах – увеличиваться.
Если электродную ячейку разделить на множество камер, то половина из них будет обессоливаться (чётные камеры), другая (нечётные камеры) – наоборот, насыщаться. Значит, очищенной от солей является вода (сточная вода) из чётных камер электродиализатора.
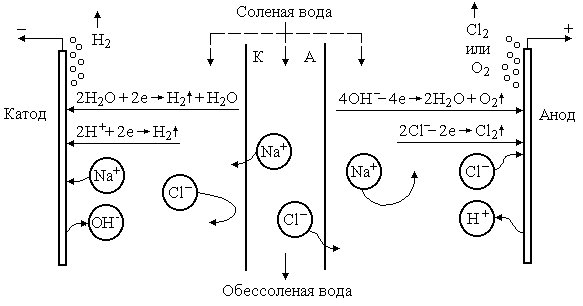
Рис. 12.2. Упрощенная принципиальная схема электродиализатора
Мембраны для аппаратов производят в виде гибких листов прямоугольной формы или рулонов полимерного связующего с порошком ионообменных смол. Наиболее эффективное использование электродиали-заторов – при концентрации солей в сточной воде 3...8 г/л.