рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Политика
- /
- Потенциометр R – в крайнем левом положении! Тумблер «Свет» выключен!
Реферат Курсовая Конспект
Потенциометр R – в крайнем левом положении! Тумблер «Свет» выключен!
Потенциометр R – в крайнем левом положении! Тумблер «Свет» выключен! - раздел Политика, ГОУВПО Воронежский государственный технический 1. Включить Установку Тумблером «Сеть». 2. С Помощью Потенцио...
1. Включить установку тумблером «Сеть».
2. С помощью потенциометра R установить минимальное напряжение на ФЭ.
3. Установить лампочку на максимальном расстоянии от фотоэлемента. Включить питание лампочки тумблером «Свет». Увеличивая напряжение на ФЭ через 5 – 10 В, записать значения фототока I (показания микроамперметра), соответствующие каждому напряжению.
4. Уменьшая расстояние между фотоэлементом и лампой, провести те же измерения для 5 – 6 расстояний (по пункту 3).
5. Заполнить табл. 2.2 физических величин и постоянных, используемых в работе.
Таблица 2.2
| h, Дж×с | e, Кл | Р, Вт | А×103, Вт/лм | Ic, кд | S×104, см2 | n, Гц |
6. По экспериментальным результатам построить вольт - амперные характеристики (ВАХ). По ВАХ определить участки тока насыщения.
7. По формуле (2.10) рассчитать световой поток Ф и освещенность Е фотоэлемента.
8. По формуле (2.11) определить чувствительность фотоэлемента g для каждой освещенности.
9. По формуле (2.12) оценить квантовый выход фотоэффекта a для различных освещенностей.
10. По результатам проведенных исследований сформулировать первый закон фотоэффекта, подтвердив его графически. Результаты всех измерений и расчетов представить в виде табл. 2.3
Таблица 2.3
| r, см | U, В | I, мкА | Ф, лм | Е, лк | g, мкА/лм | a | Da |
| 1) | 1)… 2)… ... 10) | ||||||
| 2) | |||||||
| 3) | |||||||
| 4) | |||||||
| 5) |
2.3.3. Теоретический минимум
Фотоэлектрический эффект. Внешний, внутренний и вентильный фотоэффекты. Законы внешнего фотоэффекта. Квантовая гипотеза Планка. Квантовая теория фотоэффекта. Формула Эйнштейна. Экспериментальное подтверждение квантовых свойств света. Многофотонный фотоэффект. Фотоэлементы и их устройство. Характеристики фотоэлементов. Применение фотоэлементов.
3. Атом водорода
3.1. Теоретическое введение
(к лабораторной работе 3.05)
Потенциальная энергия взаимодействия электрона с ядром атома водорода определяется выражением
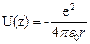 , (3.1)
, (3.1)
где r - расстояние между электроном и ядром, е - элементарный заряд.
Графически функция U(z) изображается кривой, представляющей собой подобие гиперболической "потенциальной ямы" (рис.3.1). Уравнение Шредингера имеет в данном случае вид
 , (3.2)
, (3.2)
где mе — масса электрона.
Рассмотрим основные результаты, вытекающие из решенияданного уравнения.
Прежде всего, отметим, что решение уравнения (2) приводит к появлению дискретных значений энергии электрона в атоме водорода, т.е.
 (3.3)
(3.3)
где n=1,2,3...- главное квантовое число.
Самый нижний энергетический уровень Ε1 называется основным, все остальные - возбужденными. По мере роста n энергетические уровни располагаются теснее (рис.3.1) и при n→ ∞ Ε=0. При Е>0 движение электрона является свободным. Соответственно энергия, необходимая для ионизации атома водорода, равна Ei=E1=13,55 эВ.
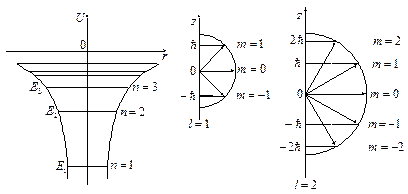 Рис.3.1 Рис.3.2
Рис.3.1 Рис.3.2
Квантование энергии электрона в атоме водорода вытекает непосредственно из решения уравнения Шредингера и не требует введения никаких постулатов, как в теории Бора.
Другим важнейшим результатом, вытекающим из решения уравнения (3.2), является квантование момента импульса (орбитального механического момента) по формуле
 , (3.4)
, (3.4)
где l=0, 1, 2, ..., (n-1) - орбитальное квантовое число. При этом, проекция вектора момента L импульса на направление внешнего магнитного поля, также принимает квантованные значения
 , (3.5)
, (3.5)
где m=0, ±1, ±2,..., ±l - магнитное квантовое число, принимает (2l+1) значений.
Дискретность в ориентации вектора L получила название пространственного квантования момента импульса. Для наглядности пространственное квантование обычно представляют графически на векторных диаграммах (рис.3.2).
Из диаграмм видно, что вектор орбитального момента импульса электрона для атома водорода может иметь (2l+1) направлений в пространстве, каждое из которых определяется соответствующим значением угла α из формулы
 , (3.6)
, (3.6)
m=0,±l,±2, ...,±1.
Собственные функции трехмерного уравнения Шредингера содержат три целочисленных параметра Ψ(r,θ,φ)=Ψn,l,m·
Каждому Еn (кроме Εl) соответствует несколько волновых функций, отличающихся значениями квантовых чисел l и m. Это означает, что атом водорода может иметь одно и то же значение энергии, находясь в нескольких различных состояниях, отличающихся величиной и ориентацией момента импульса электрона.
Состояния с одинаковой энергией называются вырожденными, а число различных состояний с каким-либо значением энергии называется кратностью вырождения соответствующего энергетического уровня. Очевидно, что число различных состояний, соответствующих данному n, равно
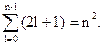 (3.7)
(3.7)
В атомной физике применяют следующие условные обозначения состояний электрона:
l=0 - s-состояние;
l =1 - р-состояние;
l=2 - d-состояние;
l =3 - f-состояние
и далее в порядке следования букв латинского алфавита. Значение главного квантового числа указывается перед условным обозначением числа l. Таким образом, электрон в состоянии с n=2 и l=1 обозначается символом 2р и т.д.
В квантовой механике нельзя говорить о траектории движения электрона в атоме, а смысл имеет лишь вероятность местонахождения электрона в той или иной области пространства. Плотность вероятности местонахождения электрона дается квадратом модуля его волновой функции. Электрон при своем движении как бы "размазан" по всему объему, образуя электронное облако, плотность которого характеризует вероятность нахождения электрона в различных точках объема атома. Форму электронного облака определяет орбитальное квантовое число l, а его ориентацию в пространстве - магнитное квантовое число.
Спектр атома водорода является линейчатым. Спектральные линии объединяются в группы или, как их называют, серии. Спектральную линию с наибольшей длиной волны среди других линий этой серии называют головной линией. Линию, около которой сгущаются другие линии серии, называют коротковолновой границей.
В видимой области спектра атома водорода находится серия Бальмера, длины волн которой удовлетворяют соотношению
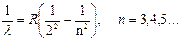 (3.8)
(3.8)
В ультрафиолетовой части спектра находится серия Лаймана
 (3.9)
(3.9)
В инфракрасной области спектра лежат серии Пашена, Брекета, Пфунда
 (3.10)
(3.10)
 (3.11)
(3.11)
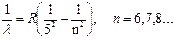 (3.12)
(3.12)
Здесь R=l, 0973732∙107 м-1 - эмпирическая постоянная, называемая постоянной Ридберга.
Все представленные серии можно описать общей формулой, получившей название обобщенной формулы Бальмера.
 (3.13)
(3.13)
или
 (3.14)
(3.14)
где m имеет постоянное для каждой серии значение (m=1, 2, 3, 4, 5...), а n приобретает ряд целых значений, начинающихся с m+1.R' = c∙R = 3,2931193·1015∙с-1 также называется постоянной Ридберга.
Спектральные закономерности атома водорода получают свое простое объяснение на основе энергетической схемы, отражающей частичное вырождение уровней (рис. 3).
Испускание и поглощение света происходит при переходе электрона с одного энергетического уровня на другой. На основании правила частот Бора получим
 (3.15)
(3.15)

Рис.3.3
Подставив в данную формулу выражение (3) для Е, найдем
 (3.16)
(3.16)
где  - совпадает с экспериментальным значением постоянной Ридберга.
- совпадает с экспериментальным значением постоянной Ридберга.
В квантовой механике доказывается, что возможны только такие переходы с одного энергетического уровня на другой, при которых изменение орбитального и магнитного квантовых чисел удовлетворяет условиям
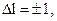 (3.17)
(3.17)
 (3.18)
(3.18)
Эти условия получили название правил отбора.
Существование этих правил является следствием закона сохранения момента импульса. Фотон, обладающий собственным моментом импульса, может уносить из атома этот момент, или наоборот, привносить его в атом. Переходы, разрешенные правилом отбора, показаны на схеме (рис. 3). Пользуясь условными обозначениями состояний электрона переходы, приводящие к возникновению серии Лаймана, можно записать в виде
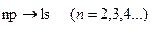 . (3.19)
. (3.19)
Серии Бальмера будут отвечать следующие переходы
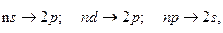
где n=3, 4, 5 ...
3.2. Лабораторная работа 3.05. Изучение спектра атома водорода
Цель работы: изучение спектра водорода; определение постоянной Ридберга и радиуса первой орбиты электрона в атоме водорода.
Принадлежности: универсальный монохроматор, водородная лампа.
3.2.1.Описание установки и методики измерений
Изучение спектра водорода производится на универсальном монохроматоре. Оптическая схема монохроматора, действующего в качестве спектроскопа, представлена на рис.3.4, где 1 – источник света, 2 – входная щель, 3 – объектив коллиматора, 4 – диспергирующая призма, 5 – объектив зрительной трубы, 6 – выходная щель, 8 – окуляр 10´, 7 – указатель (“мушка”) в фокальной плоскости зрительной трубы.
Выходная труба монохроматора помещена под углом 90° к падающему пучку света. Поворачивая призменный столик на различные углы относительно падающего света, получаем в выходной щели свет различной длины волн, проходящий через призму в минимуме отклонения.

Рис.3.4
 Рис.3.5
Рис.3.5
Для определения длины волны спектральной линии проводят градуировку спектроскопа по известному спектру (например, паров ртути). Градуировочный график спектроскопа (рис.3.5) выражает зависимость между длиной волны l входящего светового пучка и делениями барабана n.
Спектральная трубка помещается в прибор для зажигания спектральных трубок (ПЗСТ). ПЗСТ представляет собой трансформатор, дающий на вторичной обмотке напряжение 1,5 кВ. (При работе следует соблюдать правила электробезопасности!)Этот прибор состоит из корпуса и кожуха с откидной планкой, имеющей щель для исследования спектров светящихся газов. Питание ПЗСТ осуществляется от внешнего источника постоянного тока с напряжением 8-10 В. Зажигание трубки происходит при включении источника питания ПЗСТ.
3.2.2. Порядок выполнения работы
1. Установить входную щель монохроматора 0,2 мм.
2. Включить подсветку окуляра монохроматора.
3. Зарядить спектральную трубку в ПЗСТ. Для чего откинуть планку прибора и установить трубку, соблюдая направление, указанное стрелками. При этом острый выступ на колбе развернуть в сторону кожуха.
4. Установить кожух с водородной лампой против входной щели монохроматора.
5. Включить источник питания водородной трубки в сеть. Получить газовый разряд.
6. Плавно вращая барабан, определить деления соответствующие линиям Ha, Hb, Hg, Hd серии Бальмера, устанавливая спектральные линии против указателя окуляра монохроматора.
7. Определить по градуировочному графику (рис.3.5) значения соответствующих длин волн l1, l2, l3, l4 .
8. Вычислить для каждого значения длины волны l постоянную Ридберга по формулам:
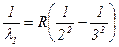 (3.20)
(3.20)
 (3.21)
(3.21)
Рассчитать среднее значение постоянной Ридберга и сравнить с табличным значением.
9. Вычислить радиус первой боровской орбиты электрона в атоме водорода по формуле (Z=1, n=1):
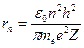 (3.23)
(3.23)
10. Заменить водородную трубку в ПЗСТ на гелиевую. Пронаблюдать спектр гелия. Определить длины волн спектральных линий гелия (п.п. 3-7).
3.2.3. Теоретический минимум
Модель атома водорода по Бору. Постулаты Бора. Атом водорода в квантовой механике. Квантовые числа и их физический смысл. Энергетические уровни атома водорода и их вырождение. Пространственное квантование. Спектр атома водорода. Обобщенная формула Бальмера. Постоянная Ридберга.
бИБЛИОГРФИЧЕСКИЙ СПИСОК
1. Детлаф А.А. Курс физики / А.А. Детлаф, Б.М. Яворский. – М.: Высш. шк. 1989.
2. Савельев И.В. Общий курс физики / И.В. Савельев. – М.: Высш. шк. 1972. Т.3.
3. Трофимова Т.И. Курс физики / Т.И. Трофимова. – М.: Высш. шк. – 1990.
4. Евграфова Н.Н. Руководство к лабораторным работам по физике: учеб. пособие для радиотехн. и электроприборостроит. специальностей вузов / Н.Н. Евграфова, Каган В.Л. - М.: Высш. шк. – 1970.
5. Лабораторные занятия по физике / Гольдин Л.Л., Игошин Ф.Ф., Козел С.М., и др.; под ред. Гольдина Л.Л. – М.: Наука, Главная редакция физико-математической литературы, 1983.
– Конец работы –
Эта тема принадлежит разделу:
ГОУВПО Воронежский государственный технический
университет... Учебно лабораторный центр кафедр общей физики...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Потенциометр R – в крайнем левом положении! Тумблер «Свет» выключен!
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов