Молекулярный уровень организации вещества
Атомы, за исключением благородных газов, не существуют в свободном состоянии при стандартных условиях. За стандартные условия принимается атмосферное давление, равное 1,013×105 Па, и температура 298 К. Силы электромагнитного взаимодействия между атомами приводят к образованию более устойчивых микросистем–молекул. Молекула–это микросистема, состоящая из двух или большего числа ядер и электронов, движущихся в поле ядер. Атомы сближаются, прежде всего, отрицательно заряженными электронными орбиталями (рис.12, а). Такое сближение должно было вызывать отталкивание атомов, но наблюдается обратная картина.

|








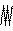
|






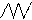 ж)
ж)
Рис. 12. Модель взаимодействия атомов водорода и образования молекулы водорода
Связано это с тем, что происходит согласованное движение электронов. Электронная плотность в атомах изменяется так, что всякий раз преобладает притяжение, а не отталкивание заряженных частей атомов (рис.12, б, в). Центры тяжести положительно (ядро) и отрицательно (электронная орбиталь) заряженных частей атома располагаются несимметрично. Такие атомы водорода-диполи-взаимно ориентируются и притягиваются противоположно заряженными частями. Силы притяжения (Fпр) разноименно заряженных и силы отталкивания Fот одноименно заряженных частей атомов возрастают по мере их сближения. В состоянии (г) Fпр > Fот. В состоянии (е) Fпр < Fот. Состояния (рис. 12, г) и (рис 12, е) соответствуют возбужденной молекуле водорода. Равенство Fпр = Fот соответствует устойчивому состоянию (рис. 12, д). Нарастание сил притяжения-отталкивания изображено увеличивающимися в размерах символами Fпр и Fот.
В результате колебательных движений ядра могут сблизиться на расстояние, меньшее длины химической связи. Тогда силы отталкивания вернут систему в устойчивое состояние. Потенциальная яма (рис.12ж) соответствует устойчивому состоянию молекулы с наименьшей энергией. Образование химической связи сопровождается выделением энергии, равной энергии химической связи. «Выбраться» из потенциальной ямы молекула способна только в результате соударения с микрочастицами окружающей среды. В результате такого соударения разрывается химическая связь, происходит диссоциация молекулы на атомы. Энергия, необходимая для разрыва химической связи, называется энергией связи.
Молекулы «наследуют» свойства атомов, и для них (как и для атомов) типичными являются следующие свойства:
обмениваться энергией;
обмениваться веществом (отдавать и присоединять электроны);
изменять геометрическую конфигурацию;
вступать в химические реакции.
Обмен энергией в результате соударений с микрочастицами (атомами, молекулами, фотонами, электронами и др.) приводит к изменению интенсивности различных видов движения молекулы, её электронного состояния. Некоторые виды движения представлены на модели двухатомной молекулы, изображенной в виде шариков, связанных пружинкой (рис.13). Фраза, утверждающая, что «молекула состоит из атомов», может быть использована для обозначения ядер, входящих в состав молекулы. Молекула-не сумма атомов. С позиций квантовой механики молекула представляет собой систему, качественное и количественное состояние которой определяется совместным движением ядер и электронов, занимающих определенное положение в пространстве.
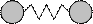 |  | ||||
 | |||||
а)
 | |||||||
 | |||||||
 | |||||||
 | |||||||
б) в)
Рис.13. Модели двухатомной молекулы: а) поступательное движение, б) вращательное движение, в) колебательное движение
Молекула способна переходить в состояние заряженной микросистемы, когда в результате соударений с другими частицами она отдает или присоединяет электрон. Эти процессы используются, например, в масс-спектрометрах. Изменение геометрической конфигурации молекул связано с перестройкой её структуры без изменения элементного состава. Например, внутримолекулярная перегруппировка:



 СН3 СН3 нагревание СН3 СН3
СН3 СН3 нагревание СН3 СН3














 СН3 Si O O Si СН3 СН3 O Si O Si СН3
СН3 Si O O Si СН3 СН3 O Si O Si СН3
СН3 СН3 СН3 СН3
Химические превращения связаны с разрывом и образованием связей, в результате которых изменяются энергетическое состояние, состав и структура молекул. Любые химические превращения происходят на уровне атомов и молекул. В зависимости от условий проведения реакции (внешней среды) ковалентные связи в молекулах разрываются гомолитически или гетеролитически. Гомолитический разрыв приводит к распариванию электронов, участвующих в образовании химической связи. Так, например, разрывается химическая связь в газообразном хлороводороде:
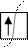 | |||||
 |  | ||||


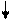 Н Cl Н + Cl
Н Cl Н + Cl
или
 HCl(газ) ×H(газ) + ×Cl(газ)
HCl(газ) ×H(газ) + ×Cl(газ)
свободные радикалы
Растворение газообразного хлороводорода в воде (другое состояние среды) приводит к гетеролитическому разрыву химических связей в молекулах. Электронная пара, обозначенная стрелками, переходит к атому хлора:
 | |||||
 |  | ||||
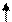


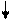 Н Cl Н+ + Cl-
Н Cl Н+ + Cl-
или
 HCl(газ) Н+(раствор) + ×Cl- (раствор)
HCl(газ) Н+(раствор) + ×Cl- (раствор)
гидратированные ионы