МИР МАКРОСИСТЕМ
Макросистемы-это твердые, жидкие, газообразные вещества, состоящие из множества взаимосвязанных атомов, молекул или ионов. Газ при высоких температурах переходит в ионизированное состояние–плазму-четвертое состояние вещества. Электромагнитные взаимодействия определяют физико-химические свойства макросистем и их устойчивость. По типу химических связей или межмолекулярных взаимодействий твердые тела делятся на ковалентные, ионные, молекулярные и металлические кристаллические вещества (рис.14).

Рис.14. Модели ковалентной (а), ионной (б), молекулярной (в) и
металлической (г) кристаллических решеток
(в металлической решетке черными точками обозначены электроны-«электронный газ»)
Все кристаллические и аморфные вещества проявляют общее для них свойство-твердость. Этим свойством они отличаются от жидкостей и газов. В кристаллах есть строгий порядок расположения микрочастиц, которого нет ни в жидкостях, ни в газах. Кристаллы с ковалентными химическими связями представляют собой многоатомные образования. Кристалл алмаза или кварца–это не что иное как полимерная молекула с ковалентными химическими связями, которую можно не только увидеть, но и подержать в руке. Ионные кристаллы содержат в узлах кристаллической решетки положительно и отрицательно заряженные ионы. Силы притяжения разноименно заряженных ионов уравновешены силами отталкивания одноименно заряженных ионов.Такие кристаллические решетки характерны, например, для силикатных материалов, поваренной соли. Молекулярные кристаллы содержат в узлах кристаллической решетки молекулы-диполи, например, молекулы воды в кристаллической решетке льда. Они удерживаются силами межмолекулярного взаимодействия. Межмолекулярные взаимодействия существенно слабее ионных. Поэтому такие кристаллы-менее прочные образования. Кристалл металла следует рассматривать как гигантскую молекулу, в которой электроны, участвующие в образовании металлической связи, свободно перемещаются по всему объему. Такие электроны называют «электронным газом». Электронный газ удерживает положительно заряженные ионы в узлах кристаллической решетки металла.
Вещества с ковалентной, ионной и молекулярной кристаллическими решетками-твердые и хрупкие. При ничтожном сдвиге слоев кристалла происходит раскалывание по линии сдвига. Так происходит раскалывание кристалла с ковалентными химическими связями (рис.15).

Рис.15. Модель раскалывания ковалентной кристаллической решетки
Сдвиг слоев в ионном и молекулярном кристаллах также приводит к раскалыванию кристалла (рис.16). Существовавшее до сдвига равновесие сил притяжения и отталкивания нарушается при сдвиге. Возрастают силы отталкивания по сравнению с притяжением в силу того, что совпадают одноименные заряды на поверхностях слоев.
В металле при сдвиге или ударе раскалывания и разделения слоев не происходит (рис.17). Электроны в металле «успевают» за перемещением ионов в слоях и удерживают их в новом положении. Становится понятным, почему металлы в подавляющем большинстве случаев являются ковкими и пластичными материалами.

Рис.16. Модель раскалывания ионной (а) и молекулярной (б)
кристаллических решеток
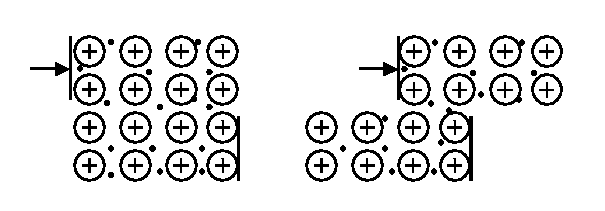
Рис.17. Модель сдвига слоев металла без разрушения кристаллической решетки
Аморфное состояние твердого вещества означает отсутствие упорядоченного расположения микрочастиц.
Жидкости отличаются от твердых тел тем, что их молекулы свободно перемещаются в занимаемом жидкостью объеме. Это происходит при плавлении твердого вещества с молекулярной кристаллической решеткой, а также металла или кристалла с ионной кристаллической решеткой. Ионы в жидком веществе беспорядочно перемещаются в занимаемом ими объеме.
Газы в отличие от жидкостей занимают весь предоставленный им объем. Это связано с тем, что в газах практически отсутствует взаимодействие между молекулами.