ПРЕВРАЩЕНИЕ ЭНЕРГИИ. ЗАКОНЫ ТЕРМОДИНАМИКИ
Энергияесть качественная и количественная характеристика движения и взаимодействия. В общем случае полная энергия системы включает кинетическую энергию движения системы, потенциальную энергию, обусловленную положением системы во внешнем поле, и внутреннюю энергию U, обусловленную движением и взаимодействием микрочастиц, составляющих систему. Обмен энергией между системой и окружающей средой осуществляется в форме теплоты Q и работы А. Теплота и работа являются формами обмена энергией. Если процесс обмена энергией отсутствует, работа и теплота равны нулю. Энергия системы не зависит от пути перехода системы из одного состояния в другое. Поэтому она является функцией состояния системы. Работа и теплота зависят от пути процесса.
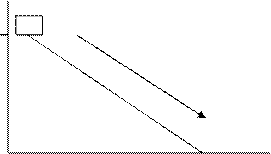
Рассмотрим пример, показывающий зависимость работы и теплоты от пути перехода системы из начального в конечное состояние (рис.27). Тело массы m, расположенное на некоторой высоте h, обладает потенциальной энергией mgh. При вертикальном падении тела (случай а) потенциальная энергия превращается в работу А деформации поверхности. В этом случае теплота Q=0. То же количество потенциальной энергии может быть использовано так, что часть энергии будет израсходована на совершение работы деформации поверхности, а часть–на трение (случай б). В сумме А и Q равны количеству потенциальной энергии тела. Возможен вариант, когда потенциальная энергия полностью расходуется на трение, тогда А=0 (случай в). Приведенный пример опирается на закон сохранения энергии: энергия не возникает из ничего и не исчезает бесследно: она лишь превращается из одного вида в другой. Чтобы установить закон сохранения энергии, наука прошла долгий путь.
 |  |  | |||
 | |||||||||
 | |||||||||
 |  |  | |||||||
а) б) в)
Рис. 27. Модель превращения потенциальной энергии тела в работу (а), в работу и теплоту при трении (б), в теплоту (в)
Становление и развитие термодинамики как науки начинается с работ французского физика и инженера Сади Карно (1796-1832). Свои изыскания Карно обобщил в книге «Размышления о движущей силе огня», изданной в 1824 г. В основе его рассуждений лежала общепринятая тогда концепция теплорода. Теплота представлялась как некая не имеющая массы жидкость–теплород. Карно считал, что действие паровой машины аналогично действию водяной мельницы. Теплород «течет» от нагревателя и на пути движения вращает колесо паровой машины подобно тому, как вода вращает мельничное колесо. Такая модель-аналогия позволила ему считать, что количество теплорода сохраняется в процессе совершения работы, как сохраняется количество воды, вращающей мельничное колесо. Теплород лишь «перетекает» из одного тела в другое.
Паровая машина или любой другой двигатель, работающий циклически, – это устройство, преобразующее теплоту в работу, если под работой подразумевать любой процесс, эквивалентный подъему груза. Любая машина, преобразующая теплоту в работу, должна действовать циклически. Так, например, работает двигатель автомобиля, неизвестный во времена Карно. Поршни в цилиндрах двигателя все время возвращаются в исходное состояние, чтобы отобрать очередную порцию топлива для сжигания и преобразования энергии химической реакции в работу движущегося автомобиля. Основываясь на циклическом действии машины, получающей теплоту от нагревателя и преобразующей её в работу, Карно доказал, что процессу преобразования теплоты в работу присуща некая «внутренняя неэффективность». Часть теплоты нагревателя машина превращает в работу, а часть вынуждена отдавать холодильнику, чтобы вернуться в исходное состояние для использования следующей порции теплоты нагревателя. Карно определил пределы превращения теплоты в работу. Иными словами, для любой машины, действующей циклически, существует максимальный коэффициент полезного действия.
Труды Карно не были преданы забвению благодаря исследованиям французского физика и инженера Э. Клапейрона (1799-1864), который уточнил детали цикла, совершаемые машиной, работающей по циклу Карно, и дал его полное математическое описание. Коэффициент полезного действия h не зависит от рабочего тела машины (водяной пар или какое-то другое вещество). Он определяется температурой нагревателя Т1, передающего теплоту Q1, и температурой холодильника Т2, получающего теплоту Q2 от машины:
h = (Т1-Т2)/Т1
Несмотря на несостоятельность концепции теплорода, идея Карно о невозможности превращения всей теплоты в работу оказалась плодотворной. Хотя всю теплоту нельзя полностью превратить в работу, превращение работы в теплоту не имеет ограничений. Как точно замечено в книге П. Эткинса «Порядок и беспорядок в природе» [25, с. 30], «природа не облагает «налогом» преобразование работы в теплоту; например, за счет трения мы можем полностью разбазарить с таким трудом полученную работу (в буквальном смысле слова «протереть» её). Однако с теплотой так поступить мы уже не сможем: в отличие от работы она облагается «налогом».
Немецкий врач Ю. Майер (1814-1878) и английский физик Дж. Джоуль (1818-1889) провели эксперименты и доказали, что работу (механическое движение) можно преобразовать в теплоту (рис.28). Примечательно, что Майер пришел к выводу о превращении теплоты в работу, будучи судовым врачом. Во время путешествия на Яву он обратил внимание на то, что венозная кровь южан имеет более светлую окраску, чем кровь северян в Германии. Он правильно объяснил эти наблюдения: в венах обитателей тропиков остается больше кислорода, т.к. для поддержания постоянной температуры тела в теплых краях необходимо сжигать меньшее количество пищи. Следовательно, теплота может расходоваться на поддержание постоянной температуры тела и на выполнение мускульной работы. Теплота и работа являются двумя разными формами обмена энергией системы и окружающей среды.
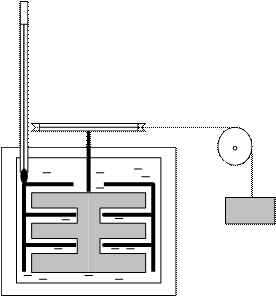 |
Рис.28. Схема прибора для преобразования работы
падающего тела в теплоту за счет трения о воду вращающихся лопаток
Джоуль также обратил внимание на возможность превращения механической работы в теплоту. Он получил значение механического эквивалента превращения работы в теплоту, отличающееся от общепринятого в настоящее время значения всего на 1%. Тело массой m кг, падающее с высоты h м при ускорении силы тяжести g=9,806 м×с-2, совершает работу
А=mgh [кг×м2×с-2] или [Дж].
Механический эквивалент теплоты равен 0,4267. Это значит, что тело массой 1 кг, падая с высоты h=0,4267 м, совершает работу, вращая лопасти мешалки, эквивалентную 1 кал теплоты:
1 кг×9,806 м×с-2×0,4267 м = 4,184 Дж = 1 кал,
или
4,184 Дж работы эквивалентно 1кал теплоты.
Ни Майер, опубликовавший свою работу в 1842 г., ни Джоуль, представивший доклад на съезде Британской ассоциации развития науки в
1843 г., не встретили понимания ученых того времени. Лишь через много лет ученые убедились, что теплота и работа эквивалентны. И на это были причины. Вспомним утверждение Карно о том, что количество теплорода сохраняется в процессе совершения работы. Майер и Джоуль лишили теплоту статуса сохраняющейся величины: теплоту можно преобразовать в работу. Это означало, что теплорода не существует и следует менять свои представления о теплоте. Окончательно отказался от концепции теплорода немецкий физик
Р. Клаузиус (1822-1888). Он сформулировал в 1850 г. первый закон термодинамики: теплота и работа являются различными формами энергии. В любом процессе энергия может переходить из одной формы в другую (в том числе в теплоту или работу), но она не создается из ничего и не исчезает бесследно. О первом законе термодинамики иногда говорят, как о частном случае закона сохранения энергии. «Частность» первого закона лишь в том, что термодинамика рассматривает две формы передачи энергии в теплоту и работу. Клаузиус пытался объяснить природу теплоты на основе поведения частиц, из которых состоит вещество. Судьба распорядилась так, что это сделал австрийский физик Людвиг Больцман (1844-1906). Он показал существование связи между свойствами вещества как целого, изучаемого с помощью термодинамики, и поведением отдельных частиц (атомов и молекул), составляющих вещество.
С позиций термодинамики не имеет значения строение и состав системы. Система выступает как целое, обладающее энергией и способное обмениваться энергией. Только после работ американского физика Д. Гиббса (1839-1903) область применения термодинамики расширилась и захватила химию и биологию.
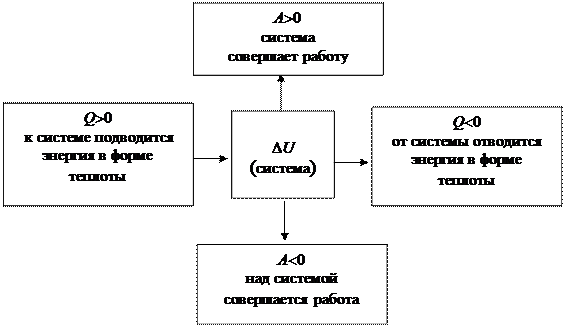 |
В соответствии с формулировкой первого закона термодинамики теплота, работа и внутренняя энергия связаны уравнением
Q = DU + A
Математическое уравнение первого закона термодинамики записано в соответствии с указанными на схеме знаками.
Теплота Qесть форма обмена энергией посредством хаотического соударения микрочастиц системы и окружающей среды. Теплота относится к процессу, а не к состоянию. Если нет процесса, то Q=0.
Работа Аесть форма обмена энергией путем направленного движения частиц. Например, газ в цилиндре под поршнем способен совершать работу по подъему груза, расположенного на поршне. Происходит направленное перемещение молекул газа. Работа также является характеристикой процесса. Если нет процесса, то А=0.
Внутренняя энергияU определяет состояние системы. В любых состояниях система обладает большим или меньшим количеством внутренней энергии. Система есть совокупность взаимосвязанных частей (атомов и молекул), выделенных из окружающей среды и выступающих по отношению к ней как целое. Система, находящаяся в относительном состоянии покоя, обладает внутренней энергией U. Внутренняя энергия системы слагается из кинетической (движения частиц) и потенциальной (притяжения и отталкивания частиц) энергии.
Первый закон термодинамики не определяет направление процессов обмена энергией системы и среды. Второй закон термодинамики указывает на существование в природе фундаментальной асимметрии, однонаправленности всех происходящих в ней самопроизвольных процессов: невозможно сконструировать машину, которая, действуя посредством кругового процесса, будет только переносить теплоту с более холодного тела на более теплое (Р. Клаузиус, 1850 г.). Это означает, что теплота не может самопроизвольно переходить от менее нагретого тела к более нагретому. Независимо от Клаузиуса в 1851 г. У. Томсон (лорд Кельвин) сформулировал второй закон термодинамики в следующем виде: в природе невозможен процесс, единственным результатом которого была бы механическая работа, совершенная за счет охлаждения теплового резервуара. Применяя второй закон к Вселенной как целому, Кельвин пришел в 1852 г. к выводу о неизбежности «тепловой смерти» Вселенной. Тепловая смерть - результат выравнивания температур и установление термодинамического равновесия.
Клаузиус развил свои термодинамические идеи и в 1865 г. ввел новое понятие-функцию состояния-энтропию, обозначенную символом S. Энтропия буквально означает «превращение в». (от греч. en «в» и tropia-«превращение»). Имелась в виду тенденция превращения энергии в менее ценные формы, т.е. рассеяние энергии. Для изолированной системы изменение энтропии служит критерием направления самопроизвольно протекающего процесса или состояния термодинамического равновесия:
DS³0
Значение DS представляет собой разность энтропий конечного (S2) и начального (S1) состояний системы. Если DS=0, это означает, что система находится в состоянии термодинамического равновесия. В ней не происходит никаких изменений (S2 = S1). Если энтропия возрастает, т.е. DS>0, в системе самопроизвольно происходит необратимый процесс перехода из состояния S1 в состояние S2 (S2 > S1). В случае, когда система обменивается энергией с окружающей средой теплотой Q при температуре Т (неизолированная система), изменение энтропии связано с теплотой и температурой соотношением
DS³Q/Т
Рассмотрим изменение состояния изолированной системы, состоящей из теплого (температура Т1) и холодного (температура Т2) тел (рис 29). Убедимся, что в изолированной системе передача энергии от теплого к холодному телу сопровождается возрастанием энтропии системы. Пусть теплое тело передает незначительное количество теплоты Q (Q<0, т.к. для тела процесс экзотермический), настолько малое, что температура тела практически не изменяется. Соответственно холодное тело получает теплоту Q (Q>0, т.к. для тела процесс эндотермический). Для холодного тела температура также практически не изменяется. Запишем уравнения, выражающие изменения энтропии теплого и холодного тел:
DS1 = Q/Т1; DS2 = Q/Т2
Q


|
|
Рис. 29. Модель изолированной системы, состоящей из нагревателя при температуре Т1 и холодильника при температуре Т2
Изменение энтропии системы DSсист = DS1 + DS2
или
DSсист = Q/Т1 + Q/Т2
Так как для теплого тела Q<0, а для холодного тела Q>0, то при неравенстве температур Т1>Т2 получаем
DSсист = Q/Т1 + Q/Т2 > 0
Клаузиус и Кельвин сумели установить законы природы. Во-первых, полное количество энергии в любом процессе должно сохраняться в соответствии с первым законом термодинамики, во-вторых, распределение имеющейся энергии осуществляется необратимым образом; естественное направление указывает второй закон термодинамики. Он выражает тенденцию всех процессов, протекающих в изолированных системах, идти самопроизвольно в направлении рассеивания энергии или, другими словами, в направлении увеличения беспорядка (рис. 30).
Потенциальная энергия падающего мяча превращается в энергию движения микрочастиц поверхности пола (рис. 30, а). Обратный процесс перемещения мяча из состояния 2 в состояние 1 невозможен. Мяч самопроизвольно не вернется в исходное состояние, т.к. частицы, расположенные на поверхности пола, рассеяли полученную энергию по всем частицам пола. Газ, оказавшийся в первое мгновение в левой части сосуда, самопроизвольно займет весь объем сосуда (рис. 30, б). Происходит увеличение беспорядочного перемещения молекул по всему объему, что эквивалентно рассеиванию энергии по всему объему, т.к. носителями энергии являются молекулы газа.

 1
1
 | |||||
 | |||||
 | |||||
 2
2

а)











 1 2
1 2
 |
б)
Рис. 30. Модель рассеяния энергии (увеличения беспорядка): а) мяч в изолированной системе; б) газ в замкнутом объеме. 1- начальное, 2 - конечное состояние системы.
Примечание. Стрелками указано направление самопроизвольного (необратимого)
процесса
Третий закон термодинамики (Планк, 1911 г.) касается свойств систем при низких температурах. Планк высказал утверждение, имеющее статус третьего закона термодинамики: энтропия правильно сформированного кристалла чистого вещества при абсолютном нуле равна нулю, т.е. S = 0 при Т = 0. Естественно, что при очень низких температурах все вещества становятся твердыми. Согласно экспериментальным данным, теплоемкость (С) твердых тел не только стремится к нулю при Т, стремящейся к нулю, но и убывает значительно быстрее, чем убывает температура. Последнее обстоятельство означает, что невозможно отобрать тепло у тела при понижении температуры посредством конечного числа шагов. Следовательно, абсолютный нуль температуры недостижим. В этих условиях по мере приближения к абсолютному нулю энтропия любой равновесной системы перестает зависеть от каких-либо термодинамических параметров, принимая для всех веществ одно и то же значение S = 0. Если бы абсолютный нуль температуры был достижим, то в соответствии с циклом Карно, который лежит в основе второго закона термодинамики, можно было бы всю теплоту превратить в работу.
h = А/Q1 = T1 - T2/Т1
если T2 = 0, то
h = T1 - 0/Т1 = 1;
h = А/Q1= 1;
отсюда следует, что Q1 = А
Как не без сарказма заметил Эткинс [25, с 51]:
«Первый закон: теплоту можно превратить в работу.
Второй закон: полностью это возможно лишь при абсолютном нуле температур.
Третий закон. Однако абсолютный нуль недостижим».