Швидкість та механізм хімічних реакцій. Вплив різних факторів на швидкість реакції. ЗДМ
Швидкість хімічної реакції визначається зміною концентрації однієї з реагуючих речовин за одиницю часу за незмінному об’єму системи.
Якщо в момент часу  концентрація реагуючої речовини відповідала
концентрація реагуючої речовини відповідала  моль/л, а в наступний момент часу
моль/л, а в наступний момент часу 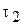 виявилася відповідною
виявилася відповідною 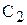 моль/л, то співвідношення
моль/л, то співвідношення

виражає середню швидкість реакції 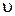 за проміжок часу:
за проміжок часу:
 (с).
(с).
Чим менше проміжок часу  і відповідний йому спад концентрації
і відповідний йому спад концентрації 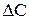 , тим ближче відношення
, тим ближче відношення 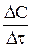 до дійсної швидкості реакції у відповідний момент часу
до дійсної швидкості реакції у відповідний момент часу 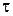 .
.
Швидкість кожної реакції залежить від природи реагуючих речовин, від їх концентрації та від умов, в яких реакція перебігає (температура, тиск, присутність каталізаторів).
Дуже важливе положення було встановлено в 1867 р. двома вченими Гульдбергом і Вааге та одержало назву закон діючих мас (ЗДМ): швидкість хімічної реакції за сталої температури пропорційна добутку концентрацій реагуючих речовин, зведених у степені їхніх стехіометричних коефіцієнтів.
Так, для гомогенної реакції типу:
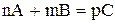
швидкість становить:
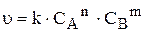 ,
,
де k — константа швидкості,
 і
і 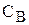 — концентрації реагуючих речовин у певний момент часу.
— концентрації реагуючих речовин у певний момент часу.
У гетерогенних реакціях концентрації речовин, що перебувають у твердому стані, практично не змінюються протягом реакції і тому не включаються в рівняння закону діючих мас. Наприклад, для реакції:
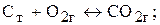
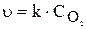 чи
чи 
де 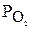 — парціальний тиск кисню.
— парціальний тиск кисню.
Залежність швидкості реакції (або константи швидкості реакції) від температури визначається правилом Вант-Гоффа: із підвищенням температури на кожні 10 С швидкість більшості реакцій зростає в 2‑4 рази.
Ця залежність виражається співвідношенням:
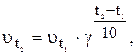
де 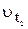 ‑ швидкість реакції після підвищення температури до
‑ швидкість реакції після підвищення температури до 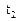 ;
;
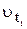 ‑ початкова швидкість реакції за температури
‑ початкова швидкість реакції за температури 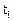 ;
;
g ‑ температурний коефіцієнт швидкості реакції, який показує, у скільки збільшується швидкість реакції із підвищенням температури реагуючих речовин на 10 градусів.
Правило Вант-Гоффа приблизне й застосовується лише для орієнтовної оцінки впливу температури на швидкість реакцій. Точніше залежність константи швидкості від температури виражається рівнянням Арреніуса:
 ,
,
де B ‑ коефіцієнт пропорційності;
Еакт ‑ енергія активації, кДж;
R ‑ газова постійна (8,31 кДж/(моль×К));
Т = (t+273°) ‑ абсолютна температура, К.
Чим нижче енергія активації Еакт і вище температура, тим більше константа швидкості.