Хімічна рівновага
Хімічні реакції можна поділити на оборотні і необоротні.
Реакції, які відбуваються в одному напрямку і завершуються повним перетворенням вихідних реагуючих речовин у кінцеві речовини, називаються необоротними. Прикладом такої реакції може бути розклад калій хлорату (бертолетової солі) під час нагрівання:
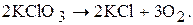
Реакція припиниться тоді, коли весь калій хлорат перетвориться на калій хлорид і кисень. Необоротних реакцій не так багато. Більшість реакцій оборотні. Оборотними називаються такі реакції, які одночасно відбуваються у двох взаємно протилежних напрямках.
Ці реакції не доходять до кінця внаслідок того, що продукти реакції взаємодіють між собою, утворюючи знову вихідні речовини. Оборотні реакції завершуються встановленням хімічної рівноваги.
Хімічна рівновага — це такий стан системи, коли швидкість прямої реакції дорівнює швидкості зворотної реакції.
У стані рівноваги пряма і зворотна реакції не припиняються. Тому така рівновага називається рухомою, або динамічною, рівновагою. А оскільки дія обох реакцій взаємно знищується, то в реагуючій суміші видимих змін не відбувається: концентрації всіх реагуючих речовин — як вихідних, так і тих, що утворюються, — залишаються чітко сталими. Концентрації реагуючих речовин, які встановлюються в умовах хімічної рівноваги, називаються рівноважними.
За певних умов реакції перебігають в одному напрямку до повного зникнення вихідних речовин. Такі реакції є практично необоротними. До них відносяться реакції, що супроводжуються виділенням:
продуктів, які виходять зі сфери реакції у вигляді осаду, газу;
малодисоційованих сполук;
великої кількості енергії.
У випадку оборотної хімічної реакції:
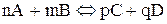
швидкість прямої та зворотної реакцій за законом діючих мас виражається відповідно рівняннями:
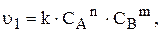

Оскільки з часом концентрація  і
і 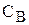 зменшується, а
зменшується, а 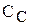 і
і  збільшується, швидкість прямої реакції
збільшується, швидкість прямої реакції 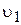 зменшується, а зворотної
зменшується, а зворотної 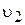 — збільшується.
— збільшується.
Із встановленням хімічної рівноваги швидкості прямої і зворотної реакції стають однаковими  . Концентрації речовин А, B, С і D у момент рівноваги називаються рівноважними концентраціями. Їх позначають символами [A], [B], [C] і [D]. У зв’язку з цим умови рівноваги
. Концентрації речовин А, B, С і D у момент рівноваги називаються рівноважними концентраціями. Їх позначають символами [A], [B], [C] і [D]. У зв’язку з цим умови рівноваги  можна виразити наступною рівністю:
можна виразити наступною рівністю:

звідки: 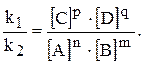
Тому що 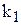 і
і 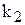 для даної температури постійні, то і їх відношення
для даної температури постійні, то і їх відношення 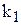 /
/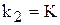 — постійне для тієї ж температури. Величина К називається константою хімічної рівноваги.
— постійне для тієї ж температури. Величина К називається константою хімічної рівноваги.
Рівняння (4.6), що зв’язує швидкість реакції із концентрацією реагуючих речовин, називається кінетичним рівнянням реакції (іншими словами — є вираженням закону діючих мас):
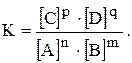
Величина К — найважливіша характеристика оборотної реакції. Константа рівноваги визначається природою реагуючих речовин і не залежить від їх концентрації, але змінюється під впливом температури і тиску (для газуватих речовин).
Константа рівноваги К показує, у скільки разів константа швидкості прямої реакції більше константи швидкості зворотної реакції. У цьому її фізичний смисл. Хімічна рівновага зберігається тільки за сталих умов. Зі зміною концентрацій реагуючих речовин, температури і тиску (для газових реакцій) рівновага порушується, рівноважні концентрації всіх речовин змінюються і встановлюється новий стан рівноваги.
Напрямок зміщення рівноваги визначається принципом рухомої рівноваги Ле Шательє: якщо на систему, що перебуває в стані рівноваги, чиниться будь-який зовнішній вплив (змінюється концентрація, температура, тиск), то він сприяє перебігу тієї із двох протилежних реакцій, яка послаблює цей вплив